人教版高中化学选修5 第三章第二节《醛》课件(共23张PPT)
文档属性
| 名称 | 人教版高中化学选修5 第三章第二节《醛》课件(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 436.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-12 11:09:54 | ||
图片预览








文档简介
(共23张PPT)
第二节 醛
教学目标? ? 1.掌握乙醛的结构及乙醛的氧化反应和还原反应。?
2.了解醛类和甲醛的性质和用途。? 3.熟悉银氨溶液的配制方法。?
1、醛的定义:
从结构上看,由烃基(或氢原子)跟醛基(-CHO)相连而成的化合物叫醛。
一、醛的概念和通式
2、醛的分类:
按醛基数目分:一元醛、二元醛、多元醛。
按烃基饱和程度分:饱和醛、不饱和醛。
按烃基类别分:脂肪醛、芳香醛。
3、饱和一元醛的通式:
CnH2n+1CHO 或 CnH2nO
1、乙醛
(1)分子结构
分子式:C2H4O 结构式:
结构简式:CH3CHO
官能团:醛基—CHO
醛基的写法,不要写成—COH
友情提示
二、醛的性质
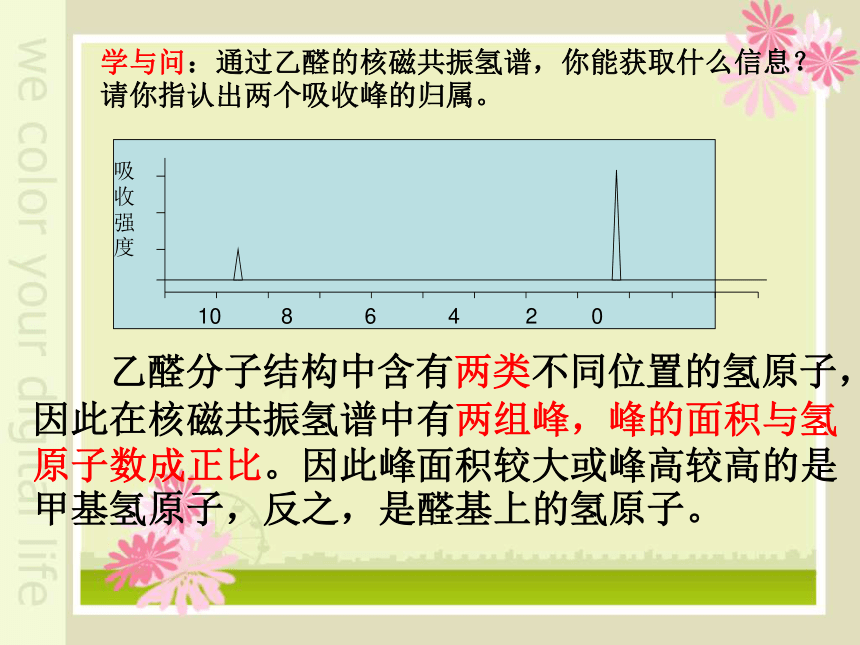
学与问:通过乙醛的核磁共振氢谱,你能获取什么信息?请你指认出两个吸收峰的归属。
乙醛分子结构中含有两类不同位置的氢原子,因此在核磁共振氢谱中有两组峰,峰的面积与氢原子数成正比。因此峰面积较大或峰高较高的是甲基氢原子,反之,是醛基上的氢原子。
(2)乙醛的物理性质
常温下为无色有刺激性气味的液体,
密度比水小,
沸点:20.8℃,
易挥发,易燃烧,
能与水、乙醇、乙醚、氯仿等互溶。
思考:
根据醛基的结构,判断醛基有哪些化学性质?
醛基中碳氧双键发生加成反应,被H2还原为醇
醛基中碳氢键较活泼,能被氧化成相应羧酸
1、加成反应
2、氧化反应
根据加成反应的概念,写出CH3CHO
和H2加成反应的方程式。
这个反应属于氧化反应还是还原反应?
还原反应
(3)乙醛的化学性质
①加成反应
a. 被弱氧化剂氧化
①配制银氨溶液
取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解
Ⅰ、银镜反应
AgNO3+NH3·H2O =AgOH↓+NH4NO3
AgOH+NH3·H2O= [Ag(NH3)2]OH +2H2O
(氢氧化二氨合银)
②氧化反应
注意:
1、碱性环境下,乙醛被氧化成乙酸后又与NH3反应生成乙酸铵。
2、1mol –CHO被氧化,就应有2molAg被还原。
3、可用稀HNO3清洗试管内壁的银镜。
4、银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物质。
氧化剂
还原剂
②水浴加热生成银镜
在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
氧化剂
还原剂
②水浴加热生成银镜
在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
银镜反应有什么应用,有什么工业价值?
应用:
(1)检验醛基的存在
(2)测定醛基的数目
(3)工业上用来制瓶胆和镜子
Ⅱ、与新制的氢氧化铜反应
1、配制新制的Cu(OH)2悬浊液:
在2ml 10% NaOH溶液中滴入2%CuSO4溶液
4~8滴,振荡。
碱必须过量
2、乙醛的氧化:在上述蓝色浊液中加入0.5ml乙
醛溶液,加热至沸腾。
注意:
氢氧化铜溶液一定要新制,
且碱一定要过量。
应用:
(1)检验醛基的存在
(2)医学上检验病人是否患糖尿病
b、 燃烧
c 催化氧化
还原
d. 被酸性KMnO4溶液、溴水等强氧化剂氧化
化学性质
(1)和H2加成被还原成醇
(2)氧化反应
a. 燃烧
b. 催化氧化成羧酸
c. 被弱氧化剂氧化
Ⅰ、银镜反应
Ⅱ、与新制的氢氧化铜反应
d. 使酸性KMnO4溶液和溴水褪色
小结:醛类的化学性质
练习、写出丙醛与下列物质反应的化学方程式:
与银氨溶液反应
与新制的氢氧化铜反应
与氢气反应
2、甲醛(蚁醛)
结构式:
甲醛中有2个活泼氢可被氧化。
分子式:CH2O
结构简式:H—CHO
物理性质:无色、有强烈刺激性气味、
气体,易溶于水
应用:重要的有机合成原料
其水溶液(福尔马林)有杀菌和防腐能力。工业上
主要用于制造酚醛树脂以及多种有机化合物等。
?1mol甲醛最多可以还原得到多少m o l Ag?
即:H2CO3
写出甲醛发生银镜反应,以及与新制的氢氧化铜反应的化学方程式。
注:由于甲醛分子相当于含有2个醛基,所以1mol甲醛发 生银镜反应时最多可生成4molAg
1mol甲醛与新制的氢氧化铜反应最多可生成2molCu2O
1、下列哪些不能使酸性KMnO4溶液褪色?
乙烯、甲烷、苯、 乙酸、甲苯、乙醛、
葡萄糖、SO2、H2S、苯酚、裂化汽油
巩固练习
甲烷、苯、 乙酸
2、已知柠檬醛的结构简式为:
若要检验出其中的碳碳双键,其方法是什么?
1、足量的银氨溶液(或新制的Cu(OH)2)使醛基氧化;
2、再用酸性KMnO4溶液(或溴水)检验碳碳双键,碳碳
双键能使酸性KMnO4溶液(或溴水)褪色。
3、一定量的某饱和一元醛发生银镜反应,析出21.6g银,等量的此醛完全燃烧时生成CO2 0.89L,则此醛是( )
A、乙醛 B、丙醛
C、丁醛 D、2-甲基丙醛
CD
第二节 醛
教学目标? ? 1.掌握乙醛的结构及乙醛的氧化反应和还原反应。?
2.了解醛类和甲醛的性质和用途。? 3.熟悉银氨溶液的配制方法。?
1、醛的定义:
从结构上看,由烃基(或氢原子)跟醛基(-CHO)相连而成的化合物叫醛。
一、醛的概念和通式
2、醛的分类:
按醛基数目分:一元醛、二元醛、多元醛。
按烃基饱和程度分:饱和醛、不饱和醛。
按烃基类别分:脂肪醛、芳香醛。
3、饱和一元醛的通式:
CnH2n+1CHO 或 CnH2nO
1、乙醛
(1)分子结构
分子式:C2H4O 结构式:
结构简式:CH3CHO
官能团:醛基—CHO
醛基的写法,不要写成—COH
友情提示
二、醛的性质
学与问:通过乙醛的核磁共振氢谱,你能获取什么信息?请你指认出两个吸收峰的归属。
乙醛分子结构中含有两类不同位置的氢原子,因此在核磁共振氢谱中有两组峰,峰的面积与氢原子数成正比。因此峰面积较大或峰高较高的是甲基氢原子,反之,是醛基上的氢原子。
(2)乙醛的物理性质
常温下为无色有刺激性气味的液体,
密度比水小,
沸点:20.8℃,
易挥发,易燃烧,
能与水、乙醇、乙醚、氯仿等互溶。
思考:
根据醛基的结构,判断醛基有哪些化学性质?
醛基中碳氧双键发生加成反应,被H2还原为醇
醛基中碳氢键较活泼,能被氧化成相应羧酸
1、加成反应
2、氧化反应
根据加成反应的概念,写出CH3CHO
和H2加成反应的方程式。
这个反应属于氧化反应还是还原反应?
还原反应
(3)乙醛的化学性质
①加成反应
a. 被弱氧化剂氧化
①配制银氨溶液
取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解
Ⅰ、银镜反应
AgNO3+NH3·H2O =AgOH↓+NH4NO3
AgOH+NH3·H2O= [Ag(NH3)2]OH +2H2O
(氢氧化二氨合银)
②氧化反应
注意:
1、碱性环境下,乙醛被氧化成乙酸后又与NH3反应生成乙酸铵。
2、1mol –CHO被氧化,就应有2molAg被还原。
3、可用稀HNO3清洗试管内壁的银镜。
4、银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物质。
氧化剂
还原剂
②水浴加热生成银镜
在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
氧化剂
还原剂
②水浴加热生成银镜
在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
银镜反应有什么应用,有什么工业价值?
应用:
(1)检验醛基的存在
(2)测定醛基的数目
(3)工业上用来制瓶胆和镜子
Ⅱ、与新制的氢氧化铜反应
1、配制新制的Cu(OH)2悬浊液:
在2ml 10% NaOH溶液中滴入2%CuSO4溶液
4~8滴,振荡。
碱必须过量
2、乙醛的氧化:在上述蓝色浊液中加入0.5ml乙
醛溶液,加热至沸腾。
注意:
氢氧化铜溶液一定要新制,
且碱一定要过量。
应用:
(1)检验醛基的存在
(2)医学上检验病人是否患糖尿病
b、 燃烧
c 催化氧化
还原
d. 被酸性KMnO4溶液、溴水等强氧化剂氧化
化学性质
(1)和H2加成被还原成醇
(2)氧化反应
a. 燃烧
b. 催化氧化成羧酸
c. 被弱氧化剂氧化
Ⅰ、银镜反应
Ⅱ、与新制的氢氧化铜反应
d. 使酸性KMnO4溶液和溴水褪色
小结:醛类的化学性质
练习、写出丙醛与下列物质反应的化学方程式:
与银氨溶液反应
与新制的氢氧化铜反应
与氢气反应
2、甲醛(蚁醛)
结构式:
甲醛中有2个活泼氢可被氧化。
分子式:CH2O
结构简式:H—CHO
物理性质:无色、有强烈刺激性气味、
气体,易溶于水
应用:重要的有机合成原料
其水溶液(福尔马林)有杀菌和防腐能力。工业上
主要用于制造酚醛树脂以及多种有机化合物等。
?1mol甲醛最多可以还原得到多少m o l Ag?
即:H2CO3
写出甲醛发生银镜反应,以及与新制的氢氧化铜反应的化学方程式。
注:由于甲醛分子相当于含有2个醛基,所以1mol甲醛发 生银镜反应时最多可生成4molAg
1mol甲醛与新制的氢氧化铜反应最多可生成2molCu2O
1、下列哪些不能使酸性KMnO4溶液褪色?
乙烯、甲烷、苯、 乙酸、甲苯、乙醛、
葡萄糖、SO2、H2S、苯酚、裂化汽油
巩固练习
甲烷、苯、 乙酸
2、已知柠檬醛的结构简式为:
若要检验出其中的碳碳双键,其方法是什么?
1、足量的银氨溶液(或新制的Cu(OH)2)使醛基氧化;
2、再用酸性KMnO4溶液(或溴水)检验碳碳双键,碳碳
双键能使酸性KMnO4溶液(或溴水)褪色。
3、一定量的某饱和一元醛发生银镜反应,析出21.6g银,等量的此醛完全燃烧时生成CO2 0.89L,则此醛是( )
A、乙醛 B、丙醛
C、丁醛 D、2-甲基丙醛
CD
