人教版九年级化学下册:第八单元金属和金属材料(共2课时,29张PPT)
文档属性
| 名称 | 人教版九年级化学下册:第八单元金属和金属材料(共2课时,29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-13 11:12:04 | ||
图片预览





文档简介
(共29张PPT)
(共2课时 )
教学重点难点
金属的化学性质、置换反应
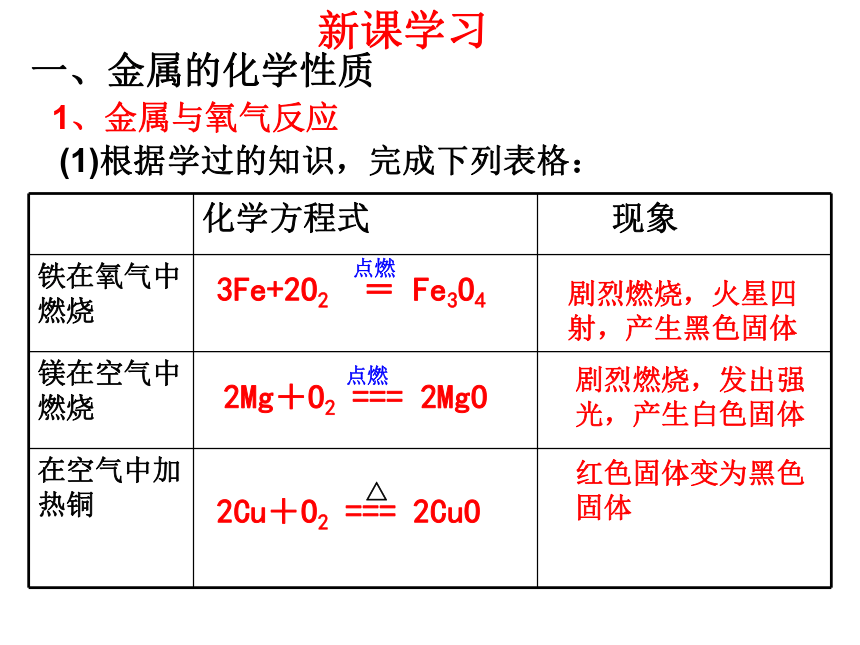
一、金属的化学性质
新课学习
(1)根据学过的知识,完成下列表格:
剧烈燃烧,火星四射,产生黑色固体
剧烈燃烧,发出强光,产生白色固体
红色固体变为黑色固体
1、金属与氧气反应
化学方程式 现象
铁在氧气中燃烧
镁在空气中燃烧
在空气中加热铜
一、金属的化学性质
①为什么生活中常用铝做门窗?
②“真金不怕火炼”说的是金的化学性质_______,不与_______反应。
③镁、铝、铁、铜、金的金属活动性由强到弱的顺序
为:镁、铝______铁、铜______金 (填?或?)
稳定
氧气
(2)阅读教材P9有关内容,完成下列问题:
【结论】 金属 + 氧气 = 金属氧化物
?
?
因为铝与氧气反应产生一层致密的氧化膜,阻止铝进一步氧化,抗腐蚀性好。
二、金属与盐酸、稀硫酸的反应:
[实验1]:将金属镁分别加入到盛盐酸、稀硫酸的试管中,观察现象,用燃烧着的木条判断气体是______。
现象
化学方程式
反应很剧烈,放出气泡速度很快。
反应较剧烈,放出气泡速度较快,
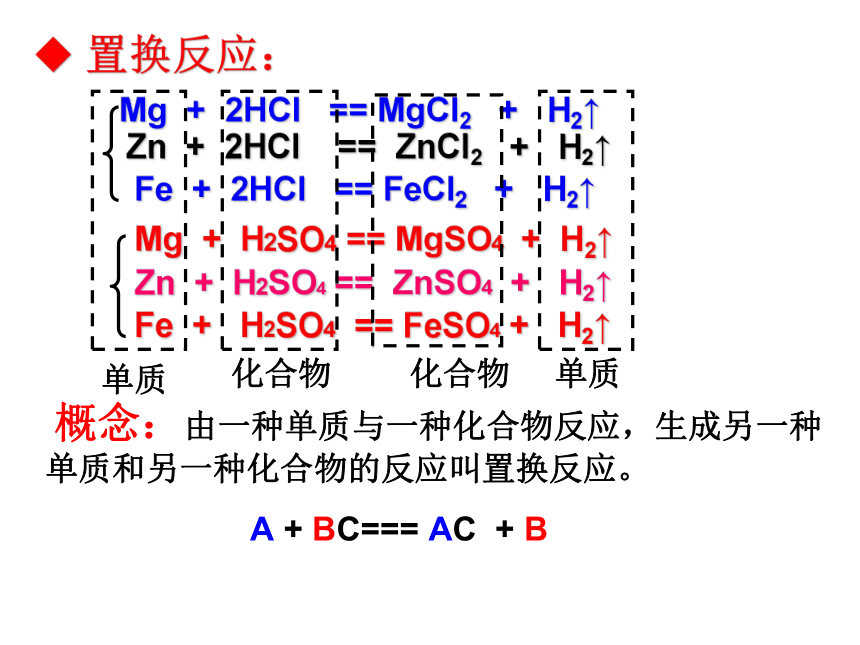
Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
氢气(H2)
氢气(H2)
反应不剧烈,放出气泡速度缓慢。
二、金属与盐酸、稀硫酸的反应:
Fe + 2HCl == FeCl2 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
[实验3]:将金属铁分别加入到盛盐酸、稀硫酸的试管中,观察现象,用燃烧着的木条判断气体是________。
现象
化学方程式
氢气(H2)
不反应
不反应,无气泡放出。
【结论】(1)有些金属与酸反应生成H2
(2)金属活泼性由强到弱: Mg>Zn>Fe > Cu
概念:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫置换反应。
A + BC=== AC + B
单质
化合物
单质
化合物
下列属于置换反应的是( )
A、CO + CuO=== Cu + CO2
B、CH4 + 2O2 ===CO2 + 2H2O
C、C + 2CuO ==== 2Cu + CO2 ↑
D、CaCO3 +2HCl === CaCl2 + CO2 ↑+ H2O
F、H2 + CuO === Cu + H2O
E、2KMnO4 ==== K2MnO4 + MnO2 + O2 ↑
G、Fe + CuSO4 === FeSO4 + Cu
△
△
△
点燃
高温
C F G
思考与练习
本课小结
一、金属的化学性质
1.与氧气反应
2.与酸的
反应
Mg + 2HCl == MgCl2 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2↑
Fe + 2HCl == FeCl2 + H2↑
二.置换反应:
一种单质与一种化合物反应生成另一种单质和另一种化合物的反应
巩固练习
1.生铁与过量的硫酸溶液反应,有少量的不溶物出
现,该不溶物主要是:
A .Fe
B .C C . FeSO4? D . Fe2(SO4)3
2.把金属片插入稀盐酸中,没有气泡放出的是:
A 铜 B 锌 C 铁 D 镁
B
3.下面是生产单质硅过程中的一个重要反应:
SiO2 + 2C ==== Si +2CO↑,该反应的基本类型是
A.化合反应 B.分解反应
C.置换反应 D.氧化反应
高温
A
C
4.下列各组物质反应时,剧烈燃烧,火星四射并生
成黑色固体的是:
A.铁在氧气中燃烧? B.镁在氧气中燃烧 ?
C.碳在氧气中燃烧? D.硫在空气中燃烧
5.请写出铝与稀盐酸、稀硫酸反应的化学方程式。
2Al + 3H2SO4 === Al2(SO4 )3+ 3H2↑
2Al + 6HCl === 2AlCl3+ 3H2↑
6.黄铜(铜、锌合金)外观和黄金极为相似,有些不法分子常以黄铜冒充黄金进行诈骗。你能帮助警察鉴别真假黄金吗?
物理方法:
化学方法:
用手感受轻重。(即感受密度大小)
黄铜能与酸反应放出气体,而金不活泼不能与酸反应。
A
7. 相同质量的Al、Mg、Zn、Fe和足量的稀硫酸反应,
产生氢气的质量最多的是:
A. Zn B. Fe C. Mg D. Al
8.下列物质可由金属直接与酸发生置换反应制取的是:
A. FeCl3 B. ZnCl2 C. CuSO4 D. CuCl2
9. 相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。
Mg
Fe
Zn
a
b
c
m
t
D
B
10.构建知识网络是一种重要的学习方法。右图是关于铁
化学性质的知识网络(“→”表示一种物质转化为另一种
物质),其中B是密度最小的气体,C为红色固体单质。
请回答下列问题:
(1)A物质的化学式为 。
(2)B物质的一种用途是 。
(3)反应②还需要的一种反应物是 _____(填化学式)。
(4)写出反应③的方程式,并注明基本反应类型:
( )。
Fe3O4
燃料
CO或C
Fe + CuSO4 === FeSO4 + Cu
置换反应
作业
1、教材P13 1,做在书本上
3, 4, 8,做在作业本上
2、《课后作业》对应练习
教学重点难点
1 .金属活动顺序。
2.会运用金属活动顺序解决问题。(难点)
课前练习
1、下列属于置换反应的是( )
3CO + Fe2O3 ====2Fe + 3CO2
高温
B. Fe + CuSO4 === FeSO4 + Cu
C. 2NO + O2 == 2NO2
D. CH4 + O2 === CO2 + 2H2O
点燃
2、将下列金属与稀盐酸反应,产生气泡最快的是____较快的是___,较慢的是____无气泡产生的是______。
四种金属活动性由强到弱顺序是______________。
A. Fe B. Mg C.Zn D.Cu
B
B
C
A
D
Mg>Zn>Fe>Cu
3.白蚁能分泌出蚁酸,其化学性质与盐酸、硫酸相似。下列物质中最不容易被蚁酸腐蚀的是( )
A.镀锌水管 B.铜制塑管
C.大理石栏杆 D.铝合金门窗
B
4.下列不能作为判断Mg、Fe、Cu三种金属活动性强弱的是( )
在纯氧中燃烧的现象
金属导电性强弱
C.三种金属发现和利用年代先后顺序
D.与盐酸反应速度快慢程度
B
5.在“南海一号”打捞的文物中,“鎏金龙纹金手镯”光彩夺目、完好无损,铜镜表面有铜锈,铁器表面锈迹斑斑,残存很少,说明金、银、铁这三种金属活动顺序由强到弱为_____________________。
Fe>Ag>Au
6. 要除去铜粉中的少量铁粉,不可以用下列试剂
中的( )
A.水 B.稀盐酸
C.磁铁 D.稀硫酸
A
回忆:将铁钉放入蓝色硫酸铜溶液中的现象是___________________________________,
化学方程式为_______________________.
上述反应说明铁的金属性比铜_____(填活泼或不活泼),该反应属于________反应。
铁钉表面有一层红色物质,溶液由蓝色变为浅绿色
Fe + CuSO4 === FeSO4 + Cu
活泼
置换
三、金属活动性顺序
(1)将铝丝放硫酸铜溶液中.观察现象.
(2)铜丝放入硝酸银溶液中.观察现象.
(3)铜丝放入硫酸铝溶液中,观察现象。
产生红色固体,蓝色溶液变无色
产生银白色固体,无色溶液变成蓝色
无现象
不反应
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
置换
【探究实验】
三、金属活动性顺序
②Al、Cu、Ag金属活动性由强到弱:_____________
结论
①上述(1)(2)都是_______反应。
Al >Cu>Ag
现象 化学方程式
(1)
(2)
(3)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
三、金属活动性顺序
金属活动性从左到右逐渐由强减弱
活泼金属
较活泼金属
不活泼金属
钾 钙 钠 镁 铝,锌 铁 锡 铅(氢),铜 汞 银 铂 金
四、金属活动顺序应用
1、判断金属是否与酸反应生成氢气:
原则:在金属活动顺序中只有排在氢前面的金属才能与置换酸中的氢产生氢气。
练习:写出下列金属能与稀盐酸反应的化学方程式,不反应的说明理由。
(1)铜 (2)铁 (3)锌 (4)汞
√
√
×
×
(2)(3)能反应:
Zn + 2HCl == ZnCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑
(1)(4)不反应,因为在金属活动顺序里铜、银排在氢后面。
2、判断金属是否与盐溶液反应:
原则:在金属活动顺序中排在前面的金属能将排在后面的金属从它们的化合物(盐)溶液中置换出来
判断下列各组物质能否发生反应,能反应的写出化学方程式,不能反应的说明理由。
练习:
(1)铜和硫酸锌溶液______________________
(2)锌和硫酸亚铁溶液_____________________
(3)镁和硫酸铜溶液_______________________
(4)铁和氯化铝溶液________________________
不反应,在金属活动顺序中铜排在锌的后面。
Zn + FeSO4 = ZnSO4+ Fe
Mg + CuSO4 = MgSO4+ Cu
不反应,在金属活动顺序中铁排在铝的后面。
3、判断金属活动性强弱:
1.有X、Y、Z三种金属。X、Y、Z分别放入稀盐酸中,X溶解并放出氢气,Y、Z无变化;将Y放入Z的化合物溶液中无变化;Z放入Y的化合物溶液中有Y析出:则X、Y、Z的活动性由强到弱的顺序是___________________。
原则:在金属活动顺序中金属的位置越靠前,它的活动性就越强
练习:
X>Z>Y
3、有下列三组物质:①锌、铜、稀硫酸②铝、锌、硫
酸铜溶液③铝、银、硫酸铜溶液,其中只用同组内物质
就能判断同组金属活动性顺序的是( )
A ①② B ②③ C ①③ D ①②③
C
C
4、在CuCl2和NaCl的混合溶液中加入过量的Zn粉,充分反应后过滤,留在滤纸上的固体( ) A、只有Zn B、只有Cu C、有Cu和Na D、有Cu和Zn
D
3、判断金属与酸或盐溶液反应后的质量变化
(1)镁加入稀盐酸后,溶液质量________(填增大或减少,下同), 镁的质量_______。
增大
减小
减小
增大
增大
减小
3、判断金属与酸或盐溶液反应后的质量变化
(3)在下列溶液中分别放入铁粒,一段时间后把锌粒取
出,溶液质量减少的是( )
A.NaCl溶液 B.硫酸铜溶液
C.稀盐酸 D.稀硫酸
B
作业
1、教材P13 1,2,6, 7 做在书本上
3,4,5,8,做在作业本上
2、《课后作业》对应练习
(共2课时 )
教学重点难点
金属的化学性质、置换反应
一、金属的化学性质
新课学习
(1)根据学过的知识,完成下列表格:
剧烈燃烧,火星四射,产生黑色固体
剧烈燃烧,发出强光,产生白色固体
红色固体变为黑色固体
1、金属与氧气反应
化学方程式 现象
铁在氧气中燃烧
镁在空气中燃烧
在空气中加热铜
一、金属的化学性质
①为什么生活中常用铝做门窗?
②“真金不怕火炼”说的是金的化学性质_______,不与_______反应。
③镁、铝、铁、铜、金的金属活动性由强到弱的顺序
为:镁、铝______铁、铜______金 (填?或?)
稳定
氧气
(2)阅读教材P9有关内容,完成下列问题:
【结论】 金属 + 氧气 = 金属氧化物
?
?
因为铝与氧气反应产生一层致密的氧化膜,阻止铝进一步氧化,抗腐蚀性好。
二、金属与盐酸、稀硫酸的反应:
[实验1]:将金属镁分别加入到盛盐酸、稀硫酸的试管中,观察现象,用燃烧着的木条判断气体是______。
现象
化学方程式
反应很剧烈,放出气泡速度很快。
反应较剧烈,放出气泡速度较快,
Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
氢气(H2)
氢气(H2)
反应不剧烈,放出气泡速度缓慢。
二、金属与盐酸、稀硫酸的反应:
Fe + 2HCl == FeCl2 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
[实验3]:将金属铁分别加入到盛盐酸、稀硫酸的试管中,观察现象,用燃烧着的木条判断气体是________。
现象
化学方程式
氢气(H2)
不反应
不反应,无气泡放出。
【结论】(1)有些金属与酸反应生成H2
(2)金属活泼性由强到弱: Mg>Zn>Fe > Cu
概念:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫置换反应。
A + BC=== AC + B
单质
化合物
单质
化合物
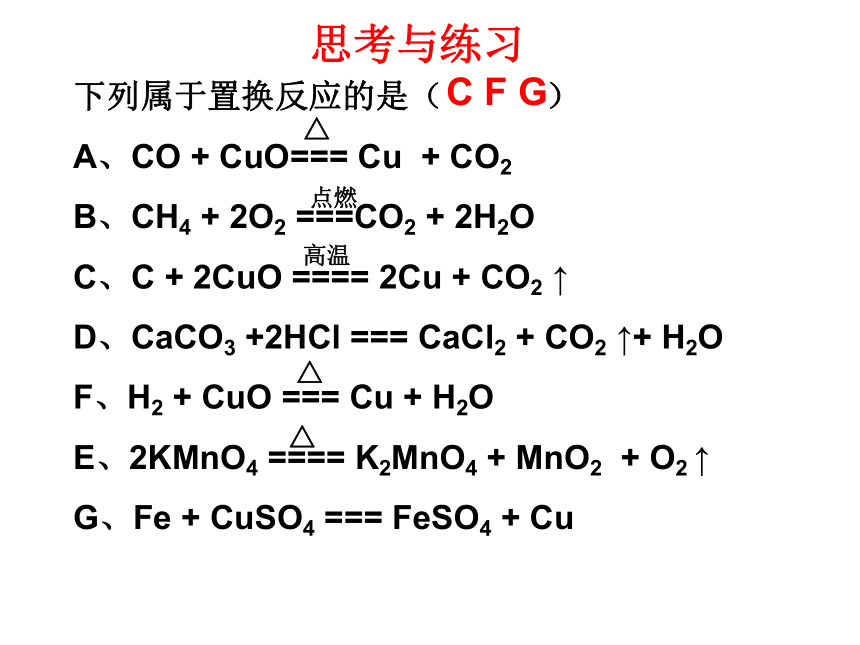
下列属于置换反应的是( )
A、CO + CuO=== Cu + CO2
B、CH4 + 2O2 ===CO2 + 2H2O
C、C + 2CuO ==== 2Cu + CO2 ↑
D、CaCO3 +2HCl === CaCl2 + CO2 ↑+ H2O
F、H2 + CuO === Cu + H2O
E、2KMnO4 ==== K2MnO4 + MnO2 + O2 ↑
G、Fe + CuSO4 === FeSO4 + Cu
△
△
△
点燃
高温
C F G
思考与练习
本课小结
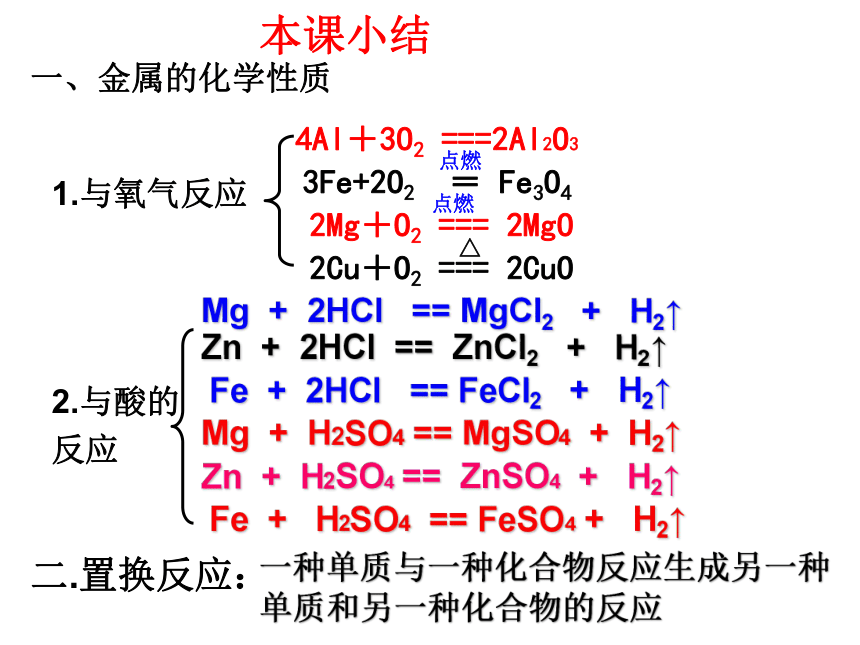
一、金属的化学性质
1.与氧气反应
2.与酸的
反应
Mg + 2HCl == MgCl2 + H2↑
Zn + H2SO4 == ZnSO4 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
Zn + 2HCl == ZnCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2↑
Fe + 2HCl == FeCl2 + H2↑
二.置换反应:
一种单质与一种化合物反应生成另一种单质和另一种化合物的反应
巩固练习
1.生铁与过量的硫酸溶液反应,有少量的不溶物出
现,该不溶物主要是:
A .Fe
B .C C . FeSO4? D . Fe2(SO4)3
2.把金属片插入稀盐酸中,没有气泡放出的是:
A 铜 B 锌 C 铁 D 镁
B
3.下面是生产单质硅过程中的一个重要反应:
SiO2 + 2C ==== Si +2CO↑,该反应的基本类型是
A.化合反应 B.分解反应
C.置换反应 D.氧化反应
高温
A
C
4.下列各组物质反应时,剧烈燃烧,火星四射并生
成黑色固体的是:
A.铁在氧气中燃烧? B.镁在氧气中燃烧 ?
C.碳在氧气中燃烧? D.硫在空气中燃烧
5.请写出铝与稀盐酸、稀硫酸反应的化学方程式。
2Al + 3H2SO4 === Al2(SO4 )3+ 3H2↑
2Al + 6HCl === 2AlCl3+ 3H2↑
6.黄铜(铜、锌合金)外观和黄金极为相似,有些不法分子常以黄铜冒充黄金进行诈骗。你能帮助警察鉴别真假黄金吗?
物理方法:
化学方法:
用手感受轻重。(即感受密度大小)
黄铜能与酸反应放出气体,而金不活泼不能与酸反应。
A
7. 相同质量的Al、Mg、Zn、Fe和足量的稀硫酸反应,
产生氢气的质量最多的是:
A. Zn B. Fe C. Mg D. Al
8.下列物质可由金属直接与酸发生置换反应制取的是:
A. FeCl3 B. ZnCl2 C. CuSO4 D. CuCl2
9. 相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。
Mg
Fe
Zn
a
b
c
m
t
D
B
10.构建知识网络是一种重要的学习方法。右图是关于铁
化学性质的知识网络(“→”表示一种物质转化为另一种
物质),其中B是密度最小的气体,C为红色固体单质。
请回答下列问题:
(1)A物质的化学式为 。
(2)B物质的一种用途是 。
(3)反应②还需要的一种反应物是 _____(填化学式)。
(4)写出反应③的方程式,并注明基本反应类型:
( )。
Fe3O4
燃料
CO或C
Fe + CuSO4 === FeSO4 + Cu
置换反应
作业
1、教材P13 1,做在书本上
3, 4, 8,做在作业本上
2、《课后作业》对应练习
教学重点难点
1 .金属活动顺序。
2.会运用金属活动顺序解决问题。(难点)
课前练习
1、下列属于置换反应的是( )
3CO + Fe2O3 ====2Fe + 3CO2
高温
B. Fe + CuSO4 === FeSO4 + Cu
C. 2NO + O2 == 2NO2
D. CH4 + O2 === CO2 + 2H2O
点燃
2、将下列金属与稀盐酸反应,产生气泡最快的是____较快的是___,较慢的是____无气泡产生的是______。
四种金属活动性由强到弱顺序是______________。
A. Fe B. Mg C.Zn D.Cu
B
B
C
A
D
Mg>Zn>Fe>Cu
3.白蚁能分泌出蚁酸,其化学性质与盐酸、硫酸相似。下列物质中最不容易被蚁酸腐蚀的是( )
A.镀锌水管 B.铜制塑管
C.大理石栏杆 D.铝合金门窗
B
4.下列不能作为判断Mg、Fe、Cu三种金属活动性强弱的是( )
在纯氧中燃烧的现象
金属导电性强弱
C.三种金属发现和利用年代先后顺序
D.与盐酸反应速度快慢程度
B
5.在“南海一号”打捞的文物中,“鎏金龙纹金手镯”光彩夺目、完好无损,铜镜表面有铜锈,铁器表面锈迹斑斑,残存很少,说明金、银、铁这三种金属活动顺序由强到弱为_____________________。
Fe>Ag>Au
6. 要除去铜粉中的少量铁粉,不可以用下列试剂
中的( )
A.水 B.稀盐酸
C.磁铁 D.稀硫酸
A
回忆:将铁钉放入蓝色硫酸铜溶液中的现象是___________________________________,
化学方程式为_______________________.
上述反应说明铁的金属性比铜_____(填活泼或不活泼),该反应属于________反应。
铁钉表面有一层红色物质,溶液由蓝色变为浅绿色
Fe + CuSO4 === FeSO4 + Cu
活泼
置换
三、金属活动性顺序
(1)将铝丝放硫酸铜溶液中.观察现象.
(2)铜丝放入硝酸银溶液中.观察现象.
(3)铜丝放入硫酸铝溶液中,观察现象。
产生红色固体,蓝色溶液变无色
产生银白色固体,无色溶液变成蓝色
无现象
不反应
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
置换
【探究实验】
三、金属活动性顺序
②Al、Cu、Ag金属活动性由强到弱:_____________
结论
①上述(1)(2)都是_______反应。
Al >Cu>Ag
现象 化学方程式
(1)
(2)
(3)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
三、金属活动性顺序
金属活动性从左到右逐渐由强减弱
活泼金属
较活泼金属
不活泼金属
钾 钙 钠 镁 铝,锌 铁 锡 铅(氢),铜 汞 银 铂 金
四、金属活动顺序应用
1、判断金属是否与酸反应生成氢气:
原则:在金属活动顺序中只有排在氢前面的金属才能与置换酸中的氢产生氢气。
练习:写出下列金属能与稀盐酸反应的化学方程式,不反应的说明理由。
(1)铜 (2)铁 (3)锌 (4)汞
√
√
×
×
(2)(3)能反应:
Zn + 2HCl == ZnCl2 + H2↑
Fe + 2HCl == FeCl2 + H2↑
(1)(4)不反应,因为在金属活动顺序里铜、银排在氢后面。
2、判断金属是否与盐溶液反应:
原则:在金属活动顺序中排在前面的金属能将排在后面的金属从它们的化合物(盐)溶液中置换出来
判断下列各组物质能否发生反应,能反应的写出化学方程式,不能反应的说明理由。
练习:
(1)铜和硫酸锌溶液______________________
(2)锌和硫酸亚铁溶液_____________________
(3)镁和硫酸铜溶液_______________________
(4)铁和氯化铝溶液________________________
不反应,在金属活动顺序中铜排在锌的后面。
Zn + FeSO4 = ZnSO4+ Fe
Mg + CuSO4 = MgSO4+ Cu
不反应,在金属活动顺序中铁排在铝的后面。
3、判断金属活动性强弱:
1.有X、Y、Z三种金属。X、Y、Z分别放入稀盐酸中,X溶解并放出氢气,Y、Z无变化;将Y放入Z的化合物溶液中无变化;Z放入Y的化合物溶液中有Y析出:则X、Y、Z的活动性由强到弱的顺序是___________________。
原则:在金属活动顺序中金属的位置越靠前,它的活动性就越强
练习:
X>Z>Y
3、有下列三组物质:①锌、铜、稀硫酸②铝、锌、硫
酸铜溶液③铝、银、硫酸铜溶液,其中只用同组内物质
就能判断同组金属活动性顺序的是( )
A ①② B ②③ C ①③ D ①②③
C
C
4、在CuCl2和NaCl的混合溶液中加入过量的Zn粉,充分反应后过滤,留在滤纸上的固体( ) A、只有Zn B、只有Cu C、有Cu和Na D、有Cu和Zn
D
3、判断金属与酸或盐溶液反应后的质量变化
(1)镁加入稀盐酸后,溶液质量________(填增大或减少,下同), 镁的质量_______。
增大
减小
减小
增大
增大
减小
3、判断金属与酸或盐溶液反应后的质量变化
(3)在下列溶液中分别放入铁粒,一段时间后把锌粒取
出,溶液质量减少的是( )
A.NaCl溶液 B.硫酸铜溶液
C.稀盐酸 D.稀硫酸
B
作业
1、教材P13 1,2,6, 7 做在书本上
3,4,5,8,做在作业本上
2、《课后作业》对应练习
同课章节目录
