《课题2 金属的化学性质》课件2(21张PPT)
文档属性
| 名称 | 《课题2 金属的化学性质》课件2(21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-13 00:00:00 | ||
图片预览







文档简介
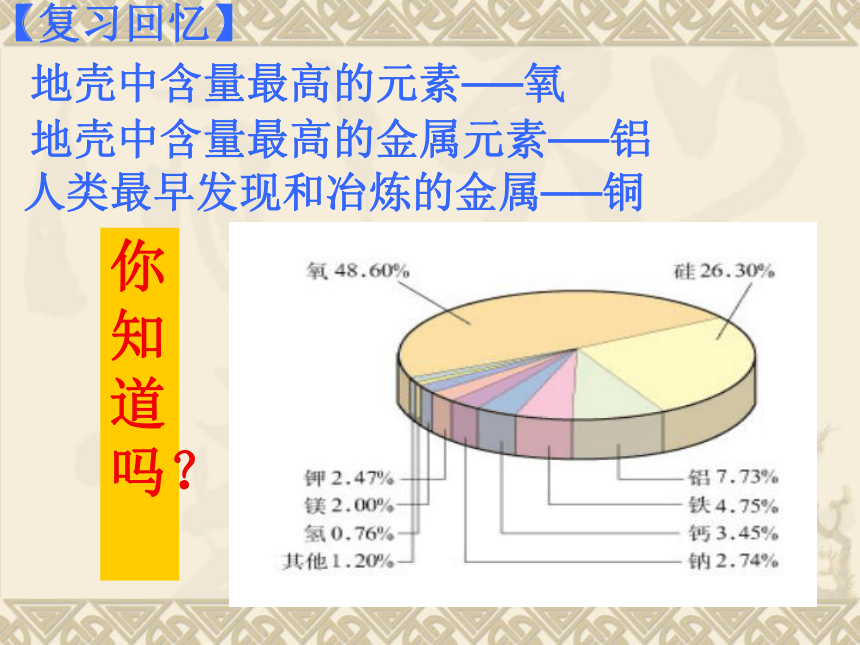
课件21张PPT。第八章 金属和金属材料课题2 金属的化学性质地壳中含量最高的金属元素──铝 地壳中含量最高的元素──氧 【复习回忆】你知道吗?人类最早发现和冶炼的金属──铜⑴?熔点最低的金属——汞。熔点-39、3℃,常温呈液态。
⑵?熔点最高的金属——钨。熔点3410℃,常用作灯丝。
⑶?地壳中含量最多的金属元素——铝。日常生活中,用于保护
钢铁制品所使用的 “银粉”实际上是金属铝的粉末。 ⑷?导电性最强的金属——银。家用热水瓶内壁上的金属是银。 ⑸?制造新型高速飞机最重要的金属——钛。被科学家称为
“二十一世纪的金属”或“未来的钢铁”。 ⑹?海水中储量最大的放射性元素——铀。 ⑺?展性最强的金属——金。最薄的金厚度只有1/10000mm。 ⑻?延性最好的金属——铂。最细的铂丝直径只有1/5000mm。
常说的“白金”首饰是用铂加工而成的。【常识资料】2、良好的__________性金属有哪些物理性质?1、金属的颜色、光泽
绝大多数金属都是_____色,具有金属光泽,少数金属是特殊颜色如铜是______,金是_______。银白紫红色导电、导热3、延展性
延性:拉成细丝
展性:压成薄片金黄色【思考与交流】钠镁铝金属原子最外层电子
数小于4,易失去电
子,表现还原性,在
反应中做还原剂。金属易发生的反应:与氧气等非金属单质反应、
与酸反应、与盐溶液反应。【思考与交流】分析下面一些化学反应的图片,写出化学方程式(3) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag(4) Mg + 2HCl = MgCl2 + H2↑(1) 2Al + 3CuSO4 = 3Cu + Al2(SO4)3铜树镁条燃烧银树镁条和盐酸【思考与交流】金 属 的 通 性物理性质:不透明有金属光泽
导电、导热性、延
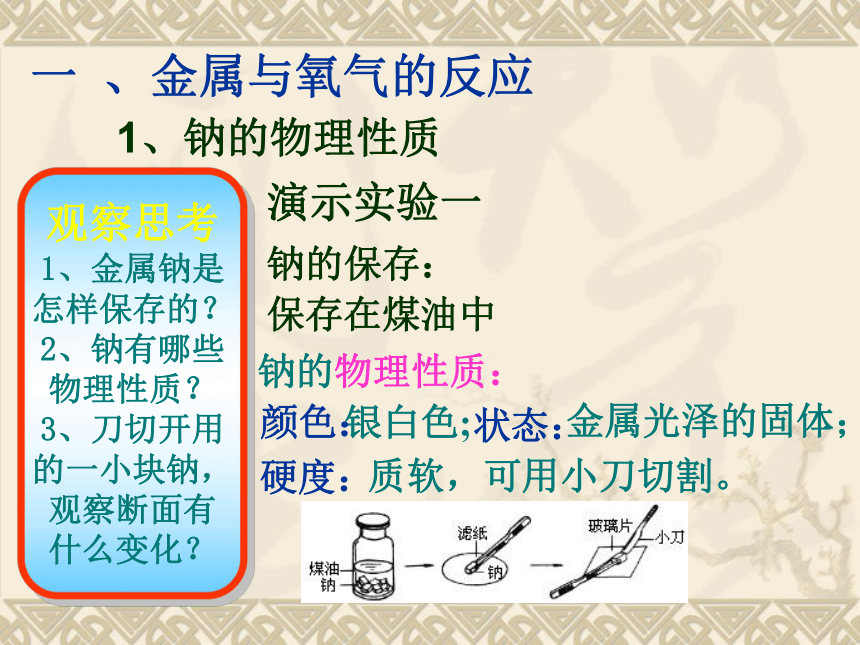
展性。化学性质:易失电子,具有还原性。【思考与交流】引言:金属在空气中有些能稳定存在、有些加热时能剧烈反应、有些高温下也不反应,那么金属与空气作用到底有什么规律呢?演示实验一钠的保存:
保存在煤油中质软,可用小刀切割。银白色;金属光泽的固体;颜色:状态:硬度:一 、金属与氧气的反应观察思考
1、金属钠是
怎样保存的?
2、钠有哪些
物理性质?
3、刀切开用
的一小块钠,
观察断面有
什么变化?钠的物理性质:1、钠的物理性质现象: 切开的光亮的金属断面很快地变暗。反应:结论:常温下易与空气中的氧气反应2、钠与氧气的反应银白色的钠表面很快变暗,说明钠很 容易被氧气氧化(常温下)那么在空气中加热时钠又会发生什么变化?说明:钠比铁镁铝等金属活泼的多。
因此,在实验室中把钠保存在石蜡油或煤油
中,以隔绝空气与钠的反应。观察思考
把一小块
钠放在石
棉网上加
热有什么
现象?反应:思考:Na2O和Na2O2 哪个稳定?Na与O2反应条件的不同,产物不同。现象:钠熔化成小球状;
剧烈燃烧、产生黄色火焰;
生成淡黄色固体物质
(过氧化钠)。Na2O2 稳定实验二1、1molNa与O2完全反应分别生成Na2O或Na2O2,转移电子的物质的量分别是______、______。练一练2、Na与O2反应若转移电子的物质的量为1、2mol,则分别生成Na2O或Na2O2的物质的量是________或________。3、0.1molNa与O2完全反应生成固体物质3、5g,则生成物为______________。1mol1mol0.6mol0.6molNa2O和Na2O2 大多数金属在空气中都可与氧气发生反应,金属是还原剂,氧气是氧化剂。活泼金属在空气中易生成氧化膜,有些氧化膜疏松不能保护内层金属,如钠、铁等;有些氧化膜致密,可以保护内层金属不被继续氧化,如镁、铝表面的氧化层等。在点燃镁带前,常需要用砂纸打磨,这样点燃起来会容易一些。铝的情况到底如何呢?【总结引入】金属+氧气 →金属氧化物【科学探究】实验现象:铝箔熔化,失去光泽,熔化的铝并不滴落(打磨后的铝箔加热现象相同)实验结论:铝是一种活泼金属,在常温下,易与氧气反应,生成一层致密而坚固的氧化物薄膜。铝是一种活泼金属,易与氧气发生反应,3、铝与氧气的反应演示加热铝箔的实验:1、铝箔不打磨;2、铝箔打磨;解释现象:构成薄膜的Al2O3的熔点(2050℃)高于Al的熔点(660℃),包在铝的外面使融化的液态铝不会掉落下来。 铝制品在日常生活中有广泛的用途,这是因为铝制品表面总是覆盖着氧化膜保护层,使内层的铝不被进一步氧化,这就是活泼金属铝在空气中稳定存在的原因。 金属元素原子的最外层电子较少,容易失去,单质往往表现出还原性,不但可与氧气反应,还可与其它重要非金属Cl2、S、Br2等非金属单质反应,生成相应的无氧酸盐。知识延伸练一练1、写出钠、铝、铁、铜分别与Cl2、S的反应
的化学方程式: 2、取22g铜镁合金在Cl2中燃烧,完全反应后消
耗标准状况Cl2的体积为11、2L,则合金中铜
和镁的原子个数比为__________。3、取一小块金属钠,放在燃烧匙里加热,下列
实验现象正确的描述是( )
①金属钠先熔化; ②燃烧后得白色固体;
③燃烧时火焰为黄色; ④燃烧后生成淡黄色
固体物质
A、①② B、①②③ C、①③④ D、②④C1:14、向一小烧杯中分别加入等体积的水和煤油,片刻后
再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观
察到的现象是 A5、一块表面已被氧化为氧化钠的钠块5、4g,投入50g水
中,最多能产生0、10g气体,则原来被氧化的钠是 A、2、3g??????B、3、1g????????C、4、6g??????? D、5、3gA6、将一小块金属钠久置于空气中,有下列现象:①生成
白色粉末;②变暗;③生成白色固体;④发生潮解变
为液体,这些现象的先后顺序是 A、①②③④??? B、④③②① C、②③④①?? D、①③④②C金属的性质物理性质:不透明有金属光泽
导电、导热性、延
展性。化学性质:易与O2、Cl2、S等非金属反应,表现还原性。小 结再见
钢铁制品所使用的 “银粉”实际上是金属铝的粉末。 ⑷?导电性最强的金属——银。家用热水瓶内壁上的金属是银。 ⑸?制造新型高速飞机最重要的金属——钛。被科学家称为
“二十一世纪的金属”或“未来的钢铁”。 ⑹?海水中储量最大的放射性元素——铀。 ⑺?展性最强的金属——金。最薄的金厚度只有1/10000mm。 ⑻?延性最好的金属——铂。最细的铂丝直径只有1/5000mm。
常说的“白金”首饰是用铂加工而成的。【常识资料】2、良好的__________性金属有哪些物理性质?1、金属的颜色、光泽
绝大多数金属都是_____色,具有金属光泽,少数金属是特殊颜色如铜是______,金是_______。银白紫红色导电、导热3、延展性
延性:拉成细丝
展性:压成薄片金黄色【思考与交流】钠镁铝金属原子最外层电子
数小于4,易失去电
子,表现还原性,在
反应中做还原剂。金属易发生的反应:与氧气等非金属单质反应、
与酸反应、与盐溶液反应。【思考与交流】分析下面一些化学反应的图片,写出化学方程式(3) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag(4) Mg + 2HCl = MgCl2 + H2↑(1) 2Al + 3CuSO4 = 3Cu + Al2(SO4)3铜树镁条燃烧银树镁条和盐酸【思考与交流】金 属 的 通 性物理性质:不透明有金属光泽
导电、导热性、延
展性。化学性质:易失电子,具有还原性。【思考与交流】引言:金属在空气中有些能稳定存在、有些加热时能剧烈反应、有些高温下也不反应,那么金属与空气作用到底有什么规律呢?演示实验一钠的保存:
保存在煤油中质软,可用小刀切割。银白色;金属光泽的固体;颜色:状态:硬度:一 、金属与氧气的反应观察思考
1、金属钠是
怎样保存的?
2、钠有哪些
物理性质?
3、刀切开用
的一小块钠,
观察断面有
什么变化?钠的物理性质:1、钠的物理性质现象: 切开的光亮的金属断面很快地变暗。反应:结论:常温下易与空气中的氧气反应2、钠与氧气的反应银白色的钠表面很快变暗,说明钠很 容易被氧气氧化(常温下)那么在空气中加热时钠又会发生什么变化?说明:钠比铁镁铝等金属活泼的多。
因此,在实验室中把钠保存在石蜡油或煤油
中,以隔绝空气与钠的反应。观察思考
把一小块
钠放在石
棉网上加
热有什么
现象?反应:思考:Na2O和Na2O2 哪个稳定?Na与O2反应条件的不同,产物不同。现象:钠熔化成小球状;
剧烈燃烧、产生黄色火焰;
生成淡黄色固体物质
(过氧化钠)。Na2O2 稳定实验二1、1molNa与O2完全反应分别生成Na2O或Na2O2,转移电子的物质的量分别是______、______。练一练2、Na与O2反应若转移电子的物质的量为1、2mol,则分别生成Na2O或Na2O2的物质的量是________或________。3、0.1molNa与O2完全反应生成固体物质3、5g,则生成物为______________。1mol1mol0.6mol0.6molNa2O和Na2O2 大多数金属在空气中都可与氧气发生反应,金属是还原剂,氧气是氧化剂。活泼金属在空气中易生成氧化膜,有些氧化膜疏松不能保护内层金属,如钠、铁等;有些氧化膜致密,可以保护内层金属不被继续氧化,如镁、铝表面的氧化层等。在点燃镁带前,常需要用砂纸打磨,这样点燃起来会容易一些。铝的情况到底如何呢?【总结引入】金属+氧气 →金属氧化物【科学探究】实验现象:铝箔熔化,失去光泽,熔化的铝并不滴落(打磨后的铝箔加热现象相同)实验结论:铝是一种活泼金属,在常温下,易与氧气反应,生成一层致密而坚固的氧化物薄膜。铝是一种活泼金属,易与氧气发生反应,3、铝与氧气的反应演示加热铝箔的实验:1、铝箔不打磨;2、铝箔打磨;解释现象:构成薄膜的Al2O3的熔点(2050℃)高于Al的熔点(660℃),包在铝的外面使融化的液态铝不会掉落下来。 铝制品在日常生活中有广泛的用途,这是因为铝制品表面总是覆盖着氧化膜保护层,使内层的铝不被进一步氧化,这就是活泼金属铝在空气中稳定存在的原因。 金属元素原子的最外层电子较少,容易失去,单质往往表现出还原性,不但可与氧气反应,还可与其它重要非金属Cl2、S、Br2等非金属单质反应,生成相应的无氧酸盐。知识延伸练一练1、写出钠、铝、铁、铜分别与Cl2、S的反应
的化学方程式: 2、取22g铜镁合金在Cl2中燃烧,完全反应后消
耗标准状况Cl2的体积为11、2L,则合金中铜
和镁的原子个数比为__________。3、取一小块金属钠,放在燃烧匙里加热,下列
实验现象正确的描述是( )
①金属钠先熔化; ②燃烧后得白色固体;
③燃烧时火焰为黄色; ④燃烧后生成淡黄色
固体物质
A、①② B、①②③ C、①③④ D、②④C1:14、向一小烧杯中分别加入等体积的水和煤油,片刻后
再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观
察到的现象是 A5、一块表面已被氧化为氧化钠的钠块5、4g,投入50g水
中,最多能产生0、10g气体,则原来被氧化的钠是 A、2、3g??????B、3、1g????????C、4、6g??????? D、5、3gA6、将一小块金属钠久置于空气中,有下列现象:①生成
白色粉末;②变暗;③生成白色固体;④发生潮解变
为液体,这些现象的先后顺序是 A、①②③④??? B、④③②① C、②③④①?? D、①③④②C金属的性质物理性质:不透明有金属光泽
导电、导热性、延
展性。化学性质:易与O2、Cl2、S等非金属反应,表现还原性。小 结再见
同课章节目录
