2020年人教版九年级化学下册课件:实验活动 4 金属的物理性质和某些化学性质 (共22张PPT)
文档属性
| 名称 | 2020年人教版九年级化学下册课件:实验活动 4 金属的物理性质和某些化学性质 (共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 495.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-14 17:32:25 | ||
图片预览








文档简介
(共22张PPT)
实验活动4
金属的物理性质和某些化学性质
【实验目的】
1.巩固和加深对金属性质的认识。
2.设计并进行实验,比较金属的活动性,并对其它实验方案进行评价。
3.归纳比较金属活动性的常用方法。
4.养成及时记录实验现象的习惯,学会规范书写实验报告。
实验活动4
金属的物理性质和某些化学性质
【实验用品】
试管、酒精灯、坩埚钳、电池、导线、小灯泡、火柴、木条
镁条、铝片、锌粒、铁片、铁粉、铜片、黄铜片、稀盐酸、稀硫酸、硫酸铜溶液、
硝酸银溶液
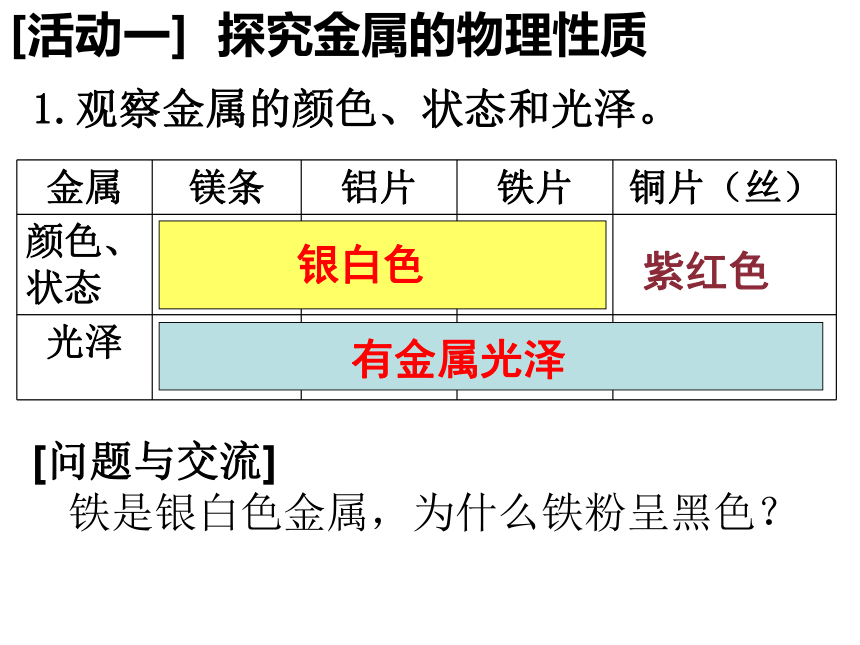
[活动一] 探究金属的物理性质
知识回放
物理性质:物质不需要发生化学变化就表现出来的性质叫做物理性质。
如物质的颜色、状态、气味、溶解性、密度、硬度、熔沸点、导电性、导热性、延展性、挥发性、吸附性、吸水性等。
[活动一] 探究金属的物理性质
1.观察金属的颜色、状态和光泽。
银白色
紫红色
有金属光泽
[问题与交流]
铁是银白色金属,为什么铁粉呈黑色?
金属 镁条 铝片 铁片 铜片(丝)
颜色、状态
光泽
[活动一] 探究金属的物理性质
2.比较铁片和铜片、铜片和黄铜片的
硬度大小可采用的方法是
。
互相刻画
结论:铁片比铜片硬度大,
黄铜片比铜片硬度大。
▲ 不同金属材料硬度不同;
合金一般比组分金属硬度大。
[活动一] 探究金属的物理性质
3.设计实验证明金属的其它物理性质
(如: 。)
导电性、导热性、延展性
实验操作 实验现象 实验结论
[活动一] 探究金属的物理性质
[归纳一]
金属共同的物理性质
特性:
大多数金属为银白色固体、有光泽、
能导电、导热、有延展性
不同金属物理性质差异较大。
[练习一]
下列关于金属材料的说法正确的是( )
A.金属钨硬度大、熔点高,可用来制作
保险丝
B.合金的强度和硬度一般高于组成它们
的纯金属,抗腐蚀性能也更好
C.铜具有良好的导电性,是制造厨具的
理想材料
D.常温下所有金属都是固体
[活动一] 探究金属的物理性质
B
[活动二] 探究金属的化学性质
知识回放
化学性质:物质在化学变化中表现出来的性质叫做化学性质。
1.用坩埚钳夹取一块铜片,放在酒精灯火焰
上加热,观察铜片表面的变化。
实验现象 ,
反应方程式 。
铜片表面有黑色固体生成
[活动二] 探究金属的化学性质
[练习二]
完成下表:
实验现象 反应方程式
铝在空气中表面生成致密保护膜
镁条在空气中燃烧
铁丝在氧气中燃烧
4Al +3O2 = 2Al2O3
铝常温下能与空气中的氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步被氧化。 现象:铝表面变暗。
为什么铝制品耐腐蚀?
3Fe +2O2 Fe3O4
点燃
2Mg + O2 2MgO
点燃
现象:镁条在空气中剧烈燃烧,发出耀眼白光,产生白烟,生成白色固体。
现象:铁丝在氧气中
剧烈燃烧,火星四射,
生成黑色固体。
[活动二] 探究金属的化学性质
[归纳二]
金属化学性质1.
金属 + O2 → 金属氧化物(化合反应)
(金除外)
[活动二] 探究金属的化学性质
2.向5支试管中分别放入少量镁条、铝片、锌粒、
铁片、铜片,然后分别加入5mL稀盐酸(或稀硫酸),观察现象。
猜想生成的气体是 ,
实验操作:
氢气
用燃着的木条伸入试管,观察现象。
无明显变化
Fe+2HCl= FeCl2 + H2↑
Zn+2HCl=ZnCl2+H2↑
Mg+2HCl=MgCl2+H2↑
+2
氯化亚铁
FeCl2
金属固体逐渐溶解,产生大量气泡,反应很快
金属固体逐渐溶解,较多气泡,反应较快
金属固体逐渐溶解,有少量气泡产生,反应较慢,无色溶液变浅绿色
不反应
[活动二] 探究金属的化学性质
金属固体逐渐溶解,产生许多气泡,反应快
2Al+6HCl=2AlCl3+3H2↑
金属 现 象 反应的化学方程式
镁
铝
锌
铁
铜
[活动二] 探究金属的化学性质
[归纳二]
金属化学性质2.
(稀盐酸或稀硫酸)
H前金属 + 酸 → 盐 + H2↑(置换反应)
[活动二] 探究金属的化学性质
3.请你设计并进行实验,比较铁、铜、银的
金属活动性强弱。
[归纳二]
金属化学性质3.
金属A + B的盐溶液→金属B + A的盐溶液(置换反应)
要求:活动性:A > B
对比实验(控制变量法)设计原则:
每组对比只有一项不同,即要研究的因素不同,其它则应控制在相同条件下进行,导致不同的结果。
“一因”致“异果”
[归纳三]
比较金属活动性强弱的方法:
1.根据金属与氧气反应的难易程度或者反应现象的剧烈程度判断;
2.根据金属是否与稀盐酸或稀硫酸反应或相同条件下反应的剧烈程度判断;
3.可根据金属能不能把另一种金属从它的盐溶液中置换出来,判断金属活动性的强弱。
金属活动顺序
K Ca Na Mg Al Zn Fe Sn Pb(H)
Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
小结:
金属的化学性质
1. 金属+O2→金属氧化物(化合反应)
(Au除外)
2. 置换反应: A + BC → B + AC
(1)金属活动性:A > B
(2)BC为盐酸、稀硫酸或金属化合物的溶液
(3)铁参加的溶液中的置换反应生成物为亚铁
单质 + 化合物 → 单质 + 化合物
[课后作业]
实验活动4
金属的物理性质和某些化学性质
【实验目的】
1.巩固和加深对金属性质的认识。
2.设计并进行实验,比较金属的活动性,并对其它实验方案进行评价。
3.归纳比较金属活动性的常用方法。
4.养成及时记录实验现象的习惯,学会规范书写实验报告。
实验活动4
金属的物理性质和某些化学性质
【实验用品】
试管、酒精灯、坩埚钳、电池、导线、小灯泡、火柴、木条
镁条、铝片、锌粒、铁片、铁粉、铜片、黄铜片、稀盐酸、稀硫酸、硫酸铜溶液、
硝酸银溶液
[活动一] 探究金属的物理性质
知识回放
物理性质:物质不需要发生化学变化就表现出来的性质叫做物理性质。
如物质的颜色、状态、气味、溶解性、密度、硬度、熔沸点、导电性、导热性、延展性、挥发性、吸附性、吸水性等。
[活动一] 探究金属的物理性质
1.观察金属的颜色、状态和光泽。
银白色
紫红色
有金属光泽
[问题与交流]
铁是银白色金属,为什么铁粉呈黑色?
金属 镁条 铝片 铁片 铜片(丝)
颜色、状态
光泽
[活动一] 探究金属的物理性质
2.比较铁片和铜片、铜片和黄铜片的
硬度大小可采用的方法是
。
互相刻画
结论:铁片比铜片硬度大,
黄铜片比铜片硬度大。
▲ 不同金属材料硬度不同;
合金一般比组分金属硬度大。
[活动一] 探究金属的物理性质
3.设计实验证明金属的其它物理性质
(如: 。)
导电性、导热性、延展性
实验操作 实验现象 实验结论
[活动一] 探究金属的物理性质
[归纳一]
金属共同的物理性质
特性:
大多数金属为银白色固体、有光泽、
能导电、导热、有延展性
不同金属物理性质差异较大。
[练习一]
下列关于金属材料的说法正确的是( )
A.金属钨硬度大、熔点高,可用来制作
保险丝
B.合金的强度和硬度一般高于组成它们
的纯金属,抗腐蚀性能也更好
C.铜具有良好的导电性,是制造厨具的
理想材料
D.常温下所有金属都是固体
[活动一] 探究金属的物理性质
B
[活动二] 探究金属的化学性质
知识回放
化学性质:物质在化学变化中表现出来的性质叫做化学性质。
1.用坩埚钳夹取一块铜片,放在酒精灯火焰
上加热,观察铜片表面的变化。
实验现象 ,
反应方程式 。
铜片表面有黑色固体生成
[活动二] 探究金属的化学性质
[练习二]
完成下表:
实验现象 反应方程式
铝在空气中表面生成致密保护膜
镁条在空气中燃烧
铁丝在氧气中燃烧
4Al +3O2 = 2Al2O3
铝常温下能与空气中的氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步被氧化。 现象:铝表面变暗。
为什么铝制品耐腐蚀?
3Fe +2O2 Fe3O4
点燃
2Mg + O2 2MgO
点燃
现象:镁条在空气中剧烈燃烧,发出耀眼白光,产生白烟,生成白色固体。
现象:铁丝在氧气中
剧烈燃烧,火星四射,
生成黑色固体。
[活动二] 探究金属的化学性质
[归纳二]
金属化学性质1.
金属 + O2 → 金属氧化物(化合反应)
(金除外)
[活动二] 探究金属的化学性质
2.向5支试管中分别放入少量镁条、铝片、锌粒、
铁片、铜片,然后分别加入5mL稀盐酸(或稀硫酸),观察现象。
猜想生成的气体是 ,
实验操作:
氢气
用燃着的木条伸入试管,观察现象。
无明显变化
Fe+2HCl= FeCl2 + H2↑
Zn+2HCl=ZnCl2+H2↑
Mg+2HCl=MgCl2+H2↑
+2
氯化亚铁
FeCl2
金属固体逐渐溶解,产生大量气泡,反应很快
金属固体逐渐溶解,较多气泡,反应较快
金属固体逐渐溶解,有少量气泡产生,反应较慢,无色溶液变浅绿色
不反应
[活动二] 探究金属的化学性质
金属固体逐渐溶解,产生许多气泡,反应快
2Al+6HCl=2AlCl3+3H2↑
金属 现 象 反应的化学方程式
镁
铝
锌
铁
铜
[活动二] 探究金属的化学性质
[归纳二]
金属化学性质2.
(稀盐酸或稀硫酸)
H前金属 + 酸 → 盐 + H2↑(置换反应)
[活动二] 探究金属的化学性质
3.请你设计并进行实验,比较铁、铜、银的
金属活动性强弱。
[归纳二]
金属化学性质3.
金属A + B的盐溶液→金属B + A的盐溶液(置换反应)
要求:活动性:A > B
对比实验(控制变量法)设计原则:
每组对比只有一项不同,即要研究的因素不同,其它则应控制在相同条件下进行,导致不同的结果。
“一因”致“异果”
[归纳三]
比较金属活动性强弱的方法:
1.根据金属与氧气反应的难易程度或者反应现象的剧烈程度判断;
2.根据金属是否与稀盐酸或稀硫酸反应或相同条件下反应的剧烈程度判断;
3.可根据金属能不能把另一种金属从它的盐溶液中置换出来,判断金属活动性的强弱。
金属活动顺序
K Ca Na Mg Al Zn Fe Sn Pb(H)
Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
小结:
金属的化学性质
1. 金属+O2→金属氧化物(化合反应)
(Au除外)
2. 置换反应: A + BC → B + AC
(1)金属活动性:A > B
(2)BC为盐酸、稀硫酸或金属化合物的溶液
(3)铁参加的溶液中的置换反应生成物为亚铁
单质 + 化合物 → 单质 + 化合物
[课后作业]
同课章节目录
