苏教版高中化学必修一专题4 第二单元 生产生活中的含氮化合物 课件(共19张PPT)
文档属性
| 名称 | 苏教版高中化学必修一专题4 第二单元 生产生活中的含氮化合物 课件(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-14 20:18:01 | ||
图片预览






文档简介
(共19张PPT)
*
专题4 硫、氮和可持续发展
第二单元 生产生活中的含氮化合物
氮肥的生产和使用
*
一、工业合成氨:
合成氨工厂
*
1.氨的物理性质
[小结]氨是无色有刺激性气味的气体,密度比空气小,易液化,氨液化的同时放出大量的热;液态氨汽化时要吸收周围的热量,使周围的空气迅速变冷(常用作致冷剂)。极易溶于水(体积比1∶700)
二、氨气的性质
[展示] 展示一瓶NH3, 观察其颜色、
状态、并闻其气味。
*
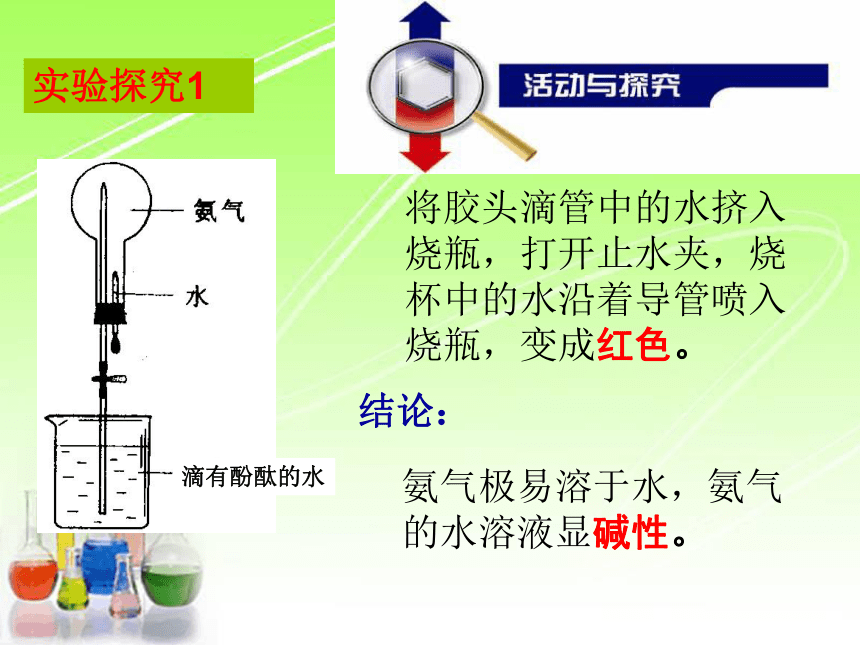
实验探究1
将胶头滴管中的水挤入烧瓶,打开止水夹,烧杯中的水沿着导管喷入烧瓶,变成红色。
氨气极易溶于水,氨气的水溶液显碱性。
滴有酚酞的水
现象:
结论:
*
湿润的红色石蕊试纸变成蓝色。
氨水易挥发,氨气的水溶液具有碱性。
实验探究2
现象:
结论:
*
2.氨的化学性质
(1)氨气与水的反应
*
2.氨的化学性质
(1)氨气与水的反应
NH3· H2O
NH4++OH-
NH3· H2O
NH3+H2O
NH3· H2O = NH3 ↑+H2O
*
讨论
纯净物
混合物
NH3
NH3、H2O、 NH3·H2O
NH4+、OH—
氨水中存在哪些微粒?并与液氨进行比较。
液氨 氨水
物质种类
主要粒子种类
*
烧杯中出现白烟。
浓氨水、浓盐酸具有挥发性,NH3与HCl结合,有固体NH4Cl生成。
实验探究3
现象:
结论:
*
(2)氨气与酸的反应
NH3+HCl= NH4Cl(白烟)
NH3 + HNO3 = NH4NO3 (白烟)
2NH3 + H2SO4 = (NH4)2 SO4
用蘸浓氨水的玻璃棒与蘸浓盐酸的玻璃棒靠近,能观察到什么现象产生?为什么?
将上述浓盐酸换成浓硝酸或浓硫酸现象是否相同?为什么?
*
(3)氨气与氧气反应
主要应用于制造硝酸
*
小结:
一、工业合成氨气
二、氨气的性质
1、物理性质
2、化学性质
与水反应
与酸反应
与氧气反应
*
1、下列反应中,起到固氮作用的是( )
A、N2和H2在一定条件下合成NH3
B、 NH3 经催化氧化生成NO
C、NO与O2反应生成NO2
D、由NH3制碳酸氢铵和尿素
A
*
2、氨水显碱性的主要原因是 ( )
A、通常情况下,氨气在水中的溶解度
不大
B、氨水中的NH3· H2O电离出少量的OH- C、溶于水的氨分子只有少量发生电离
D、氨本身的碱性弱
B
*
3、解释下列实验现象
①向氨水中滴几滴酚酞试液,溶液变红色
②两只棉球分别滴有几滴浓氨水和浓盐酸放入同一只烧杯中,用表面皿盖住烧杯口,烧杯内有白烟
③一瓶无色气体打开瓶盖后,瓶口呈现红棕色
*
4、检验氨气是否充满的方法是:
观察的现象是:
5、能否用浓硫酸干燥氨气?
*
6、有A、B、C三种气体,且均含有N元素,A气体在一定条件下能与O2反应生成B;B不溶于水,但易与O2反应生成C;A、C气体皆易溶于水,所得的溶液相互反应生成盐和水,
则A是__,B是__ ,C是__。
NH3
NO
NO2
*
7、利用右图装置下列组合能形成明显喷泉并充满烧瓶的是
BD
A干燥气体 B 液体
A NO2 水
B CO2 4 mol/L NaOH aq
C Cl2 饱和食盐水
D NH3 1mol/L HCl aq
*
标准状况下,1体积水中溶解700体积
的氨气,所得溶液的密度为0.9 g/cm3,
所得溶液的质量分数为_____,
物质的量浓度是____。
作业
*
专题4 硫、氮和可持续发展
第二单元 生产生活中的含氮化合物
氮肥的生产和使用
*
一、工业合成氨:
合成氨工厂
*
1.氨的物理性质
[小结]氨是无色有刺激性气味的气体,密度比空气小,易液化,氨液化的同时放出大量的热;液态氨汽化时要吸收周围的热量,使周围的空气迅速变冷(常用作致冷剂)。极易溶于水(体积比1∶700)
二、氨气的性质
[展示] 展示一瓶NH3, 观察其颜色、
状态、并闻其气味。
*
实验探究1
将胶头滴管中的水挤入烧瓶,打开止水夹,烧杯中的水沿着导管喷入烧瓶,变成红色。
氨气极易溶于水,氨气的水溶液显碱性。
滴有酚酞的水
现象:
结论:
*
湿润的红色石蕊试纸变成蓝色。
氨水易挥发,氨气的水溶液具有碱性。
实验探究2
现象:
结论:
*
2.氨的化学性质
(1)氨气与水的反应
*
2.氨的化学性质
(1)氨气与水的反应
NH3· H2O
NH4++OH-
NH3· H2O
NH3+H2O
NH3· H2O = NH3 ↑+H2O
*
讨论
纯净物
混合物
NH3
NH3、H2O、 NH3·H2O
NH4+、OH—
氨水中存在哪些微粒?并与液氨进行比较。
液氨 氨水
物质种类
主要粒子种类
*
烧杯中出现白烟。
浓氨水、浓盐酸具有挥发性,NH3与HCl结合,有固体NH4Cl生成。
实验探究3
现象:
结论:
*
(2)氨气与酸的反应
NH3+HCl= NH4Cl(白烟)
NH3 + HNO3 = NH4NO3 (白烟)
2NH3 + H2SO4 = (NH4)2 SO4
用蘸浓氨水的玻璃棒与蘸浓盐酸的玻璃棒靠近,能观察到什么现象产生?为什么?
将上述浓盐酸换成浓硝酸或浓硫酸现象是否相同?为什么?
*
(3)氨气与氧气反应
主要应用于制造硝酸
*
小结:
一、工业合成氨气
二、氨气的性质
1、物理性质
2、化学性质
与水反应
与酸反应
与氧气反应
*
1、下列反应中,起到固氮作用的是( )
A、N2和H2在一定条件下合成NH3
B、 NH3 经催化氧化生成NO
C、NO与O2反应生成NO2
D、由NH3制碳酸氢铵和尿素
A
*
2、氨水显碱性的主要原因是 ( )
A、通常情况下,氨气在水中的溶解度
不大
B、氨水中的NH3· H2O电离出少量的OH- C、溶于水的氨分子只有少量发生电离
D、氨本身的碱性弱
B
*
3、解释下列实验现象
①向氨水中滴几滴酚酞试液,溶液变红色
②两只棉球分别滴有几滴浓氨水和浓盐酸放入同一只烧杯中,用表面皿盖住烧杯口,烧杯内有白烟
③一瓶无色气体打开瓶盖后,瓶口呈现红棕色
*
4、检验氨气是否充满的方法是:
观察的现象是:
5、能否用浓硫酸干燥氨气?
*
6、有A、B、C三种气体,且均含有N元素,A气体在一定条件下能与O2反应生成B;B不溶于水,但易与O2反应生成C;A、C气体皆易溶于水,所得的溶液相互反应生成盐和水,
则A是__,B是__ ,C是__。
NH3
NO
NO2
*
7、利用右图装置下列组合能形成明显喷泉并充满烧瓶的是
BD
A干燥气体 B 液体
A NO2 水
B CO2 4 mol/L NaOH aq
C Cl2 饱和食盐水
D NH3 1mol/L HCl aq
*
标准状况下,1体积水中溶解700体积
的氨气,所得溶液的密度为0.9 g/cm3,
所得溶液的质量分数为_____,
物质的量浓度是____。
作业
