苏教版高中化学必修一专题4 第二单元 生产生活中的含氮化合物 课件(共22张PPT)
文档属性
| 名称 | 苏教版高中化学必修一专题4 第二单元 生产生活中的含氮化合物 课件(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 792.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-14 20:20:52 | ||
图片预览








文档简介
(共22张PPT)
硝酸的性质
(新华网)7月30日下午16时,福州市鼓山附近路边,突然腾起红棕色的浓烟,带着一股浓烈的刺激性气味。黄烟引起许多人的不良反应:咽喉刺痛、眼睛发涩,甚至有人感觉呼吸困难。附近的居民透露,黄烟冒出的地方,是一个仓库,仓库里存放着很多浓硝酸。赶往现场的消防人员立即关闭了4个硝酸储藏罐盖子,并设置安全隔离带,采用冲水稀释和沙子、石灰覆盖等办法控制泄漏蔓延。经过一个多小时的紧张作业,大面积泄漏得到控制。据现场的消防指挥官吴发辉介绍,在现场,根据嗅觉判断,烟气里含有硝酸。“硝酸是溶解在水中的,所以我们用水雾来压住并稀释烟气,让这些腐蚀性的气体沉降到地面,不至于在空气中扩散。”
老板马某说,他不太清楚硝酸的性质,以为用一般的罐来装没有问题。事发后他还抱怨:“都怪罐子的质量太差了,怎么就突然裂开了呢?相关的环保人员告诉记者,装浓硝酸的容器不但要耐得住压力,还得耐得住腐蚀,一般的金属根本挡不住这种酸性剧烈的物质。
【探究问题1】
在刚才看到的硝酸泄漏事故中,现场消防指挥官说:“根据嗅觉判断,‘烟’气里含有硝酸;用高压水雾来压住并稀释‘烟’气,通过这些话,结合教材P100页的内容,分析硝酸具有什么物理性质?
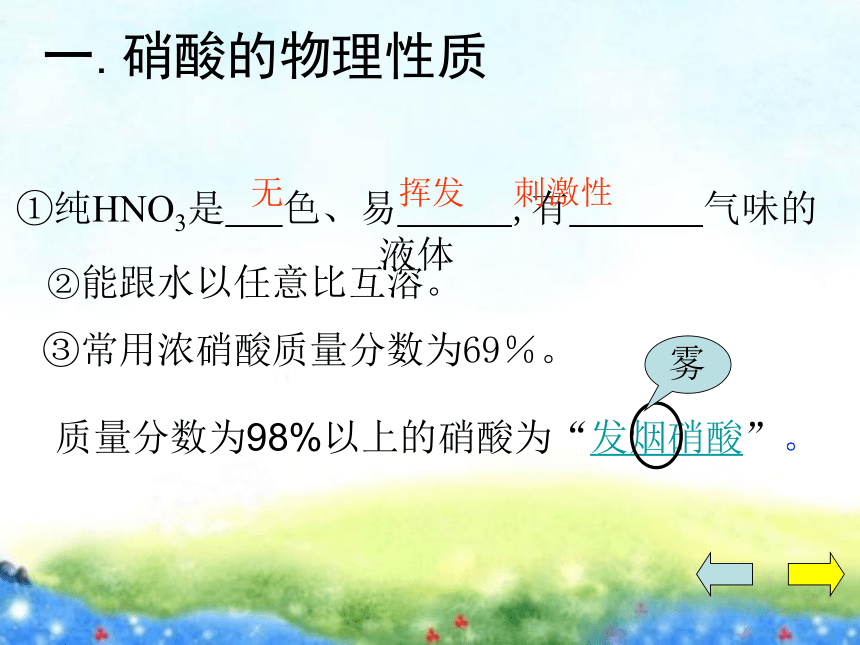
①纯HNO3是 色、易 ,有 气味的液体
②能跟水以任意比互溶。
③常用浓硝酸质量分数为69%。
挥发
刺激性
无
质量分数为98%以上的硝酸为“发烟硝酸”。
一.硝酸的物理性质
1.具有酸的通性:一元强酸 HNO3 = H++NO3-
使指示剂变色
与碱发生中和反应
与碱性氧化物反应
与某些盐反应
与金属反应
【探究问题2】
在抢险过程中,运来的石灰起什么作用,体现了硝酸的什么性质?
二、硝酸的化学性质
【联想质疑】
在这幅图片中,红棕色的气体是什么物质?为什么会产生这种物质,说明了硝酸的什么性质?
2. 硝酸的不稳定性
硝酸越浓越容易分解
HNO3 分解产生的NO2溶于硝酸而变黄。
长久放置的浓硝酸为何呈黄色?
【动动脑】从氧化还原的角度试着分析:硝酸的分解产物除了NO2还有什么?
根据硝酸的这一特点,实验室如何保
存浓硝酸?
棕色试剂瓶,并贮放在黑暗、阴凉处
久置的浓硝酸和新放置的浓硝酸
【探究问题3】
事故报道中叙述:“装浓硝酸的容器不但要耐得住压力,还得耐得住腐蚀,一般的金属根本挡不住这种酸性剧烈的物质。”通过这句话可以看出硝酸对金属具有强烈的腐蚀性。那么硝酸能与铜反应吗?如果能反应,产物是什么?
实 验 现 象 记 录
剧烈
蓝绿色
红棕色
缓慢
蓝色
无色
生成Cu(NO3)2
产生NO2
生成Cu(NO3)2
产生NO
【实验探究】
铜分别与稀硝酸、浓硝酸反应,观察现象
反应物 现象 结论
Cu与浓HNO3 剧烈程度:
溶液颜色:
气体颜色:
Cu与稀HNO3 剧烈程度:
溶液颜色:
气体颜色:
3、强氧化性
①硝酸能与大部分金属(除Au、Pt外)反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
在该反应中HNO3体现了哪些性质?
(氧化性、酸性)
Cu+4H+ +2NO3— =Cu2++ 2NO2 ↑ +2H2O
3Cu+8H+ +2NO3— =3Cu2++2NO↑+4H2O
1)金属与HNO3反应时,金属被氧化成高价硝酸盐:
R+HNO3→R(NO3)x+NOx
一般情况下:浓HNO3被还原为NO2 ,
稀HNO3被还原为NO 。
2)常温下,浓硝酸使铁、铝等金属钝化
3)硝酸浓度越高,氧化性越强.
(浓HNO3>稀HNO3)
zxxk
硝酸与金属反应的规律:
故可用铁质或铝质容器装浓硝酸。
②硝酸能与许多非金属反应:
讨论:在该反应中浓硝酸表现了什么性质?
只有氧化性
规律:浓硝酸与非金属反应(C、S、P),一般将
非金属氧化为最高价氧化物或最高价含氧酸;自
身被还原为NO2
③硝酸能与许多还原性化合物反应:
如:SO2、Na2SO3、KI、FeCl2 等。
问题的深化
浓硝酸能够溶解除金、铂以外的大多数金属,要溶解金、铂还需要在浓硝酸中加入一种酸,猜想这会是什么酸?
玻尔巧藏“诺贝尔金质奖章”
玻尔(1885—1962) 丹麦物理学家
在“量子力学”的建立中有重大贡献
“王水”里的奖章
1943年9月的一天,丹麦反法西斯组织派人告诉玻尔一个紧急的消息:德国法西斯准备对他下手了!玻尔准备逃亡。在收拾行李中发现了一样重要的东西:他在1942年获得的诺贝尔奖章。这枚奖章决不能落在法西斯的手里。如果藏在身上带走,是很危险的。焦急中他的眼光落在了一个试剂瓶上,瓶子里存放的是“王水”。 玻尔把金质的奖章小心的放入“试剂瓶”里,奖章在“王水”里慢慢的就消失了。然后,他离开了自己的祖国。 战争结束后,玻尔回到了自己的实验室,那个小瓶子还在那里。于是,他拿起一块铜放入“王水”,铜块慢慢的也变小了,奇怪的是,瓶子里出现了一块黄金! 玻尔就是利用了化学上的一个化学反应——置换反应,把奖章安全的保护下来了。新铸成的奖章显得更加灿烂夺目,因为,它凝聚着玻尔对祖国无限的热爱和无穷的智慧
3体积浓盐酸与1体积浓硝酸的混合物叫做王水。它的氧化能力更强,可以溶解铂和金。
帮
你
记
忆
(3:1)
硝酸的用途
课本P101页
【课堂小结】
一、硝酸的物理性质
无色有刺激性气味的易挥发的液体
常用浓硝酸:69%
发烟硝酸:98%以上
【作业】课本P102 2、3
【课堂练习】
1. 常温能用铝制品容器盛放的是( )
A.稀硝酸 B.浓硝酸 C.浓硫酸 D.浓盐酸
2.下列反应主要体现了硝酸的什么性质?
A.氧化性 B.酸性 C.还原性 D.不稳定性
(1)久置的硝酸变黄色( )
(2)用硝酸浸洗附有银的试管( )
(3)用硝酸浸洗久置石灰水试剂瓶上的固体( )
(4)用硝酸浸洗积碳的试管( )
B、C
D
A、B
B
A
4.足量的Cu中加入少量的浓硝酸,可能会发生什么反应?
3.硝酸与铁反应的产物是硝酸铁还是硝酸亚铁?试试看写出反应的方程式。
2.在稀硫酸中加入铜粉,铜粉不溶解,再加入KNO3 ,发现铜粉溶解,为什么?
(用离子方程式表示)
3Cu+8H+ +2NO3— =3Cu2++2NO↑+4H2O
硝酸的性质
(新华网)7月30日下午16时,福州市鼓山附近路边,突然腾起红棕色的浓烟,带着一股浓烈的刺激性气味。黄烟引起许多人的不良反应:咽喉刺痛、眼睛发涩,甚至有人感觉呼吸困难。附近的居民透露,黄烟冒出的地方,是一个仓库,仓库里存放着很多浓硝酸。赶往现场的消防人员立即关闭了4个硝酸储藏罐盖子,并设置安全隔离带,采用冲水稀释和沙子、石灰覆盖等办法控制泄漏蔓延。经过一个多小时的紧张作业,大面积泄漏得到控制。据现场的消防指挥官吴发辉介绍,在现场,根据嗅觉判断,烟气里含有硝酸。“硝酸是溶解在水中的,所以我们用水雾来压住并稀释烟气,让这些腐蚀性的气体沉降到地面,不至于在空气中扩散。”
老板马某说,他不太清楚硝酸的性质,以为用一般的罐来装没有问题。事发后他还抱怨:“都怪罐子的质量太差了,怎么就突然裂开了呢?相关的环保人员告诉记者,装浓硝酸的容器不但要耐得住压力,还得耐得住腐蚀,一般的金属根本挡不住这种酸性剧烈的物质。
【探究问题1】
在刚才看到的硝酸泄漏事故中,现场消防指挥官说:“根据嗅觉判断,‘烟’气里含有硝酸;用高压水雾来压住并稀释‘烟’气,通过这些话,结合教材P100页的内容,分析硝酸具有什么物理性质?
①纯HNO3是 色、易 ,有 气味的液体
②能跟水以任意比互溶。
③常用浓硝酸质量分数为69%。
挥发
刺激性
无
质量分数为98%以上的硝酸为“发烟硝酸”。
一.硝酸的物理性质
1.具有酸的通性:一元强酸 HNO3 = H++NO3-
使指示剂变色
与碱发生中和反应
与碱性氧化物反应
与某些盐反应
与金属反应
【探究问题2】
在抢险过程中,运来的石灰起什么作用,体现了硝酸的什么性质?
二、硝酸的化学性质
【联想质疑】
在这幅图片中,红棕色的气体是什么物质?为什么会产生这种物质,说明了硝酸的什么性质?
2. 硝酸的不稳定性
硝酸越浓越容易分解
HNO3 分解产生的NO2溶于硝酸而变黄。
长久放置的浓硝酸为何呈黄色?
【动动脑】从氧化还原的角度试着分析:硝酸的分解产物除了NO2还有什么?
根据硝酸的这一特点,实验室如何保
存浓硝酸?
棕色试剂瓶,并贮放在黑暗、阴凉处
久置的浓硝酸和新放置的浓硝酸
【探究问题3】
事故报道中叙述:“装浓硝酸的容器不但要耐得住压力,还得耐得住腐蚀,一般的金属根本挡不住这种酸性剧烈的物质。”通过这句话可以看出硝酸对金属具有强烈的腐蚀性。那么硝酸能与铜反应吗?如果能反应,产物是什么?
实 验 现 象 记 录
剧烈
蓝绿色
红棕色
缓慢
蓝色
无色
生成Cu(NO3)2
产生NO2
生成Cu(NO3)2
产生NO
【实验探究】
铜分别与稀硝酸、浓硝酸反应,观察现象
反应物 现象 结论
Cu与浓HNO3 剧烈程度:
溶液颜色:
气体颜色:
Cu与稀HNO3 剧烈程度:
溶液颜色:
气体颜色:
3、强氧化性
①硝酸能与大部分金属(除Au、Pt外)反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
在该反应中HNO3体现了哪些性质?
(氧化性、酸性)
Cu+4H+ +2NO3— =Cu2++ 2NO2 ↑ +2H2O
3Cu+8H+ +2NO3— =3Cu2++2NO↑+4H2O
1)金属与HNO3反应时,金属被氧化成高价硝酸盐:
R+HNO3→R(NO3)x+NOx
一般情况下:浓HNO3被还原为NO2 ,
稀HNO3被还原为NO 。
2)常温下,浓硝酸使铁、铝等金属钝化
3)硝酸浓度越高,氧化性越强.
(浓HNO3>稀HNO3)
zxxk
硝酸与金属反应的规律:
故可用铁质或铝质容器装浓硝酸。
②硝酸能与许多非金属反应:
讨论:在该反应中浓硝酸表现了什么性质?
只有氧化性
规律:浓硝酸与非金属反应(C、S、P),一般将
非金属氧化为最高价氧化物或最高价含氧酸;自
身被还原为NO2
③硝酸能与许多还原性化合物反应:
如:SO2、Na2SO3、KI、FeCl2 等。
问题的深化
浓硝酸能够溶解除金、铂以外的大多数金属,要溶解金、铂还需要在浓硝酸中加入一种酸,猜想这会是什么酸?
玻尔巧藏“诺贝尔金质奖章”
玻尔(1885—1962) 丹麦物理学家
在“量子力学”的建立中有重大贡献
“王水”里的奖章
1943年9月的一天,丹麦反法西斯组织派人告诉玻尔一个紧急的消息:德国法西斯准备对他下手了!玻尔准备逃亡。在收拾行李中发现了一样重要的东西:他在1942年获得的诺贝尔奖章。这枚奖章决不能落在法西斯的手里。如果藏在身上带走,是很危险的。焦急中他的眼光落在了一个试剂瓶上,瓶子里存放的是“王水”。 玻尔把金质的奖章小心的放入“试剂瓶”里,奖章在“王水”里慢慢的就消失了。然后,他离开了自己的祖国。 战争结束后,玻尔回到了自己的实验室,那个小瓶子还在那里。于是,他拿起一块铜放入“王水”,铜块慢慢的也变小了,奇怪的是,瓶子里出现了一块黄金! 玻尔就是利用了化学上的一个化学反应——置换反应,把奖章安全的保护下来了。新铸成的奖章显得更加灿烂夺目,因为,它凝聚着玻尔对祖国无限的热爱和无穷的智慧
3体积浓盐酸与1体积浓硝酸的混合物叫做王水。它的氧化能力更强,可以溶解铂和金。
帮
你
记
忆
(3:1)
硝酸的用途
课本P101页
【课堂小结】
一、硝酸的物理性质
无色有刺激性气味的易挥发的液体
常用浓硝酸:69%
发烟硝酸:98%以上
【作业】课本P102 2、3
【课堂练习】
1. 常温能用铝制品容器盛放的是( )
A.稀硝酸 B.浓硝酸 C.浓硫酸 D.浓盐酸
2.下列反应主要体现了硝酸的什么性质?
A.氧化性 B.酸性 C.还原性 D.不稳定性
(1)久置的硝酸变黄色( )
(2)用硝酸浸洗附有银的试管( )
(3)用硝酸浸洗久置石灰水试剂瓶上的固体( )
(4)用硝酸浸洗积碳的试管( )
B、C
D
A、B
B
A
4.足量的Cu中加入少量的浓硝酸,可能会发生什么反应?
3.硝酸与铁反应的产物是硝酸铁还是硝酸亚铁?试试看写出反应的方程式。
2.在稀硫酸中加入铜粉,铜粉不溶解,再加入KNO3 ,发现铜粉溶解,为什么?
(用离子方程式表示)
3Cu+8H+ +2NO3— =3Cu2++2NO↑+4H2O
