人教版九年级化学 第11单元 课题1 生活中常见的盐 第2课时 复分解反应 教学课件(共29张PPT)
文档属性
| 名称 | 人教版九年级化学 第11单元 课题1 生活中常见的盐 第2课时 复分解反应 教学课件(共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 614.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-04-22 00:00:00 | ||
图片预览




文档简介
(共29张PPT)
第2课时
复分解反应
第十一单元
盐 化肥
课题1
生活中常见的盐
学习目标
1.进一步理解酸、碱、盐等基本概念;
2.对重点知识进行初步的归纳和整理;
3.能正确判断酸、碱、盐之间的反应;
4.对物质的分类有进一步的认识;
5.重点掌握复分解反应的条件。
学习难点
学习重点
1.理解复分解反应的定义。
2.掌握复分解反应发生的条件。
掌握复分解反应发生的条件。
课前自学准备
课标要求
1.复分解反应:两种________相互______成分,生成另外两种________的反应。
2.复分解反应发生的条件:当两种化合物互相交换成分,生成物中有________或者___
____或者_______生成时,复分解反应才可以发生。
课前自学准备
预习检测
化合物
交换
化合物
沉淀
水
气体
3.根据溶解性表,可归纳盐的溶解性如下:
(1)____盐、____盐、____盐、______盐均可溶。
(2)碳酸盐中除了_______________可溶,______微溶外,其余都不溶。
(3)盐酸盐除了_____不溶外,其余都可溶。
(4)硫酸盐除了 ______微溶、 ______不溶外,其余都可溶。
钾
钠
铵
硝酸
钾、钠、铵盐
镁盐
AgCl
CaSO4
BaSO4
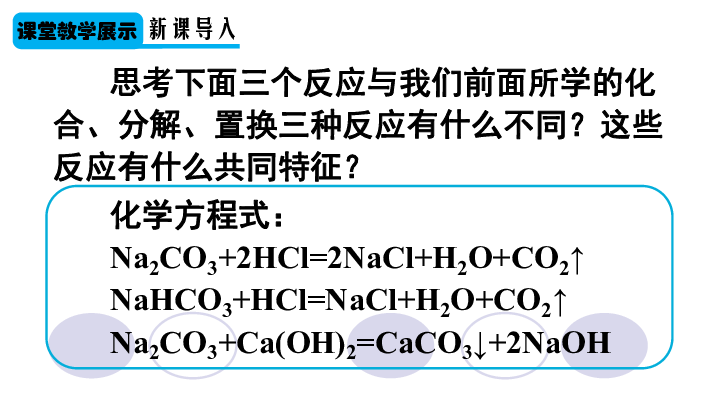
思考下面三个反应与我们前面所学的化合、分解、置换三种反应有什么不同?这些反应有什么共同特征?
课堂教学展示
新课导入
化学方程式:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+2HCl=2NaCl+ CO2↑ +H2O
NaHCO3+HCl=NaCl+ CO2↑ +H2O
Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH
H2CO3
上述三个反应都是由两种化合物互相交换成分,生成另外两种化合物的反应,这样的反应叫做复分解反应。
知识点1 复分解反应
课堂教学展示
课堂探究
H2CO3
复分解反应一般发生在酸、碱、盐和金属氧化物之间,那么是不是酸、碱、盐和金属氧化物之间就一定能发生复分解反应呢?
思考
向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象
化学方程式
实验11-3
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象
化学方程式
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH=Cu(OH)2↓
+Na2SO4
CuSO4+BaCl2=BaSO4↓
+CuCl2
1.上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
2.前面学过的酸碱中和反应是否也属于复分解反应?中和反应的生成物中,相同的生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐溶液与盐酸发生复分解反应时,可观察到的共同现象是什么?
属于;
属于;
都有气体生成。
讨论
水。
都有沉淀生成。
复分解反应发生的条件
并不是任何酸、碱、盐和金属氧化物之间都能发生复分解反应,只有当两种化合物相互交换成分,且有沉淀、气体或水生成时,复分解反应才能发生。
归纳
例 某小组为了验证复分解反应发生的条件,选用了下列部分药品进行实验。
①氢氧化钠溶液 ②硫酸铜溶液 ③稀盐酸 ④硝酸钾溶液
(1)为了验证有水生成的复分解反应能发生,某同学选择了①和③。你认为除上述四种药品外,还需增加的一种试剂是_____________________。
紫色石蕊溶液
课堂教学展示
典例剖析
(2)选择_______(填序号)两种物质进行实验,能验证有沉淀生成的复分解反应能发生,其化学方程式________________________________________。
① ②
CuSO4+2NaOH==
Cu(OH)2↓+Na2SO4
(3)下列反应中,能验证有气体生成的复分解反应能发生的是____(填字母)。
A.锌与稀硫酸反应
B.天然气燃烧
C.石灰石与稀盐酸反应
D.过氧化氢分解
C
置换反应
单质和化合物反应生成两种化合物
分解反应
√
请同学们阅读课本P114附录 I 找出常见的酸、碱、盐的溶解性规律,并归纳记忆方法。
知识点2 常见酸、碱、盐的溶解性
某些酸、碱、盐之间是否发生反应
探究
1.常见的酸大多溶于水;
2.常见的碱中只有五种溶于水:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O;
3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
归纳
4.盐酸盐(也称氯化物)不溶于水的只有AgCl;
5.硫酸盐不溶于水的只有BaSO4;微溶于水的有:CaSO4、Ag2SO4;
6.碳酸盐:含钾、钠、铵根离子的溶于水,MgCO3微溶于水,其余都不溶于水。
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物的溶液是否能发生反应。
问题
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断依据
能
有水生成
不能
能
能
无气体、无沉淀、无水生成
有气体生成
有沉淀生成
复分解反应的五种情况:
金属
氧化物
酸
碱
盐
①
②
③
④
⑤
①金属氧化物+酸→盐+水
②酸+碱→盐+水(中和反应)
③酸+盐→新酸+新盐
④碱+盐→新碱+新盐
⑤盐+盐→两种新盐
一般不需判断
需要判断
第2课时 复分解反应
复分解反应
由两种化合物相互交换成分生成另外两种化合物的反应;
复分解反应发生的条件:生成物中有沉淀、气体或水。
课堂教学展示
教学板书
本节课我们主要学习了:
1.复分解反应及其发生的条件
复分解反应:由两种化合物相互交换成分生成另外两种化合物的反应;
复分解反应发生的条件:生成物中有沉淀、气体或水。
2.盐的溶解性
课堂教学展示
课堂小结
课后反馈总结
课后作业
1.从课后习题中选取;
2.完成练习册本课时的习题。
结合实验让学生掌握碳酸根离子和碳酸氢根离子的检验方法,理解复分解反应及其发生的条件。教学中可加强小组讨论,激发学生的学习兴趣。
课后反馈总结
教学反思
练习与应用(P78)
课后反馈总结
课本习题
3.下列反应中不属于复分解反应的是( )
A. H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
B. H2SO4 + BaCl2 = BaSO4↓ + 2HC1
C. 2HC1 + Fe = FeCl2 + H2 ↑
D. 2HC1 + CaCO3 = CaCl2 + CO2 ↑ +H2O
C
4.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们提出了如下假设:
假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液全部变质。
请设计实验方案,分别验证以上假设,简要叙述实验步骤和现象,并写出相关反应的化学方程式。
解:假设一:该溶液没有变质
实验步骤:取少量该溶液于试管中,加入稀盐酸。
实验现象:无气泡产生化学方程式:NaOH+HCl==NaCl+H2O
假设二:该溶液部分变质
实验步骤:取少量该溶液于试管中,加入过量氯化钙溶液,静置,取上层清液于另一支试管中,加入2~3滴酚酞溶液, 实验现象:有白色沉淀生成,上层清液变红化学方程式:CaCl2+Na2CO3==2NaCl+CaCO3↓
假设三:该溶液全部变质
实验步骤:取少量该溶液于试管中,加入过量氯化钙溶液,静置,取上层清液于另一支试管中,加入2~3滴酚酞溶液, 实验现象:有白色沉淀生成,上层清液不变红化学方程式:CaCl2+Na2CO3==2NaCl+CaCO3↓
第2课时
复分解反应
第十一单元
盐 化肥
课题1
生活中常见的盐
学习目标
1.进一步理解酸、碱、盐等基本概念;
2.对重点知识进行初步的归纳和整理;
3.能正确判断酸、碱、盐之间的反应;
4.对物质的分类有进一步的认识;
5.重点掌握复分解反应的条件。
学习难点
学习重点
1.理解复分解反应的定义。
2.掌握复分解反应发生的条件。
掌握复分解反应发生的条件。
课前自学准备
课标要求
1.复分解反应:两种________相互______成分,生成另外两种________的反应。
2.复分解反应发生的条件:当两种化合物互相交换成分,生成物中有________或者___
____或者_______生成时,复分解反应才可以发生。
课前自学准备
预习检测
化合物
交换
化合物
沉淀
水
气体
3.根据溶解性表,可归纳盐的溶解性如下:
(1)____盐、____盐、____盐、______盐均可溶。
(2)碳酸盐中除了_______________可溶,______微溶外,其余都不溶。
(3)盐酸盐除了_____不溶外,其余都可溶。
(4)硫酸盐除了 ______微溶、 ______不溶外,其余都可溶。
钾
钠
铵
硝酸
钾、钠、铵盐
镁盐
AgCl
CaSO4
BaSO4
思考下面三个反应与我们前面所学的化合、分解、置换三种反应有什么不同?这些反应有什么共同特征?
课堂教学展示
新课导入
化学方程式:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+2HCl=2NaCl+ CO2↑ +H2O
NaHCO3+HCl=NaCl+ CO2↑ +H2O
Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH
H2CO3
上述三个反应都是由两种化合物互相交换成分,生成另外两种化合物的反应,这样的反应叫做复分解反应。
知识点1 复分解反应
课堂教学展示
课堂探究
H2CO3
复分解反应一般发生在酸、碱、盐和金属氧化物之间,那么是不是酸、碱、盐和金属氧化物之间就一定能发生复分解反应呢?
思考
向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象
化学方程式
实验11-3
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象
化学方程式
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH=Cu(OH)2↓
+Na2SO4
CuSO4+BaCl2=BaSO4↓
+CuCl2
1.上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
2.前面学过的酸碱中和反应是否也属于复分解反应?中和反应的生成物中,相同的生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐溶液与盐酸发生复分解反应时,可观察到的共同现象是什么?
属于;
属于;
都有气体生成。
讨论
水。
都有沉淀生成。
复分解反应发生的条件
并不是任何酸、碱、盐和金属氧化物之间都能发生复分解反应,只有当两种化合物相互交换成分,且有沉淀、气体或水生成时,复分解反应才能发生。
归纳
例 某小组为了验证复分解反应发生的条件,选用了下列部分药品进行实验。
①氢氧化钠溶液 ②硫酸铜溶液 ③稀盐酸 ④硝酸钾溶液
(1)为了验证有水生成的复分解反应能发生,某同学选择了①和③。你认为除上述四种药品外,还需增加的一种试剂是_____________________。
紫色石蕊溶液
课堂教学展示
典例剖析
(2)选择_______(填序号)两种物质进行实验,能验证有沉淀生成的复分解反应能发生,其化学方程式________________________________________。
① ②
CuSO4+2NaOH==
Cu(OH)2↓+Na2SO4
(3)下列反应中,能验证有气体生成的复分解反应能发生的是____(填字母)。
A.锌与稀硫酸反应
B.天然气燃烧
C.石灰石与稀盐酸反应
D.过氧化氢分解
C
置换反应
单质和化合物反应生成两种化合物
分解反应
√
请同学们阅读课本P114附录 I 找出常见的酸、碱、盐的溶解性规律,并归纳记忆方法。
知识点2 常见酸、碱、盐的溶解性
某些酸、碱、盐之间是否发生反应
探究
1.常见的酸大多溶于水;
2.常见的碱中只有五种溶于水:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O;
3.钾盐、钠盐、铵盐、硝酸盐,都能溶于水;
归纳
4.盐酸盐(也称氯化物)不溶于水的只有AgCl;
5.硫酸盐不溶于水的只有BaSO4;微溶于水的有:CaSO4、Ag2SO4;
6.碳酸盐:含钾、钠、铵根离子的溶于水,MgCO3微溶于水,其余都不溶于水。
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物的溶液是否能发生反应。
问题
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断依据
能
有水生成
不能
能
能
无气体、无沉淀、无水生成
有气体生成
有沉淀生成
复分解反应的五种情况:
金属
氧化物
酸
碱
盐
①
②
③
④
⑤
①金属氧化物+酸→盐+水
②酸+碱→盐+水(中和反应)
③酸+盐→新酸+新盐
④碱+盐→新碱+新盐
⑤盐+盐→两种新盐
一般不需判断
需要判断
第2课时 复分解反应
复分解反应
由两种化合物相互交换成分生成另外两种化合物的反应;
复分解反应发生的条件:生成物中有沉淀、气体或水。
课堂教学展示
教学板书
本节课我们主要学习了:
1.复分解反应及其发生的条件
复分解反应:由两种化合物相互交换成分生成另外两种化合物的反应;
复分解反应发生的条件:生成物中有沉淀、气体或水。
2.盐的溶解性
课堂教学展示
课堂小结
课后反馈总结
课后作业
1.从课后习题中选取;
2.完成练习册本课时的习题。
结合实验让学生掌握碳酸根离子和碳酸氢根离子的检验方法,理解复分解反应及其发生的条件。教学中可加强小组讨论,激发学生的学习兴趣。
课后反馈总结
教学反思
练习与应用(P78)
课后反馈总结
课本习题
3.下列反应中不属于复分解反应的是( )
A. H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
B. H2SO4 + BaCl2 = BaSO4↓ + 2HC1
C. 2HC1 + Fe = FeCl2 + H2 ↑
D. 2HC1 + CaCO3 = CaCl2 + CO2 ↑ +H2O
C
4.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们提出了如下假设:
假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液全部变质。
请设计实验方案,分别验证以上假设,简要叙述实验步骤和现象,并写出相关反应的化学方程式。
解:假设一:该溶液没有变质
实验步骤:取少量该溶液于试管中,加入稀盐酸。
实验现象:无气泡产生化学方程式:NaOH+HCl==NaCl+H2O
假设二:该溶液部分变质
实验步骤:取少量该溶液于试管中,加入过量氯化钙溶液,静置,取上层清液于另一支试管中,加入2~3滴酚酞溶液, 实验现象:有白色沉淀生成,上层清液变红化学方程式:CaCl2+Na2CO3==2NaCl+CaCO3↓
假设三:该溶液全部变质
实验步骤:取少量该溶液于试管中,加入过量氯化钙溶液,静置,取上层清液于另一支试管中,加入2~3滴酚酞溶液, 实验现象:有白色沉淀生成,上层清液不变红化学方程式:CaCl2+Na2CO3==2NaCl+CaCO3↓
同课章节目录
