苏教版高中化学必修一专题4 第一单元 含硫化合物的性质和应用 课件(共26张PPT)
文档属性
| 名称 | 苏教版高中化学必修一专题4 第一单元 含硫化合物的性质和应用 课件(共26张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-14 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
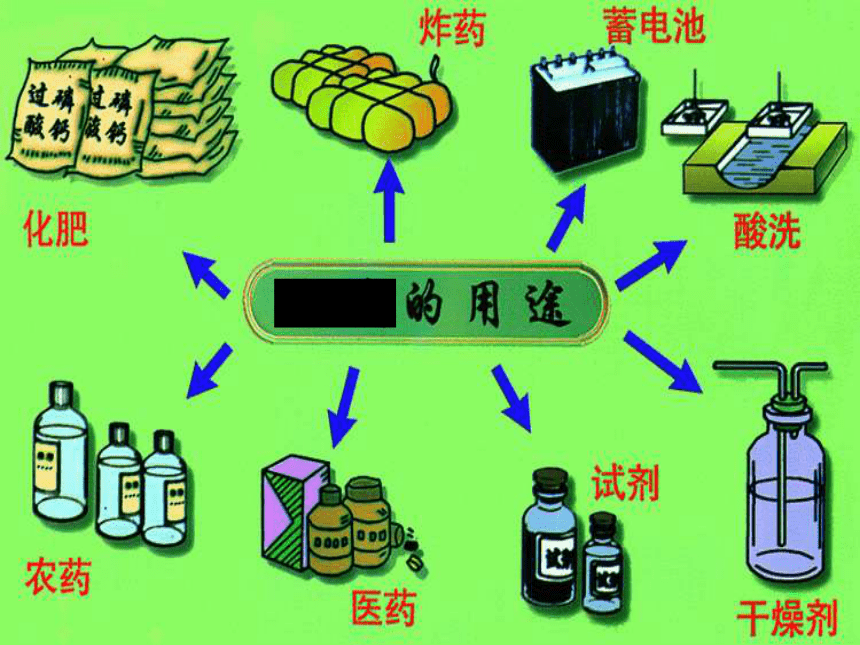
某物质
硫酸生产反应式
硫酸工业生产的原理
第一步:
第二步:
第三步:
沸腾炉
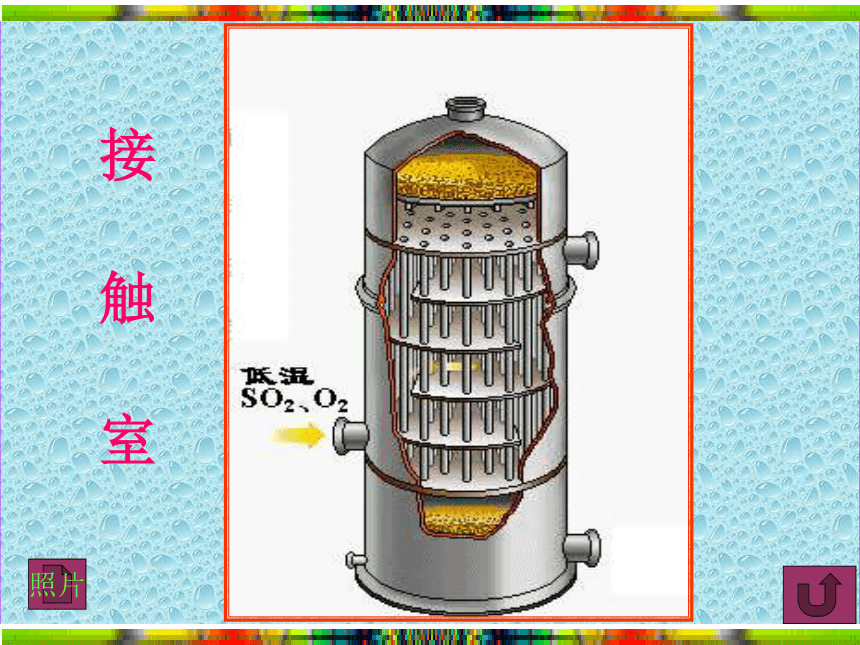
接触室
吸收塔
全过程
结束
硫酸工业生产流程自制动画
硫酸的工业生产
沸 腾 炉
接 触 室
吸 收 塔
净化
冷 却
沸腾炉
沸 腾 炉
照片
接触室
接 触 室
照片
吸收塔
吸 收 塔
工业沸腾炉照片
沸 腾 炉
工业接触室照片
接 触 室
硫酸的性质
一、硫酸的物理性质
纯硫酸是一种无色油状液体,沸点高,难挥发,密度大于水(浓度越大,密度越大),易溶于水,能以任意比与水混溶。
1 稀硫酸——酸的通性
①与指示剂反应:
④与碱反应生成盐和水:
②与H前的金属反应置换出氢气:
③与金属氧化物反应生成盐和水:
⑤与盐反应生成新的盐和新的酸:
2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
Na2CO3+H2SO4=Na2SO4+CO2↑+ H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
使紫色石蕊变红,无色酚酞不变色
Zn+H2SO4=ZnSO4+H2↑(实验室制H2)
一、硫酸的化学性质
结 论:
实验现象:
将一小块铜片放入试管中,然后加入2mL浓
硫酸,用图示装置进行实验,观察实验现象。
氧化性
酸性
将一小块铝片或铁片放入试管中,然后
加入2mL浓硫酸,观察实验现象。
结 论:
实验现象:
无明显现象
常温下,铁和铝遇浓硫酸发生钝化
取2g蔗糖( C12H22O11),放入大试管中,加入约5mL浓硫酸,迅速搅拌,然后塞上带玻璃导管的橡胶塞,将玻璃导管的另一端插入盛有品红溶液的试管中,观察实验现象。
结 论:
实验现象:
浓H2SO4能将有机物中的H、O两元素以H2O的形式脱去,并且在上述反应中有SO2生成。
蔗糖变黑,体积膨胀,有刺激性气味的气体产生,气体通入品红溶液后品红褪色。
以上实验中浓硫酸除了表现出脱水性之外还有没有体现出其它的性质呢?
交流与讨论
强氧化性
CO2↑+
SO2↑
+ H2O
C+ H2SO4(浓)
△
向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察实验现象。
结论:
实验现象:
浓H2SO4能吸收CuSO4晶体中的水,具有吸
水性。
蓝色的晶体变成白色
2.浓硫酸的特性
①吸水性:
②脱水性:
③强氧化性:
1.有两瓶等体积的浓硫酸和稀硫酸,请设计实验方案加以鉴别。
交流与讨论
2.下列化学反应和事实,分别利用了H2SO4的什么性质。
(1)用浓H2SO4干燥氧气:
(2)铜片和浓硫酸共热,产生二氧化硫:
(3)纸张、布条、蔗糖等遇浓硫酸会慢慢变黑:
(4)S+ 2H2SO4(浓) = 3SO2 ↑ +2H2O:
交流与讨论
吸水性
酸性、强氧化性
脱水性
强氧化性
△
思考?
用铜和浓硫酸为原料制取硫酸铜,可用下列两种方法:
(1)Cu CuSO4
(2)Cu CuO CuSO4
请写出上述实验中发生反应的化学方程式,并说明哪一种方法较优越?
浓H2SO4
O2
H2SO4
下图是验证碳与浓硫酸反应的产物的装置图,你能说出它们各自的作用吗?
产物
向50ml18mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.等于0.45mol B. 等于0.90mol
C. 小于0.45mol D.在0.45mol与0.90mol之间
课堂巩固:
分析(1)n(H2SO4)=18mol/L×50mL ×10-3=0.90mol
(3)随着反应的进行,浓硫酸转化为稀硫酸,便不再与铜反应。
(2)Cu——2H2SO4——H2SO4(被还原)
若0.90mol浓硫酸全部参加反应,则被还原的为0.45mol.
答案:C
浓、稀硫酸的比较
强
弱
SO2
H2
有
无
S
H
与Zn反应的
气态产物 氧化性
强弱 被还原
的元素 吸水性
脱水性
浓硫酸
稀硫酸
某物质
硫酸生产反应式
硫酸工业生产的原理
第一步:
第二步:
第三步:
沸腾炉
接触室
吸收塔
全过程
结束
硫酸工业生产流程自制动画
硫酸的工业生产
沸 腾 炉
接 触 室
吸 收 塔
净化
冷 却
沸腾炉
沸 腾 炉
照片
接触室
接 触 室
照片
吸收塔
吸 收 塔
工业沸腾炉照片
沸 腾 炉
工业接触室照片
接 触 室
硫酸的性质
一、硫酸的物理性质
纯硫酸是一种无色油状液体,沸点高,难挥发,密度大于水(浓度越大,密度越大),易溶于水,能以任意比与水混溶。
1 稀硫酸——酸的通性
①与指示剂反应:
④与碱反应生成盐和水:
②与H前的金属反应置换出氢气:
③与金属氧化物反应生成盐和水:
⑤与盐反应生成新的盐和新的酸:
2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
Na2CO3+H2SO4=Na2SO4+CO2↑+ H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
使紫色石蕊变红,无色酚酞不变色
Zn+H2SO4=ZnSO4+H2↑(实验室制H2)
一、硫酸的化学性质
结 论:
实验现象:
将一小块铜片放入试管中,然后加入2mL浓
硫酸,用图示装置进行实验,观察实验现象。
氧化性
酸性
将一小块铝片或铁片放入试管中,然后
加入2mL浓硫酸,观察实验现象。
结 论:
实验现象:
无明显现象
常温下,铁和铝遇浓硫酸发生钝化
取2g蔗糖( C12H22O11),放入大试管中,加入约5mL浓硫酸,迅速搅拌,然后塞上带玻璃导管的橡胶塞,将玻璃导管的另一端插入盛有品红溶液的试管中,观察实验现象。
结 论:
实验现象:
浓H2SO4能将有机物中的H、O两元素以H2O的形式脱去,并且在上述反应中有SO2生成。
蔗糖变黑,体积膨胀,有刺激性气味的气体产生,气体通入品红溶液后品红褪色。
以上实验中浓硫酸除了表现出脱水性之外还有没有体现出其它的性质呢?
交流与讨论
强氧化性
CO2↑+
SO2↑
+ H2O
C+ H2SO4(浓)
△
向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察实验现象。
结论:
实验现象:
浓H2SO4能吸收CuSO4晶体中的水,具有吸
水性。
蓝色的晶体变成白色
2.浓硫酸的特性
①吸水性:
②脱水性:
③强氧化性:
1.有两瓶等体积的浓硫酸和稀硫酸,请设计实验方案加以鉴别。
交流与讨论
2.下列化学反应和事实,分别利用了H2SO4的什么性质。
(1)用浓H2SO4干燥氧气:
(2)铜片和浓硫酸共热,产生二氧化硫:
(3)纸张、布条、蔗糖等遇浓硫酸会慢慢变黑:
(4)S+ 2H2SO4(浓) = 3SO2 ↑ +2H2O:
交流与讨论
吸水性
酸性、强氧化性
脱水性
强氧化性
△
思考?
用铜和浓硫酸为原料制取硫酸铜,可用下列两种方法:
(1)Cu CuSO4
(2)Cu CuO CuSO4
请写出上述实验中发生反应的化学方程式,并说明哪一种方法较优越?
浓H2SO4
O2
H2SO4
下图是验证碳与浓硫酸反应的产物的装置图,你能说出它们各自的作用吗?
产物
向50ml18mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.等于0.45mol B. 等于0.90mol
C. 小于0.45mol D.在0.45mol与0.90mol之间
课堂巩固:
分析(1)n(H2SO4)=18mol/L×50mL ×10-3=0.90mol
(3)随着反应的进行,浓硫酸转化为稀硫酸,便不再与铜反应。
(2)Cu——2H2SO4——H2SO4(被还原)
若0.90mol浓硫酸全部参加反应,则被还原的为0.45mol.
答案:C
浓、稀硫酸的比较
强
弱
SO2
H2
有
无
S
H
与Zn反应的
气态产物 氧化性
强弱 被还原
的元素 吸水性
脱水性
浓硫酸
稀硫酸
