鲁教版九年级化学第二节 海水“晒盐“(共38张PPT)
文档属性
| 名称 | 鲁教版九年级化学第二节 海水“晒盐“(共38张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-15 10:44:11 | ||
图片预览










文档简介
(共38张PPT)
感悟导入
感悟导入
第二节 海水“晒盐”
1.知道蒸发结晶是海水晒盐的基本原理
2.理解“饱和溶液”“溶解度”“结晶”等概念
3.掌握有关物质溶解度的计算方法
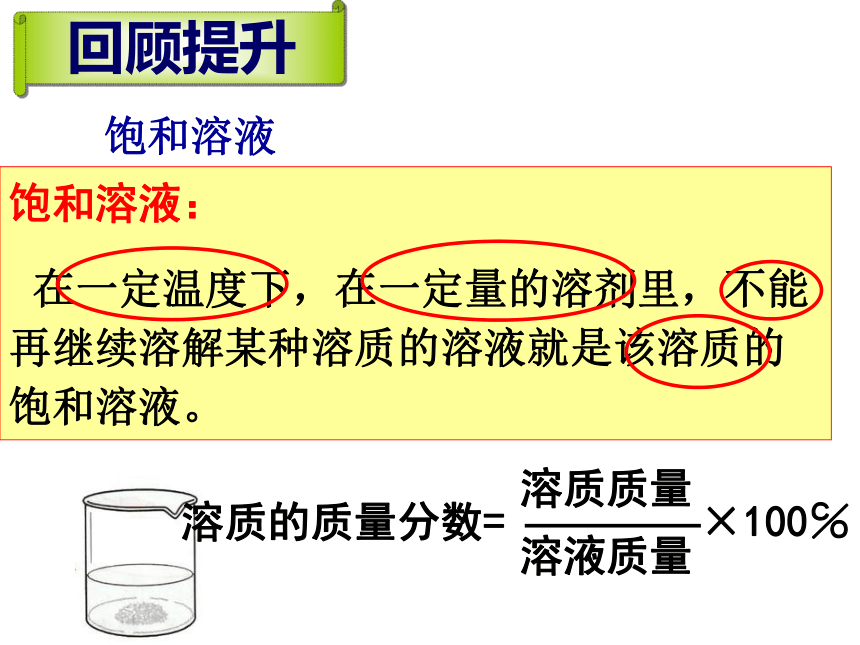
饱和溶液
饱和溶液:
在一定温度下,在一定量的溶剂里,不能再继续溶解某种溶质的溶液就是该溶质的饱和溶液。
回顾提升
溶质的质量分数=
溶质质量
溶液质量
×100℅
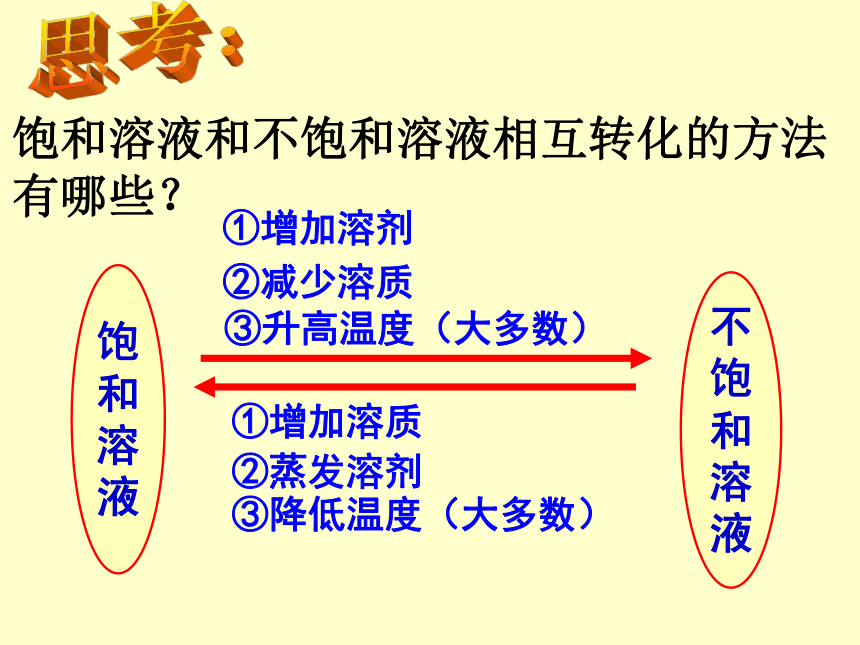
①增加溶质
③降低温度(大多数)
②蒸发溶剂
①增加溶剂
③升高温度(大多数)
饱和溶液和不饱和溶液相互转化的方法有哪些?
饱
和
溶
液
不
饱
和
溶
液
②减少溶质
判断下列溶液是否是饱和溶液?
3、一定温度下,一定量的溶剂中,溶质不再继续溶解的溶液
2、蒸发水或改变温度后能析出溶质的溶液
1、在试管中没有未溶解的固体物质的溶液
不一定
不一定
一定
回顾提升
海水
蒸发池
结晶池
粗盐
母液(苦卤)
多种化工原料
“盐田法”(“太阳能蒸发法”)
风吹日晒
继续日晒
提取
物理变化
一、海水“晒盐”的过程
哪些自然条件有利于海水中的食盐蒸发结晶?
气候温和、光照充足、地势平坦等
盐场:
取少量不饱和氯化钠溶液,滴在洁净的玻璃片上,用电热吹风机向玻璃片上的溶液吹热风,观察现象:
【活动天地8-1】
搅拌,使液体受热均匀,防止飞溅
蒸发皿
结晶皿
实验现象:
有白色晶体析出
食盐晶体
取少量不饱和氯化钠溶液,滴在洁净的玻璃片上,用电热吹风机向玻璃片上的溶液吹热风,观察现象:
【活动天地8-1】
蒸发结晶
结晶:固体物质从它的饱和溶液中以晶体的形式析出的过程叫作结晶。
注:晶体——具有规则几何外形的固体。
结晶
蒸发结晶
降温结晶
重结晶
1、溶解性(最大溶解量、溶解限量):
①定义:一种物质溶解在另一种物质里的能力。
二、溶解度
如: 氯化钠(NaCl)易溶于水,
氢氧化钙[Ca(OH)2]微溶于水,
碳酸钙(CaCO3)难溶于水
物质的溶解性受哪些因素
影响呢?
影响物质溶解性的因素
实验一:探究溶剂种类对物质溶解性的影响
实验步骤:称取等质量的氯化钠和碘,分别加入10mL水和10mL酒精里并振荡,观察溶解情况:
结论一:
【实验探究8-2】
全部溶解
几乎不溶解
几乎不溶解
全部溶解
物质的溶解性与溶剂种类有关
加入10mL水并振荡 加入10mL酒精并振荡
氯化钠
碘
实验二:探究温度对物质溶解性的影响
实验步骤:⑴取一定量硝酸钾固体于试管中,加少量水振荡,使试管底部有少量未溶解的硝酸钾固体;
⑵给试管加热,观察现象;
⑶将加热后的试管放入盛有冷水的烧杯中,观察现象;
结论一:在 保持不变的情况下,当升高温度时,硝酸钾晶体在水中的最大溶解量会 ;当降低温度时,其最大溶解量会 。
【实验探究8-2】
试管底部的硝酸钾全部溶解
试管底部有未溶解的硝酸钾
溶质、溶剂种类
增大
减小
1、溶解性(最大溶解量、溶解限量):
①定义:一种物质溶解在另一种物质里的能力。
②影响因素:
内因:
溶质本身的性质
外因:
化学上通常用溶解度来定量表示某种物质在某种溶剂中的溶解性。
二、溶解度
溶剂种类
温度
2、溶解度:
一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所能溶解的质量,常用S表示。
例:在20℃时,氯化钠在水里的溶解度是36 g的含义是什么?
(1)在20℃时,氯化钠在100 g水里达到饱和状态时所溶解的质量是36g 。
(2)在20℃时,在100 g水里最多溶解氯化钠的质量为36g。
二、溶解度
(1)20℃时,100g水中溶解了23g食盐,则食盐在20℃时的溶解度为23g。
(2)20℃时,100g水中最多溶解NaCl36.5g,则NaCl的溶解度为36.5。
(3)20℃时,100g饱和溶液中含有溶质23g,则该溶质的溶解度为23g。
(4)100g水中最多溶解36.5g NaCl,则NaCl的溶解度为36.5g.
不正确 没有指明溶液是否达到饱和状态;
不正确 没有指明溶解度的单位;
不正确 100g不是溶剂的质量;
不正确 没有指明温度。
判断下列说法是否正确,并说出理由.
溶解度:
一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所能溶解的质量。
‘四要素’
外界条件: 一定温度
溶剂的质量: 100g
溶液的状态: 饱和状态
单位: g
二、溶解度
溶解度与溶解性之间的关系:
溶解度
>10g
1-10g
0.01-1g
< 0.01g
易溶
可溶
微溶
难溶
溶解性
.
.
.
.
50
10
20
30
40
0
60
70
808
90
100
50
10
20
30
40
80
60
70
8 0
90
100
110
180
170
160
150
140
130
120
190
200
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钾
氯化钠
硼酸
温度/℃
.
硝酸钾
.
.
.
.
已知:硝酸钾在不同温度时的溶解度如下所示。
13.3
31.6
20.9
45.8
63.9
85.5
110
138
168
202
246
3、溶解度曲线:
(1)定义:物质的溶解度随温度变化的曲线。
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g
熟石灰的溶解度曲线:
讨论:
固体物质溶解度受温度变化情况:
大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。
少数固体物质溶解度受温度影响不大, 例如氯化钠。
极少数固体物质溶解度随温度升高反而减小,例如熟石灰。
碳酸氢钠
几种物质的溶解度曲线
三种典型的溶解度曲线
0.10
0.20
0 20 40 60 80 100
温度/℃
溶解度∕g
温度∕℃
160
140
120
100
80
60
40
20
200
180
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
(2)溶解度曲线的意义:
A
点
①点:表示在某一
温度时的溶解度
②交点:表示两种
物质在该温度下
的溶解度相同
线
陡:溶解度受温
度影响大(KNO3)
平坦:溶解度受温
度影响小(NaCl)
面
曲线及曲线上方:
饱和状态
曲线下方:
不饱和状态
B
温度∕℃
160
140
120
100
80
60
40
20
200
180
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
(3)溶解度曲线的应用:
(1)判断某物质在不同温度
下的溶解度;
(2)比较同一温度下,不同
物质的溶解度大小和溶质质量分数大小;
(3)判断溶液是否处于饱和
状态;
(4)根据曲线的变化趋势,
设计混合物分离或提纯的方法。
溶解度(克)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸钾
氯化钠
(从溶解度曲线分析结晶情况)
1、降温结晶
(又叫冷却热饱和溶液法)
2、蒸发结晶
适用于溶解度随温度变化较小的物质如:NaCl
适用于溶解度随温度变化较大的物质如:KNO3
温度∕℃
溶解度∕g
分离或提纯
熟石灰的溶解度曲线:
(1)给熟石灰的饱和溶液升高温度会有什么现象?
为什么?
变浑浊,因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出
3、升温结晶
0.10
0.20
0
20 40 60 80 100
温度/℃
硝酸钾中混有氯化钠时,通过什么途径提纯硝酸钾?
氯化钠中混有硝酸钾时,通过什么途径提纯氯化钠?
KNO3(NaCl):
提纯
降温结晶
NaCl (KNO3):
提纯
蒸发结晶
1.如图,A点表示_____________________,
所在溶液是______溶液;
2.B点表示______________________________;
3.80℃时,a的溶解度___ b的溶解度(填“>”“<”或“=”)
80℃时,a的溶解度为85g
饱和
>
不饱和
饱和
A
.C
B
4.C点对于a物质是_________溶液,
对于b物质是_________溶液。
a,b两物质在60 ℃时,溶解度相等为52g
2.A、B、C三种物质的溶解度曲线如图所示:
⑴40℃时B物质的溶解度是多少?
⑵m点表示什么意义?
⑶40℃时,三种物质的溶解度由小到大的顺序是( )
C、B、A
A、B、C
B、A、C
B、C、A
70
30
B
20g
表示B、C两物质在70℃时的溶解度相等
1、除难溶性杂质:
(1)流程:
溶解 →
过滤 →
蒸发
重结晶法
搅拌,加速溶解
引流
搅拌,使受热均匀,防止液体飞溅
三、粗盐的提纯
物理变化
难溶性杂质(泥沙等)
可溶性杂质( SO42-、Ca2+、Mg2+等 )
三、粗盐的提纯
2、除可溶性杂质:(SO42-、Ca2+、Mg2+等)
加入过量的BaCl2溶液
加入过量的NaOH溶液
加入过量的Na2CO3溶液
加入适量的盐酸至pH=7
H2O+CO2
化学变化
①
⑤
④
③
②
⑥
除杂流程顺序
① BaCl2 、 NaOH 、 Na2CO3、 稀HCl
③NaOH 、 BaCl2 、 Na2CO3、 稀HCl
② BaCl2 、 Na2CO3、 NaOH 、 稀HCl
注意:在添加除杂质试剂顺序时,BaCl2 溶液一定要在Na2CO3溶液之前。
(3)食盐的作用:
调味品、食品添加剂、制造烧碱、氯气,盐酸、纯碱、化肥、染料等。
扩展延伸:
1某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙,实验设计如下:
⑴写出A物质的化学式: ;
⑵写出反应②的化学方程式: 。
⑶反应①中加入过量A物质的目是 ;反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度 (填“有”或“没有”)影响。
Na2CO3
Na2CO3+2HCl=2NaCl+H2O+CO2↑
使氯化钙全部被除尽
有
某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。他们要除去杂质得到精盐,设计了下列实验方案(序号①~⑧表示实验操作,用于沉淀的试剂稍过量):
(1)操作①中玻璃棒的作用是 ;
(2)第⑤步操作的名称是 ;
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、
(4)利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号):
搅拌,加速溶解
过滤
蒸发皿
③②④或②④③
完成助学P137---P140
感悟导入
感悟导入
第二节 海水“晒盐”
1.知道蒸发结晶是海水晒盐的基本原理
2.理解“饱和溶液”“溶解度”“结晶”等概念
3.掌握有关物质溶解度的计算方法
饱和溶液
饱和溶液:
在一定温度下,在一定量的溶剂里,不能再继续溶解某种溶质的溶液就是该溶质的饱和溶液。
回顾提升
溶质的质量分数=
溶质质量
溶液质量
×100℅
①增加溶质
③降低温度(大多数)
②蒸发溶剂
①增加溶剂
③升高温度(大多数)
饱和溶液和不饱和溶液相互转化的方法有哪些?
饱
和
溶
液
不
饱
和
溶
液
②减少溶质
判断下列溶液是否是饱和溶液?
3、一定温度下,一定量的溶剂中,溶质不再继续溶解的溶液
2、蒸发水或改变温度后能析出溶质的溶液
1、在试管中没有未溶解的固体物质的溶液
不一定
不一定
一定
回顾提升
海水
蒸发池
结晶池
粗盐
母液(苦卤)
多种化工原料
“盐田法”(“太阳能蒸发法”)
风吹日晒
继续日晒
提取
物理变化
一、海水“晒盐”的过程
哪些自然条件有利于海水中的食盐蒸发结晶?
气候温和、光照充足、地势平坦等
盐场:
取少量不饱和氯化钠溶液,滴在洁净的玻璃片上,用电热吹风机向玻璃片上的溶液吹热风,观察现象:
【活动天地8-1】
搅拌,使液体受热均匀,防止飞溅
蒸发皿
结晶皿
实验现象:
有白色晶体析出
食盐晶体
取少量不饱和氯化钠溶液,滴在洁净的玻璃片上,用电热吹风机向玻璃片上的溶液吹热风,观察现象:
【活动天地8-1】
蒸发结晶
结晶:固体物质从它的饱和溶液中以晶体的形式析出的过程叫作结晶。
注:晶体——具有规则几何外形的固体。
结晶
蒸发结晶
降温结晶
重结晶
1、溶解性(最大溶解量、溶解限量):
①定义:一种物质溶解在另一种物质里的能力。
二、溶解度
如: 氯化钠(NaCl)易溶于水,
氢氧化钙[Ca(OH)2]微溶于水,
碳酸钙(CaCO3)难溶于水
物质的溶解性受哪些因素
影响呢?
影响物质溶解性的因素
实验一:探究溶剂种类对物质溶解性的影响
实验步骤:称取等质量的氯化钠和碘,分别加入10mL水和10mL酒精里并振荡,观察溶解情况:
结论一:
【实验探究8-2】
全部溶解
几乎不溶解
几乎不溶解
全部溶解
物质的溶解性与溶剂种类有关
加入10mL水并振荡 加入10mL酒精并振荡
氯化钠
碘
实验二:探究温度对物质溶解性的影响
实验步骤:⑴取一定量硝酸钾固体于试管中,加少量水振荡,使试管底部有少量未溶解的硝酸钾固体;
⑵给试管加热,观察现象;
⑶将加热后的试管放入盛有冷水的烧杯中,观察现象;
结论一:在 保持不变的情况下,当升高温度时,硝酸钾晶体在水中的最大溶解量会 ;当降低温度时,其最大溶解量会 。
【实验探究8-2】
试管底部的硝酸钾全部溶解
试管底部有未溶解的硝酸钾
溶质、溶剂种类
增大
减小
1、溶解性(最大溶解量、溶解限量):
①定义:一种物质溶解在另一种物质里的能力。
②影响因素:
内因:
溶质本身的性质
外因:
化学上通常用溶解度来定量表示某种物质在某种溶剂中的溶解性。
二、溶解度
溶剂种类
温度
2、溶解度:
一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所能溶解的质量,常用S表示。
例:在20℃时,氯化钠在水里的溶解度是36 g的含义是什么?
(1)在20℃时,氯化钠在100 g水里达到饱和状态时所溶解的质量是36g 。
(2)在20℃时,在100 g水里最多溶解氯化钠的质量为36g。
二、溶解度
(1)20℃时,100g水中溶解了23g食盐,则食盐在20℃时的溶解度为23g。
(2)20℃时,100g水中最多溶解NaCl36.5g,则NaCl的溶解度为36.5。
(3)20℃时,100g饱和溶液中含有溶质23g,则该溶质的溶解度为23g。
(4)100g水中最多溶解36.5g NaCl,则NaCl的溶解度为36.5g.
不正确 没有指明溶液是否达到饱和状态;
不正确 没有指明溶解度的单位;
不正确 100g不是溶剂的质量;
不正确 没有指明温度。
判断下列说法是否正确,并说出理由.
溶解度:
一定温度下,某固体物质在100g溶剂(通常为水)里达到饱和状态时所能溶解的质量。
‘四要素’
外界条件: 一定温度
溶剂的质量: 100g
溶液的状态: 饱和状态
单位: g
二、溶解度
溶解度与溶解性之间的关系:
溶解度
>10g
1-10g
0.01-1g
< 0.01g
易溶
可溶
微溶
难溶
溶解性
.
.
.
.
50
10
20
30
40
0
60
70
808
90
100
50
10
20
30
40
80
60
70
8 0
90
100
110
180
170
160
150
140
130
120
190
200
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钾
氯化钠
硼酸
温度/℃
.
硝酸钾
.
.
.
.
已知:硝酸钾在不同温度时的溶解度如下所示。
13.3
31.6
20.9
45.8
63.9
85.5
110
138
168
202
246
3、溶解度曲线:
(1)定义:物质的溶解度随温度变化的曲线。
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g
熟石灰的溶解度曲线:
讨论:
固体物质溶解度受温度变化情况:
大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。
少数固体物质溶解度受温度影响不大, 例如氯化钠。
极少数固体物质溶解度随温度升高反而减小,例如熟石灰。
碳酸氢钠
几种物质的溶解度曲线
三种典型的溶解度曲线
0.10
0.20
0 20 40 60 80 100
温度/℃
溶解度∕g
温度∕℃
160
140
120
100
80
60
40
20
200
180
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
(2)溶解度曲线的意义:
A
点
①点:表示在某一
温度时的溶解度
②交点:表示两种
物质在该温度下
的溶解度相同
线
陡:溶解度受温
度影响大(KNO3)
平坦:溶解度受温
度影响小(NaCl)
面
曲线及曲线上方:
饱和状态
曲线下方:
不饱和状态
B
温度∕℃
160
140
120
100
80
60
40
20
200
180
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
(3)溶解度曲线的应用:
(1)判断某物质在不同温度
下的溶解度;
(2)比较同一温度下,不同
物质的溶解度大小和溶质质量分数大小;
(3)判断溶液是否处于饱和
状态;
(4)根据曲线的变化趋势,
设计混合物分离或提纯的方法。
溶解度(克)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸钾
氯化钠
(从溶解度曲线分析结晶情况)
1、降温结晶
(又叫冷却热饱和溶液法)
2、蒸发结晶
适用于溶解度随温度变化较小的物质如:NaCl
适用于溶解度随温度变化较大的物质如:KNO3
温度∕℃
溶解度∕g
分离或提纯
熟石灰的溶解度曲线:
(1)给熟石灰的饱和溶液升高温度会有什么现象?
为什么?
变浑浊,因为熟石灰的溶解度随温度升高而减小,升温后会有熟石灰固体析出
3、升温结晶
0.10
0.20
0
20 40 60 80 100
温度/℃
硝酸钾中混有氯化钠时,通过什么途径提纯硝酸钾?
氯化钠中混有硝酸钾时,通过什么途径提纯氯化钠?
KNO3(NaCl):
提纯
降温结晶
NaCl (KNO3):
提纯
蒸发结晶
1.如图,A点表示_____________________,
所在溶液是______溶液;
2.B点表示______________________________;
3.80℃时,a的溶解度___ b的溶解度(填“>”“<”或“=”)
80℃时,a的溶解度为85g
饱和
>
不饱和
饱和
A
.C
B
4.C点对于a物质是_________溶液,
对于b物质是_________溶液。
a,b两物质在60 ℃时,溶解度相等为52g
2.A、B、C三种物质的溶解度曲线如图所示:
⑴40℃时B物质的溶解度是多少?
⑵m点表示什么意义?
⑶40℃时,三种物质的溶解度由小到大的顺序是( )
C、B、A
A、B、C
B、A、C
B、C、A
70
30
B
20g
表示B、C两物质在70℃时的溶解度相等
1、除难溶性杂质:
(1)流程:
溶解 →
过滤 →
蒸发
重结晶法
搅拌,加速溶解
引流
搅拌,使受热均匀,防止液体飞溅
三、粗盐的提纯
物理变化
难溶性杂质(泥沙等)
可溶性杂质( SO42-、Ca2+、Mg2+等 )
三、粗盐的提纯
2、除可溶性杂质:(SO42-、Ca2+、Mg2+等)
加入过量的BaCl2溶液
加入过量的NaOH溶液
加入过量的Na2CO3溶液
加入适量的盐酸至pH=7
H2O+CO2
化学变化
①
⑤
④
③
②
⑥
除杂流程顺序
① BaCl2 、 NaOH 、 Na2CO3、 稀HCl
③NaOH 、 BaCl2 、 Na2CO3、 稀HCl
② BaCl2 、 Na2CO3、 NaOH 、 稀HCl
注意:在添加除杂质试剂顺序时,BaCl2 溶液一定要在Na2CO3溶液之前。
(3)食盐的作用:
调味品、食品添加剂、制造烧碱、氯气,盐酸、纯碱、化肥、染料等。
扩展延伸:
1某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙,实验设计如下:
⑴写出A物质的化学式: ;
⑵写出反应②的化学方程式: 。
⑶反应①中加入过量A物质的目是 ;反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度 (填“有”或“没有”)影响。
Na2CO3
Na2CO3+2HCl=2NaCl+H2O+CO2↑
使氯化钙全部被除尽
有
某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。他们要除去杂质得到精盐,设计了下列实验方案(序号①~⑧表示实验操作,用于沉淀的试剂稍过量):
(1)操作①中玻璃棒的作用是 ;
(2)第⑤步操作的名称是 ;
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、
(4)利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号):
搅拌,加速溶解
过滤
蒸发皿
③②④或②④③
完成助学P137---P140
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
