苏教版 高中化学 必修二 2019-2020学年 专题二 第一单元 化学反应速率与反应的限度 1.1 化学反应速率 (共22张PPT)
文档属性
| 名称 | 苏教版 高中化学 必修二 2019-2020学年 专题二 第一单元 化学反应速率与反应的限度 1.1 化学反应速率 (共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-16 16:55:30 | ||
图片预览







文档简介
(共22张PPT)
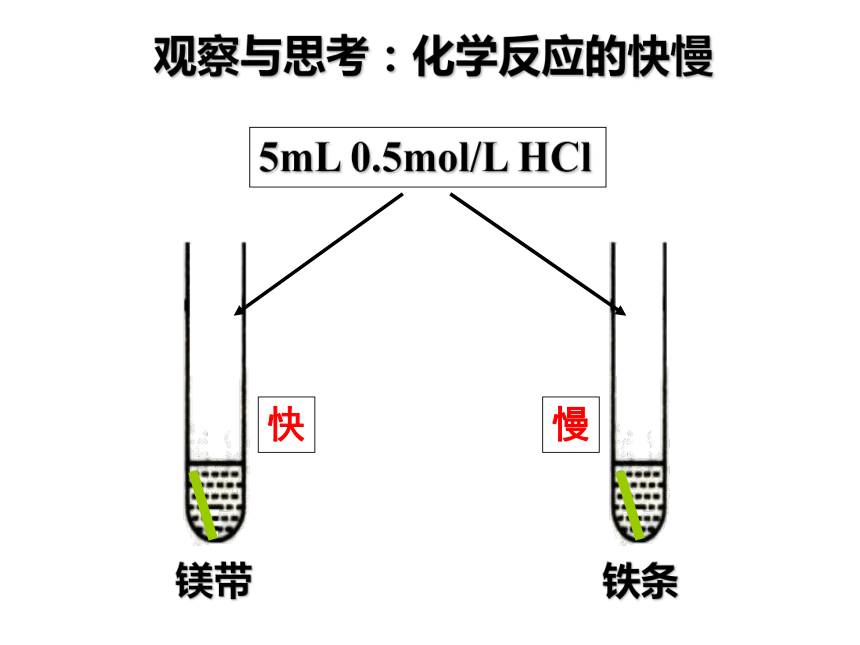
5mL 0.5mol/L HCl
观察与思考:化学反应的快慢
镁带
铁条
快
慢
或mol/(L·min) mol/(L·s)
一、化学反应速率
1、定义:
用 反应物浓度的 或
生成物浓度的 来表示。
2、公式:
3、单位:
mol·(L·min) -1 mol·(L·s)-1
化学反应速率是用来衡量化学反应
进行的快慢的物理量。
单位时间内
减少
增加
问题1:分别用O2和SO3的浓度变化来计算该反应速率。
问题2:v (SO3)与v (O2) 意义是否相同?数值上有何关系?
问题3:总结化学反应速率的特点。
例题:
在2SO2+O2 2SO3反应中:10秒后,O2物质的量浓度减小了1mol·L-1,SO3物质的量浓度增加了2mol·L-1,
催化剂
Δ
化学反应速率的特点:
①化学反应速率表示的是一段时间内的平均速率,而不是指瞬时速率,均取正值。
②同一反应的速率可用不同物质来表示,其数值可能不同,但表示的意义相同,所以需要指明具体物质,如v (B)。
③固体或纯液体,其浓度可视为常数。因此不用固体或纯液体表示化学反应速率。
例:反应4NH3+5O2 4NO+6H2O 在5升的密闭容器中进行,30秒后,NO 的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?
问1:若用O2的浓度变化来表示此反应速率是多少?
问2:v(NO)=0.002mol/(L·s) 与v(O2)=0.0025mol/(L·s)是否表示此反应的同一种速率?数值上有何规律?
v(NO)=0.002mol/(L·s)
v(O2)=0.0025mol/(L·s)
问3:小结化学反应速率表示时的注意点、规律。
④对于反应 aA+bB=cC+dD,速率关系式:
v (A)∶v (B)∶v (C)∶v (D) = a : b : c : d = △ n(A)∶ △ n(B)∶ △ n (C)∶ △ n (D) = △ c(A)∶ △ c(B)∶ △ c (C)∶ △ c (D)
同一化学反应,用不同的物质表示的化学反应速率之比等于化学反应方程式中相应物质的化学计量数之比;等于相应物质变化的物质的量之比;等于相应物质变化的浓度之比。
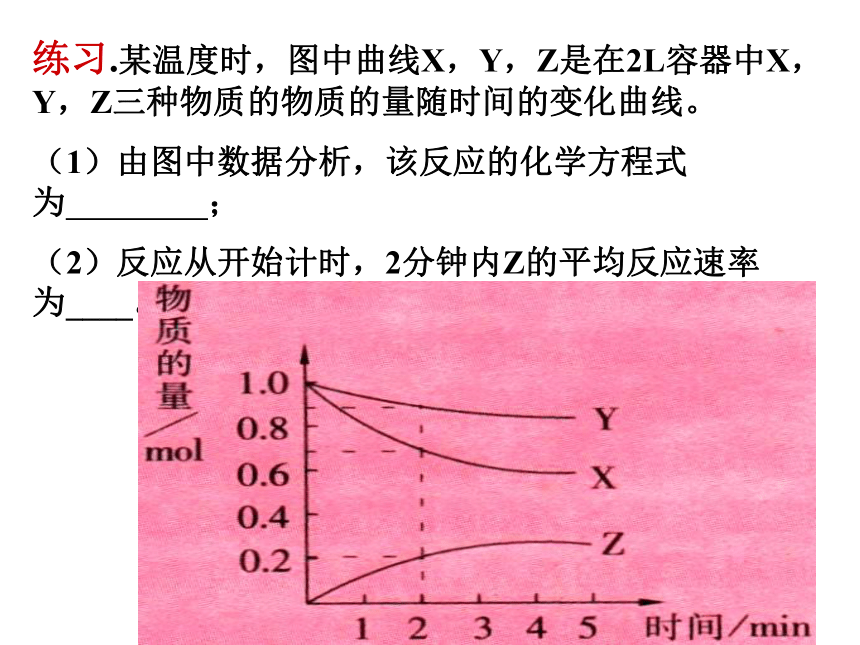
练习.某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线。
(1)由图中数据分析,该反应的化学方程式为 ;
(2)反应从开始计时,2分钟内Z的平均反应速率为____。
3.在四个不同的容器中,在不同的条件下进行合成氨的反应,测得的速率如下,其中生成氨的速率最快的是 ( )
A. v ( H2 )= 0.45 mol/ (L·min)
B. v ( N2 )= 0.1 mol/ (L·min)
C. v ( N2 )= 0.2mol/ (L·min)
D. v ( NH3 ) 0.3mol/ (L·min)
C
即学即练:
结论:在同一反应中,反应速率大小不能单纯看数值大小,应化成同一物质的反应速率再进行比较
练习:在25℃时,向100mL含HCl 14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为
(2)后4s内用HCl表示的平均反应速率为
(3)前2s与后4s比较,反应速 较快,其原因可能
0.25mol/(L·s)
0.25mol/(L·s)
前2s
前2s时段盐酸浓度比后4s时段大
(4)能用表示Fe化学反应速率吗?
2、外界条件对化学反应速率的影响
水浴加热产生
气泡快
加入二氧化锰粉末产生气泡快
加热能加快反应速率
使用催化剂能加快反应速率
浓度大的产生气泡快
增大反应物的浓度能加快反应速率
实验方案 实验现象 结论
实验一:
实验二:
实验三:
2、外界条件对化学反应速率的影响
(1)浓度对化学反应速率的影响
其它条件相同时,增大反应物的浓度可以增大化学反应速率
某同学在进行铜和足量的浓硫酸反应时,除了采用加热的条件,他设想将铜的投入量增加,以使反应速率增加,你认为这种设想对吗?
(2)压强对化学反应速率的影响
对于有气体参加的反应:其它条件相同时,
增大压强,可以增大化学反应速率。
减小压强,可以减小化学反应速率。
如果反应物是固体、液体、溶液时,改变压强对反应速率没有影响。
(3)温度对化学反应速率的影响
升高温度,可以增大化学反应速率
降低温度,可以减小化学反应速率
每升高10℃ ,化学反应速率通常增大到原来的2~4倍。
其它条件相同时,
(4)催化剂对化学反应速率的影响
使用催化剂,能显著地增大反应速率。
问题解决
1、应用化学反应速率的有关知识解释下列问题
(1)氢气能在氧气中安静燃烧,点燃氢气和氧气的混合气体为什么会发生爆炸?
(2)燃烧含硫矿石制备SO2时,要把矿石粉碎成颗粒状,在沸腾炉内鼓入强大空气流,把矿粒吹的剧烈翻腾
(3)一小块白磷露置在空气中,一段时间后会突然燃烧
(4)工业上用N2和H2合成氨需要使用催化剂
5、其它条件对化学反应速率的影响
固体反应物颗粒的大小、反应物接触面积等因素对化学反应速率也有影响。某些反应也会受光、超声波、磁场等影响而改变反应速率。
2.为了研究CaCO3与稀盐酸反应的反应速率,某
同学通过实验测定反应中生成的CO2体积随反
应时间变化的情况,见图。请分析以下问题: ⑴在O-t1 、t1–t2 、t2–t3
各相同的时间段里,反应
速率最大的是 时间
段,收集到气体最多的是
时间段。
t1–t2
t1–t2
2.为了研究CaCO3与稀盐酸反应的反应速率,某
同学通过实验测定反应中生成的CO2体积随反
应时间变化的情况,见图。请分析以下问题: ⑵试分析三个时间段里,
反应速率不同的可能
原因(该反应放热)。
反应放热使体系温度升高,使t1–t2段的反应速率比O–t1段的快。
随着反应的进行,盐酸浓度逐渐减少,使t2后的反应速率逐渐减小。
2.为了研究CaCO3与稀盐酸反应的反应速率,某
同学通过实验测定反应中生成的CO2体积随反
应时间变化的情况,见图。请分析以下问题: ⑶在t4后,为什么收集到的
气体的体积不再增加?
反应物已全部消耗,反应不再进行。
2、为了研究碳酸钙与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制出图2-1所示的曲线,请分析讨论一下问题
(1)在0-t1、t1-t2、t2-t3各相同的时间段里,反应速率最大的是——------时间段,收集到气体最多的是 -----------时间段
(2)试分析三个时间段里,
反应速率不同的可能原因是
(该反应是放热反应)
(3)在t4后,为什么收集到
的气体的体积不在增加?
5mL 0.5mol/L HCl
观察与思考:化学反应的快慢
镁带
铁条
快
慢
或mol/(L·min) mol/(L·s)
一、化学反应速率
1、定义:
用 反应物浓度的 或
生成物浓度的 来表示。
2、公式:
3、单位:
mol·(L·min) -1 mol·(L·s)-1
化学反应速率是用来衡量化学反应
进行的快慢的物理量。
单位时间内
减少
增加
问题1:分别用O2和SO3的浓度变化来计算该反应速率。
问题2:v (SO3)与v (O2) 意义是否相同?数值上有何关系?
问题3:总结化学反应速率的特点。
例题:
在2SO2+O2 2SO3反应中:10秒后,O2物质的量浓度减小了1mol·L-1,SO3物质的量浓度增加了2mol·L-1,
催化剂
Δ
化学反应速率的特点:
①化学反应速率表示的是一段时间内的平均速率,而不是指瞬时速率,均取正值。
②同一反应的速率可用不同物质来表示,其数值可能不同,但表示的意义相同,所以需要指明具体物质,如v (B)。
③固体或纯液体,其浓度可视为常数。因此不用固体或纯液体表示化学反应速率。
例:反应4NH3+5O2 4NO+6H2O 在5升的密闭容器中进行,30秒后,NO 的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?
问1:若用O2的浓度变化来表示此反应速率是多少?
问2:v(NO)=0.002mol/(L·s) 与v(O2)=0.0025mol/(L·s)是否表示此反应的同一种速率?数值上有何规律?
v(NO)=0.002mol/(L·s)
v(O2)=0.0025mol/(L·s)
问3:小结化学反应速率表示时的注意点、规律。
④对于反应 aA+bB=cC+dD,速率关系式:
v (A)∶v (B)∶v (C)∶v (D) = a : b : c : d = △ n(A)∶ △ n(B)∶ △ n (C)∶ △ n (D) = △ c(A)∶ △ c(B)∶ △ c (C)∶ △ c (D)
同一化学反应,用不同的物质表示的化学反应速率之比等于化学反应方程式中相应物质的化学计量数之比;等于相应物质变化的物质的量之比;等于相应物质变化的浓度之比。
练习.某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线。
(1)由图中数据分析,该反应的化学方程式为 ;
(2)反应从开始计时,2分钟内Z的平均反应速率为____。
3.在四个不同的容器中,在不同的条件下进行合成氨的反应,测得的速率如下,其中生成氨的速率最快的是 ( )
A. v ( H2 )= 0.45 mol/ (L·min)
B. v ( N2 )= 0.1 mol/ (L·min)
C. v ( N2 )= 0.2mol/ (L·min)
D. v ( NH3 ) 0.3mol/ (L·min)
C
即学即练:
结论:在同一反应中,反应速率大小不能单纯看数值大小,应化成同一物质的反应速率再进行比较
练习:在25℃时,向100mL含HCl 14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为
(2)后4s内用HCl表示的平均反应速率为
(3)前2s与后4s比较,反应速 较快,其原因可能
0.25mol/(L·s)
0.25mol/(L·s)
前2s
前2s时段盐酸浓度比后4s时段大
(4)能用表示Fe化学反应速率吗?
2、外界条件对化学反应速率的影响
水浴加热产生
气泡快
加入二氧化锰粉末产生气泡快
加热能加快反应速率
使用催化剂能加快反应速率
浓度大的产生气泡快
增大反应物的浓度能加快反应速率
实验方案 实验现象 结论
实验一:
实验二:
实验三:
2、外界条件对化学反应速率的影响
(1)浓度对化学反应速率的影响
其它条件相同时,增大反应物的浓度可以增大化学反应速率
某同学在进行铜和足量的浓硫酸反应时,除了采用加热的条件,他设想将铜的投入量增加,以使反应速率增加,你认为这种设想对吗?
(2)压强对化学反应速率的影响
对于有气体参加的反应:其它条件相同时,
增大压强,可以增大化学反应速率。
减小压强,可以减小化学反应速率。
如果反应物是固体、液体、溶液时,改变压强对反应速率没有影响。
(3)温度对化学反应速率的影响
升高温度,可以增大化学反应速率
降低温度,可以减小化学反应速率
每升高10℃ ,化学反应速率通常增大到原来的2~4倍。
其它条件相同时,
(4)催化剂对化学反应速率的影响
使用催化剂,能显著地增大反应速率。
问题解决
1、应用化学反应速率的有关知识解释下列问题
(1)氢气能在氧气中安静燃烧,点燃氢气和氧气的混合气体为什么会发生爆炸?
(2)燃烧含硫矿石制备SO2时,要把矿石粉碎成颗粒状,在沸腾炉内鼓入强大空气流,把矿粒吹的剧烈翻腾
(3)一小块白磷露置在空气中,一段时间后会突然燃烧
(4)工业上用N2和H2合成氨需要使用催化剂
5、其它条件对化学反应速率的影响
固体反应物颗粒的大小、反应物接触面积等因素对化学反应速率也有影响。某些反应也会受光、超声波、磁场等影响而改变反应速率。
2.为了研究CaCO3与稀盐酸反应的反应速率,某
同学通过实验测定反应中生成的CO2体积随反
应时间变化的情况,见图。请分析以下问题: ⑴在O-t1 、t1–t2 、t2–t3
各相同的时间段里,反应
速率最大的是 时间
段,收集到气体最多的是
时间段。
t1–t2
t1–t2
2.为了研究CaCO3与稀盐酸反应的反应速率,某
同学通过实验测定反应中生成的CO2体积随反
应时间变化的情况,见图。请分析以下问题: ⑵试分析三个时间段里,
反应速率不同的可能
原因(该反应放热)。
反应放热使体系温度升高,使t1–t2段的反应速率比O–t1段的快。
随着反应的进行,盐酸浓度逐渐减少,使t2后的反应速率逐渐减小。
2.为了研究CaCO3与稀盐酸反应的反应速率,某
同学通过实验测定反应中生成的CO2体积随反
应时间变化的情况,见图。请分析以下问题: ⑶在t4后,为什么收集到的
气体的体积不再增加?
反应物已全部消耗,反应不再进行。
2、为了研究碳酸钙与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制出图2-1所示的曲线,请分析讨论一下问题
(1)在0-t1、t1-t2、t2-t3各相同的时间段里,反应速率最大的是——------时间段,收集到气体最多的是 -----------时间段
(2)试分析三个时间段里,
反应速率不同的可能原因是
(该反应是放热反应)
(3)在t4后,为什么收集到
的气体的体积不在增加?
