人教版九年级化学下册第八单元课题2、金属的化学性质课件 (共25张PPT)
文档属性
| 名称 | 人教版九年级化学下册第八单元课题2、金属的化学性质课件 (共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 13.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-16 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
第八单元 金属和金属材料
Fe
Cu
Mg
Zn
Al
Au
(第1课时)
金属的化学性质(第1课时)
学习目标:
1.知识与技能:常见金属化学性质判定原则。
2.过程与方法:学会运用科学的方法探究金属的化学性
质。
3.情感态度价值观:
(1)培养勤于思考、严谨求实、勇于实践的科学精神;
(2)了解化学与生活的密切联系。
发出耀眼的白光,放热,生成白色固体
火星四射,放出大量的热,生成黑色固体
除了这些金属之外,其它金属是否也可以与氧气反应呢?
实 验 现 象 化学方程式
镁条在空气中燃烧 ? ?
铁丝在氧气中燃烧 ? ?
探究实验一、用坩埚钳夹持铜片在酒精灯上加热。仔细观察金属表面的变化并记录现象。
金属与氧气的反应
探究一:加热铜片
探究二:加热铝箔
探究实验二、用坩埚钳夹持铝箔在酒精灯上加热。仔细观察金属表面的变化并记录现象。
用坩埚钳分别夹持铜片和铝片在酒精灯上加热,现象与分析。
不燃烧,铜由红色变为黑色。
铝熔化,但也没有燃烧。
金属与氧气的反应
铝与空气接触,铝箔表面生成致密的氧化铝薄膜,阻止铝进一步与氧气反应。
黄金能在空气中燃烧?
真金不怕火炼:即使在高温时也不与氧气反应。
金属与氧气的反应
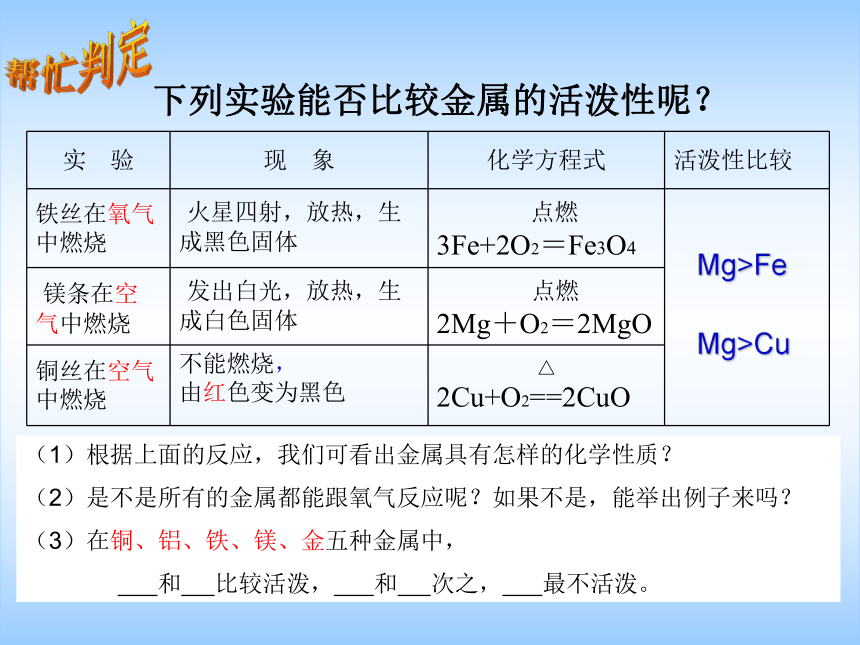
下列实验能否比较金属的活泼性呢?
Mg>Fe
Mg>Cu
(1)根据上面的反应,我们可看出金属具有怎样的化学性质?
(2)是不是所有的金属都能跟氧气反应呢?如果不是,能举出例子来吗?
(3)在铜、铝、铁、镁、金五种金属中,
和 比较活泼, 和 次之, 最不活泼。
实 验 现 象 化学方程式 活泼性比较
铁丝在氧气中燃烧 ?火星四射,放热,生成黑色固体 ? 点燃
3Fe+2O2=Fe3O4
镁条在空气中燃烧 ?发出白光,放热,生成白色固体 ?? 点燃
2Mg+O2=2MgO
铜丝在空气中燃烧 不能燃烧,
由红色变为黑色 △
2Cu+O2==2CuO
“戒指”鉴别方法一
(通过前面的活动探究,发现可以根据金属与氧气反应的难易程度来推测金属的活泼性强弱。大头儿子还会想到其它的方法吗?)
学完金属与氧气反应的化学性质,你知道大头儿子可以通过什么方法来鉴别戒指的真假吗?
(提示:假黄金通常是铜锌合金)
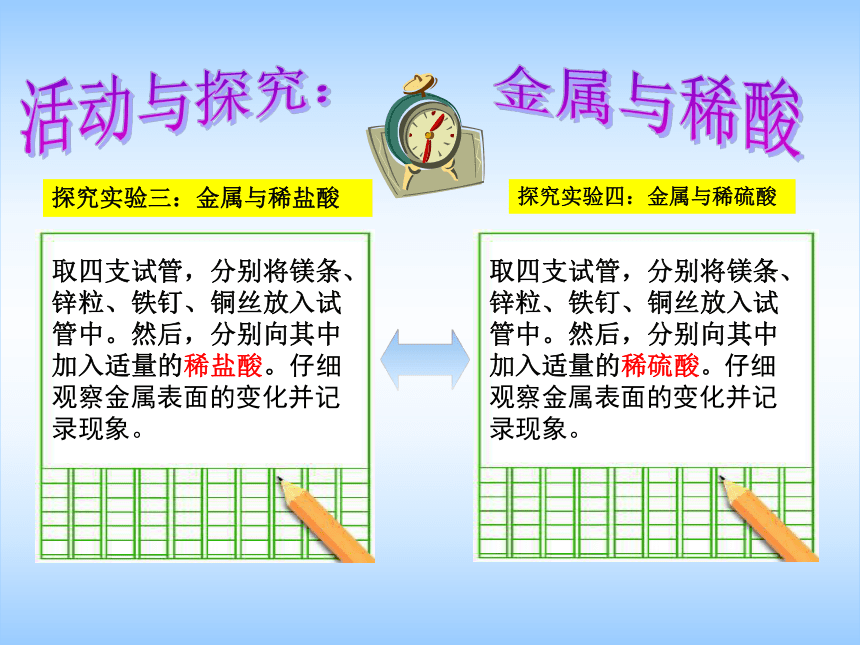
取四支试管,分别将镁条、锌粒、铁钉、铜丝放入试管中。然后,分别向其中加入适量的稀硫酸。仔细
观察金属表面的变化并记录现象。
取四支试管,分别将镁条、锌粒、铁钉、铜丝放入试管中。然后,分别向其中加入适量的稀盐酸。仔细观察金属表面的变化并记录现象。
探究实验三:金属与稀盐酸
探究实验四:金属与稀硫酸
根据探究实验描述现象
小游戏:观察此图,请你找不同!
教材插图
讨论:1、哪些金属能与盐酸、稀硫酸发生反应?哪些金属不能与
盐酸、稀硫酸发生反应?
铁钉和稀酸
镁和稀酸
锌和稀酸
铜和稀酸
铁、镁、锌能和稀盐酸或稀硫酸反应,铜不能和稀盐酸或稀硫酸反应。
2、铁、镁、锌和稀盐酸或稀硫酸反应时剧烈程度不同。
____反应最剧烈,其次是 _____,然后是_____ 。
镁
锌
铁
一种可燃性气体的发现
16世纪中叶,瑞士化学家帕拉塞斯和17世纪英国化学家卡文迪许以及其他一些化学家,都发现有些金属与酸反应可以生成一种可燃性气体,并且发现不同金属反应的剧烈程度不一样。后来经过研究发现该气体为氢气(化学式:H2)。
(Henry Cavendish,1731~1810年)
照葫芦画瓢:请根据已知反应方程式书写剩余化学反应方程式。
小贴士:镁、锌、铁等与稀酸反应的产物里,化合物中金属元素均为+2价。
Zn + 2HCl == H2 ↑ + ZnCl2
Fe + 2HCl == H2 ↑ + FeCl2
Zn + H2SO4 == H2 ↑ + ZnSO4
Fe + H2SO4 == H2 ↑ + FeSO4
Mg + H2SO4 == H2 ↑ + MgSO4
金属与稀酸反应 反应方程式
镁和稀盐酸 Mg + 2HCl == H2 ↑ + MgCl2
锌与稀盐酸
铁与稀盐酸
镁与稀硫酸
锌与稀硫酸
铁与稀硫酸
“戒指”鉴别方法二
学完金属与稀酸反应的化学性质,你知道大头儿子还可以通过什么方法来鉴别戒指的真假吗?
(提示:假黄金通常是铜锌合金)
讨论:下列反应方程式有何共同特征?
Mg + 2HCl == H2 ↑ + MgCl2
Mg + H2SO4 == H2 ↑ + MgSO4
Zn + 2HCl == H2 ↑ + ZnCl2
Zn + H2SO4 == H2 ↑ + ZnSO4
Fe + 2HCl == H2 ↑ + FeCl2
Fe + H2SO4 == H2 ↑ + FeSO4
单质
化合物
单质
化合物
+ → +
温馨提示:小伙伴们可以从物质的类别上进行分析哦!
1、 反应物和产物都只有两种;
2、反应物是单质和化合物,产物也是单质和化合物;
置换反应:
一种单质和一种化合物反应,生成另一种单
质和另一种化合物的反应。
反应特征:A + BC → AC + B
小结:化学基本反应类型
多变一
一变多
一单换一单
注意!
金属置换出的是酸中的_____
氢
(1)化合反应
(2)分解反应
(3)置换反应
判断下列反应是否是置换反应?
1. Mg+CuO=Cu+MgO
2. CH4+2O2 = CO2+2H2O
3. CuO+CO=Cu+CO2
4. C+2CuO = 2Cu+CO2↑
5. CaCO3+2HCl=CaCl2+H2O+CO2 ↑
6. 2H2O2 = 2H2O+O2↑
△
点燃
高温
MnO2
△
×
×
×
×
√
√
1.金属的化学性质:
(1)大多数金属能与氧气反应;
(2)大多数金属能与稀盐酸或稀硫酸反应。
2.判断常见金属活泼性的方法
(1)金属与氧气反应的难易程度;
(2)金属与酸反应的剧烈程度。
3.置换反应:单质+化合物 → 单质+化合物
归纳总结
1.遇稀盐酸不产生气体的是( )
A.铁片 B.铜片 C.铝片 D.石灰片
2.收藏家收藏的清末铝制艺术品,至今保存完好,该艺术品未被锈蚀的主要原因是 ( )
A.铝不易被氧化 B.铝的氧化物容易发生还原反应
C.铝不易发生化学反应
D.铝表面的氧化铝具有保护作用
3.近年来,经过我国科学家的努力,制造出了国产芯片“龙芯一号”和“龙芯二号”。芯片的核心部件是以高纯度的单质硅为原材料制造的。用化学方法制得高纯度硅的反应原理是:SiCl4+2H2 ==Si+4HCl,该反应属于( )
A.化合反应 B.复分解反应 C.置换反应 D.分解反应
选择题
1、铝锅底部黏有水垢(主要成分为CaCO3),可用稀盐酸清除,但盐酸不宜过多的原因:
(1)________________________
(2)________________________
2.芋头梗、酸笋汤是大家喜欢的一道菜肴。聪明的妈妈常常用沙锅而不用铁锅、铝锅煮,你知道其中的原因吗?
答:芋头梗、酸笋汤中的酸类物质会与铁、铝发生反应,大大缩短铁锅和铝锅的使用寿命。
选做题
1.一般情况下,金属越活泼,与酸反应的速度越快。
为了探究金属Mg、Zn、Fe与酸反应的快慢,
某研究性学习小组设计了如下的实验。
【实验步骤】
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液,
②分别加入足量的、大小相等的Mg、Zn、Fe,立即
把三个相同的气球分别套在各试管口上。
【实验预测与分析】
(1)写出铁与盐酸反应的化学方程式_________。
(2)气球膨胀速度最快的是______(填试管编号)。
(3)该实验表明,实验室一般选用锌而不选用镁、铁
制取氢气的主要原因是 。
(4)步骤②是实验获得成功的关键,
你认为在操作过程中小组成员之间应该: 。
思考题:
2.相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。
m
t
a
b
c
0
Mg
Fe
Zn
t2
t1
t3
第八单元 金属和金属材料
Fe
Cu
Mg
Zn
Al
Au
(第1课时)
金属的化学性质(第1课时)
学习目标:
1.知识与技能:常见金属化学性质判定原则。
2.过程与方法:学会运用科学的方法探究金属的化学性
质。
3.情感态度价值观:
(1)培养勤于思考、严谨求实、勇于实践的科学精神;
(2)了解化学与生活的密切联系。
发出耀眼的白光,放热,生成白色固体
火星四射,放出大量的热,生成黑色固体
除了这些金属之外,其它金属是否也可以与氧气反应呢?
实 验 现 象 化学方程式
镁条在空气中燃烧 ? ?
铁丝在氧气中燃烧 ? ?
探究实验一、用坩埚钳夹持铜片在酒精灯上加热。仔细观察金属表面的变化并记录现象。
金属与氧气的反应
探究一:加热铜片
探究二:加热铝箔
探究实验二、用坩埚钳夹持铝箔在酒精灯上加热。仔细观察金属表面的变化并记录现象。
用坩埚钳分别夹持铜片和铝片在酒精灯上加热,现象与分析。
不燃烧,铜由红色变为黑色。
铝熔化,但也没有燃烧。
金属与氧气的反应
铝与空气接触,铝箔表面生成致密的氧化铝薄膜,阻止铝进一步与氧气反应。
黄金能在空气中燃烧?
真金不怕火炼:即使在高温时也不与氧气反应。
金属与氧气的反应
下列实验能否比较金属的活泼性呢?
Mg>Fe
Mg>Cu
(1)根据上面的反应,我们可看出金属具有怎样的化学性质?
(2)是不是所有的金属都能跟氧气反应呢?如果不是,能举出例子来吗?
(3)在铜、铝、铁、镁、金五种金属中,
和 比较活泼, 和 次之, 最不活泼。
实 验 现 象 化学方程式 活泼性比较
铁丝在氧气中燃烧 ?火星四射,放热,生成黑色固体 ? 点燃
3Fe+2O2=Fe3O4
镁条在空气中燃烧 ?发出白光,放热,生成白色固体 ?? 点燃
2Mg+O2=2MgO
铜丝在空气中燃烧 不能燃烧,
由红色变为黑色 △
2Cu+O2==2CuO
“戒指”鉴别方法一
(通过前面的活动探究,发现可以根据金属与氧气反应的难易程度来推测金属的活泼性强弱。大头儿子还会想到其它的方法吗?)
学完金属与氧气反应的化学性质,你知道大头儿子可以通过什么方法来鉴别戒指的真假吗?
(提示:假黄金通常是铜锌合金)
取四支试管,分别将镁条、锌粒、铁钉、铜丝放入试管中。然后,分别向其中加入适量的稀硫酸。仔细
观察金属表面的变化并记录现象。
取四支试管,分别将镁条、锌粒、铁钉、铜丝放入试管中。然后,分别向其中加入适量的稀盐酸。仔细观察金属表面的变化并记录现象。
探究实验三:金属与稀盐酸
探究实验四:金属与稀硫酸
根据探究实验描述现象
小游戏:观察此图,请你找不同!
教材插图
讨论:1、哪些金属能与盐酸、稀硫酸发生反应?哪些金属不能与
盐酸、稀硫酸发生反应?
铁钉和稀酸
镁和稀酸
锌和稀酸
铜和稀酸
铁、镁、锌能和稀盐酸或稀硫酸反应,铜不能和稀盐酸或稀硫酸反应。
2、铁、镁、锌和稀盐酸或稀硫酸反应时剧烈程度不同。
____反应最剧烈,其次是 _____,然后是_____ 。
镁
锌
铁
一种可燃性气体的发现
16世纪中叶,瑞士化学家帕拉塞斯和17世纪英国化学家卡文迪许以及其他一些化学家,都发现有些金属与酸反应可以生成一种可燃性气体,并且发现不同金属反应的剧烈程度不一样。后来经过研究发现该气体为氢气(化学式:H2)。
(Henry Cavendish,1731~1810年)
照葫芦画瓢:请根据已知反应方程式书写剩余化学反应方程式。
小贴士:镁、锌、铁等与稀酸反应的产物里,化合物中金属元素均为+2价。
Zn + 2HCl == H2 ↑ + ZnCl2
Fe + 2HCl == H2 ↑ + FeCl2
Zn + H2SO4 == H2 ↑ + ZnSO4
Fe + H2SO4 == H2 ↑ + FeSO4
Mg + H2SO4 == H2 ↑ + MgSO4
金属与稀酸反应 反应方程式
镁和稀盐酸 Mg + 2HCl == H2 ↑ + MgCl2
锌与稀盐酸
铁与稀盐酸
镁与稀硫酸
锌与稀硫酸
铁与稀硫酸
“戒指”鉴别方法二
学完金属与稀酸反应的化学性质,你知道大头儿子还可以通过什么方法来鉴别戒指的真假吗?
(提示:假黄金通常是铜锌合金)
讨论:下列反应方程式有何共同特征?
Mg + 2HCl == H2 ↑ + MgCl2
Mg + H2SO4 == H2 ↑ + MgSO4
Zn + 2HCl == H2 ↑ + ZnCl2
Zn + H2SO4 == H2 ↑ + ZnSO4
Fe + 2HCl == H2 ↑ + FeCl2
Fe + H2SO4 == H2 ↑ + FeSO4
单质
化合物
单质
化合物
+ → +
温馨提示:小伙伴们可以从物质的类别上进行分析哦!
1、 反应物和产物都只有两种;
2、反应物是单质和化合物,产物也是单质和化合物;
置换反应:
一种单质和一种化合物反应,生成另一种单
质和另一种化合物的反应。
反应特征:A + BC → AC + B
小结:化学基本反应类型
多变一
一变多
一单换一单
注意!
金属置换出的是酸中的_____
氢
(1)化合反应
(2)分解反应
(3)置换反应
判断下列反应是否是置换反应?
1. Mg+CuO=Cu+MgO
2. CH4+2O2 = CO2+2H2O
3. CuO+CO=Cu+CO2
4. C+2CuO = 2Cu+CO2↑
5. CaCO3+2HCl=CaCl2+H2O+CO2 ↑
6. 2H2O2 = 2H2O+O2↑
△
点燃
高温
MnO2
△
×
×
×
×
√
√
1.金属的化学性质:
(1)大多数金属能与氧气反应;
(2)大多数金属能与稀盐酸或稀硫酸反应。
2.判断常见金属活泼性的方法
(1)金属与氧气反应的难易程度;
(2)金属与酸反应的剧烈程度。
3.置换反应:单质+化合物 → 单质+化合物
归纳总结
1.遇稀盐酸不产生气体的是( )
A.铁片 B.铜片 C.铝片 D.石灰片
2.收藏家收藏的清末铝制艺术品,至今保存完好,该艺术品未被锈蚀的主要原因是 ( )
A.铝不易被氧化 B.铝的氧化物容易发生还原反应
C.铝不易发生化学反应
D.铝表面的氧化铝具有保护作用
3.近年来,经过我国科学家的努力,制造出了国产芯片“龙芯一号”和“龙芯二号”。芯片的核心部件是以高纯度的单质硅为原材料制造的。用化学方法制得高纯度硅的反应原理是:SiCl4+2H2 ==Si+4HCl,该反应属于( )
A.化合反应 B.复分解反应 C.置换反应 D.分解反应
选择题
1、铝锅底部黏有水垢(主要成分为CaCO3),可用稀盐酸清除,但盐酸不宜过多的原因:
(1)________________________
(2)________________________
2.芋头梗、酸笋汤是大家喜欢的一道菜肴。聪明的妈妈常常用沙锅而不用铁锅、铝锅煮,你知道其中的原因吗?
答:芋头梗、酸笋汤中的酸类物质会与铁、铝发生反应,大大缩短铁锅和铝锅的使用寿命。
选做题
1.一般情况下,金属越活泼,与酸反应的速度越快。
为了探究金属Mg、Zn、Fe与酸反应的快慢,
某研究性学习小组设计了如下的实验。
【实验步骤】
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液,
②分别加入足量的、大小相等的Mg、Zn、Fe,立即
把三个相同的气球分别套在各试管口上。
【实验预测与分析】
(1)写出铁与盐酸反应的化学方程式_________。
(2)气球膨胀速度最快的是______(填试管编号)。
(3)该实验表明,实验室一般选用锌而不选用镁、铁
制取氢气的主要原因是 。
(4)步骤②是实验获得成功的关键,
你认为在操作过程中小组成员之间应该: 。
思考题:
2.相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。
m
t
a
b
c
0
Mg
Fe
Zn
t2
t1
t3
同课章节目录
