人教版高中化学选修4第三章第三节 盐类的水解 课件(共26张PPT)
文档属性
| 名称 | 人教版高中化学选修4第三章第三节 盐类的水解 课件(共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-18 07:40:15 | ||
图片预览








文档简介
(共26张PPT)
盐类水解的影响因素及其应用
第三节 盐类的水解
一、盐类水解的影响因素
1、内 因
盐的组成是影响盐类水解的主要因素。
Na2CO3和CH3COONa溶液
实验与探究:
组成盐的酸(或碱)的酸性(或碱性)越___时,盐类的水解程度越__。
弱
大
内因
越
弱
越
水
解
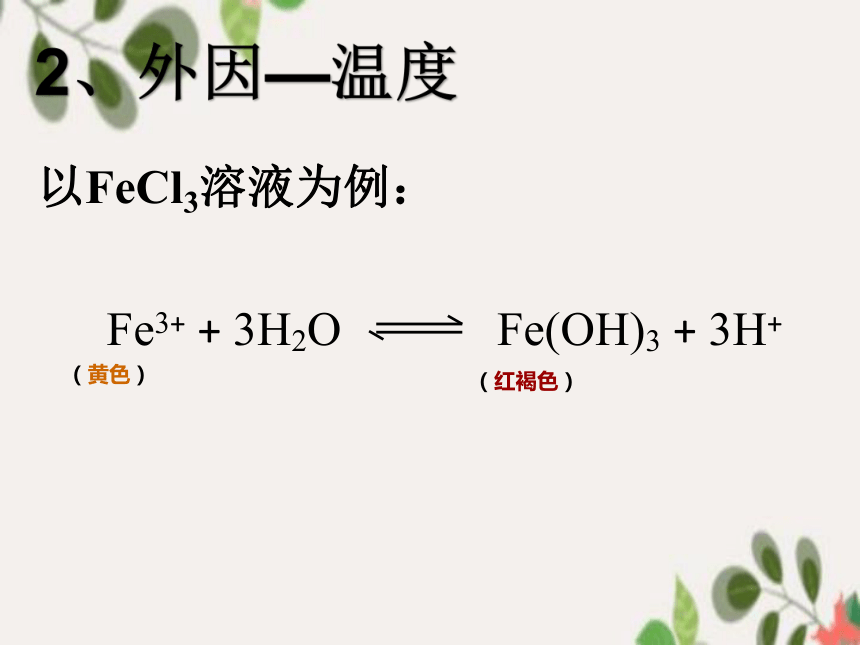
以FeCl3溶液为例:
Fe3+ + 3H2O Fe(OH)3 + 3H+
(黄色)
(红褐色)
盐的水解反应是 ,升高温度,盐的水解程度 ,反之则 。
吸热反应
增大
减小
温度
分别测量不同浓度醋酸钠溶液的pH:
2、外因—浓度
CH3COO-+ H2O CH3COOH + OH-
浓度
(mol/L) 0.6 0.3 0.15 0.075
pH
差值
盐浓度越大,水解程度越 ;
盐浓度越小,水解程度越 。
小
大
浓度
越
稀
越
水
解
CH3COONa的水解平衡:
填写下表中各项的变化情况:
CH3COO-+ H2O CH3COOH + OH-
加入试剂 平衡
移动 c(CH3COO-) c(CH3COOH)
c(H+) c(OH-) pH 水解
程度
固体醋酸钠
水
CH3COO-+ H2O CH3COOH + OH-
实验:
1、在0.1mol/L醋酸钠溶液中滴加两滴酚酞试液,再滴加两滴0.1mol/L氢氧化钠溶液,观察现象。
能否判断出平衡移动的方向?
2、外因—溶液的酸碱性
1、将pH传感器置于0.1mol/L醋酸钠溶液中,并用磁力搅拌器搅拌,滴加两滴0.1mol/L氢氧化钠溶液,观察溶液pH的变化。
用pH传感器测量溶液pH变化:
2、在0.1mol/L醋酸钠溶液中滴加少量酚酞试液,再滴加两滴0.1mol/L盐酸,观察现象。
CH3COO-+ H2O CH3COOH + OH-
实验:
能否判断出平衡移动的方向?
2、将pH传感器置于0.1mol/L醋酸钠溶液中,并用磁力搅拌器搅拌,滴加两滴0.1mol/L盐酸,观察溶液pH的变化。
用pH传感器测量溶液pH变化:
溶液的酸碱性
在盐溶液中加入酸或者碱,会促进或抑制盐类的水解。
向醋酸钠溶液中加入下列物质,填写各项的变化情况:
CH3COO-+ H2O CH3COOH + OH-
加入试剂 平衡
移动 c(CH3COO-) c(CH3COOH) c(H+) c(OH-) pH 水解
程度
NaOH溶液
盐酸
1、热碱水去油污
纯碱(Na2CO3)水解的离子方程式为:
已知:碱性越强,洗涤 油污效果更好!
Al2(SO4)3溶液
NaHCO3溶液
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
2、泡沫灭火器原理
药品:
二、盐类的水解在生活中的应用
常见能发生互相促进的水解反应的离子有:
Al3+与CO32-、HCO3-、S2-、AlO2-等;
Fe3+与CO32-、HCO3-、AlO2-等。
明矾与纯碱?
铝盐、铁盐等部分盐类水解生成胶体,能吸附水中悬浮的杂质,常用作净水剂。
如明矾(KAl(SO4)2·12H2O)水解的离子方程式为:
Al3++3H2O Al(OH)3+3H+
3.盐类做净水剂
二、盐类的水解在生活中的应用
总 结
盐类水解的影响因素
内 因
外 因:
温 度
浓 度
溶液的酸碱性
热碱水去油污
在生活中的应用
盐类做净水剂
泡沫灭火器原理
盐类水解的影响因素及其应用
第三节 盐类的水解
一、盐类水解的影响因素
1、内 因
盐的组成是影响盐类水解的主要因素。
Na2CO3和CH3COONa溶液
实验与探究:
组成盐的酸(或碱)的酸性(或碱性)越___时,盐类的水解程度越__。
弱
大
内因
越
弱
越
水
解
以FeCl3溶液为例:
Fe3+ + 3H2O Fe(OH)3 + 3H+
(黄色)
(红褐色)
盐的水解反应是 ,升高温度,盐的水解程度 ,反之则 。
吸热反应
增大
减小
温度
分别测量不同浓度醋酸钠溶液的pH:
2、外因—浓度
CH3COO-+ H2O CH3COOH + OH-
浓度
(mol/L) 0.6 0.3 0.15 0.075
pH
差值
盐浓度越大,水解程度越 ;
盐浓度越小,水解程度越 。
小
大
浓度
越
稀
越
水
解
CH3COONa的水解平衡:
填写下表中各项的变化情况:
CH3COO-+ H2O CH3COOH + OH-
加入试剂 平衡
移动 c(CH3COO-) c(CH3COOH)
c(H+) c(OH-) pH 水解
程度
固体醋酸钠
水
CH3COO-+ H2O CH3COOH + OH-
实验:
1、在0.1mol/L醋酸钠溶液中滴加两滴酚酞试液,再滴加两滴0.1mol/L氢氧化钠溶液,观察现象。
能否判断出平衡移动的方向?
2、外因—溶液的酸碱性
1、将pH传感器置于0.1mol/L醋酸钠溶液中,并用磁力搅拌器搅拌,滴加两滴0.1mol/L氢氧化钠溶液,观察溶液pH的变化。
用pH传感器测量溶液pH变化:
2、在0.1mol/L醋酸钠溶液中滴加少量酚酞试液,再滴加两滴0.1mol/L盐酸,观察现象。
CH3COO-+ H2O CH3COOH + OH-
实验:
能否判断出平衡移动的方向?
2、将pH传感器置于0.1mol/L醋酸钠溶液中,并用磁力搅拌器搅拌,滴加两滴0.1mol/L盐酸,观察溶液pH的变化。
用pH传感器测量溶液pH变化:
溶液的酸碱性
在盐溶液中加入酸或者碱,会促进或抑制盐类的水解。
向醋酸钠溶液中加入下列物质,填写各项的变化情况:
CH3COO-+ H2O CH3COOH + OH-
加入试剂 平衡
移动 c(CH3COO-) c(CH3COOH) c(H+) c(OH-) pH 水解
程度
NaOH溶液
盐酸
1、热碱水去油污
纯碱(Na2CO3)水解的离子方程式为:
已知:碱性越强,洗涤 油污效果更好!
Al2(SO4)3溶液
NaHCO3溶液
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
2、泡沫灭火器原理
药品:
二、盐类的水解在生活中的应用
常见能发生互相促进的水解反应的离子有:
Al3+与CO32-、HCO3-、S2-、AlO2-等;
Fe3+与CO32-、HCO3-、AlO2-等。
明矾与纯碱?
铝盐、铁盐等部分盐类水解生成胶体,能吸附水中悬浮的杂质,常用作净水剂。
如明矾(KAl(SO4)2·12H2O)水解的离子方程式为:
Al3++3H2O Al(OH)3+3H+
3.盐类做净水剂
二、盐类的水解在生活中的应用
总 结
盐类水解的影响因素
内 因
外 因:
温 度
浓 度
溶液的酸碱性
热碱水去油污
在生活中的应用
盐类做净水剂
泡沫灭火器原理
