人教版初中化学九年级下册第九单元《溶液》单元检测题(含答案)
文档属性
| 名称 | 人教版初中化学九年级下册第九单元《溶液》单元检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 189.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-17 22:56:47 | ||
图片预览


文档简介
《溶液》单元检测题
一、单选题
1.下列叙述正确的是
A.自然界的金属元素都是以化合物的形式存在的 B.凡是含氧元素的化合物都是氧化物
C.冰块和水混合得到冰的水溶液 D.同种元素组成的纯净物是单质
2.夏天打开碳酸饮料瓶盖,有大量二氧化碳气体逸出。关于打开瓶盖前后的变化,下列说法错误的是
A.二氧化碳的溶解度减小 B.剩余溶液仍为二氧化碳的饱和溶液
C.瓶内二氧化碳的溶质质量分数减小 D.二氧化碳从化合态变为游离态
3.t℃时,欲使一接近饱和的溶液变成饱和溶液,分别采取下列措施:①降低温度,②升高温度,③加水,④加入足量的溶质。一定能达到目的的是( )
A.只有④ B.只有① C.①③ D.②④
4.向某浓溶液中加入一定量的水,则所得溶液中保持不变的是?( )
A.溶质质量 B.溶剂质量 C.溶液质量 D.溶质的质量分数
5.下列过程中热量的变化与其他三个选项不同的是( )
A.氢氧化钠固体溶于水 B.硝酸铵固体溶于水
C.把水加入生石灰中 D.金属镁与稀盐酸反应
6.水是生命之源,下列有关水与溶液的说法错误的是( )
A.溶液具有均一性和稳定性,因为溶液中各种粒子保持静止不动
B.天然淡水生产自来水需要经过沉降、过滤、杀菌消毒等净化过程
C.水的净化操作中,蒸馏操作净化程度最高
D.用量简量取50 mL水配制溶液,若俯视读数,会导致配制的溶液溶质质量分数偏大
7.下列有关溶液的说法正确的是
A.饱和溶液就是不能再溶解任何物质的溶液
B.长期放置后不会分层的液体一定是溶液
C.20℃时,KNO3饱和溶液一定比不饱和溶液溶质质量分数大
D.降低饱和溶液的温度,一定有晶体析出
8.下列有关溶液的说法不正确的是( )
A.溶液一定是均一、稳定的混合物
B.饱和溶液可能是稀溶液
C.饱和溶液析出晶体后溶质质量分数一定会变小
D.溶液中的溶剂只能是一种
9.a、b、c三种物质在水中的溶解度曲线如图所示,下列有关叙述正确的是( )
A.20℃时,a物质在水中的溶解度是10
B.C物质是氢氧化钙的溶解度曲线
C.a的溶解度比b溶解度大
D.将50℃时l0%a的不饱和溶液降温到20℃,有晶体析出
10.夏日里想随时喝到凉爽的饮料,可以自制化学“冰箱”,即把一种化学试剂放人到一定量的水中,就可以形成低温小环境。这种试剂可以是下列物质中的( )
A.食盐 B.氢氧化钠 C.蔗糖 D.硝酸铵
11.把10 mL溶质质量分数为35%的浓盐酸稀释100倍,则稀释后的溶液中所含溶质的质量( )
A.减少99% B.增大100倍 C.增大1倍 D.不变
12.下列说法错误的是( )
A.均一、稳定的液体一定是溶液
B.硝酸钾的饱和溶液析出晶体,溶质质量分数可能不变
C.氯化钠的饱和溶液还可能再溶解其它物质
D.同一温度下,同一物质的饱和溶液一定比不饱和溶液的浓度大
13.在“一定溶质质量分数的氯化钠溶液配制”实验活动中,下列操作正确的是( )
A.取药 B.称量
C.量取 D.溶解
二、实验题
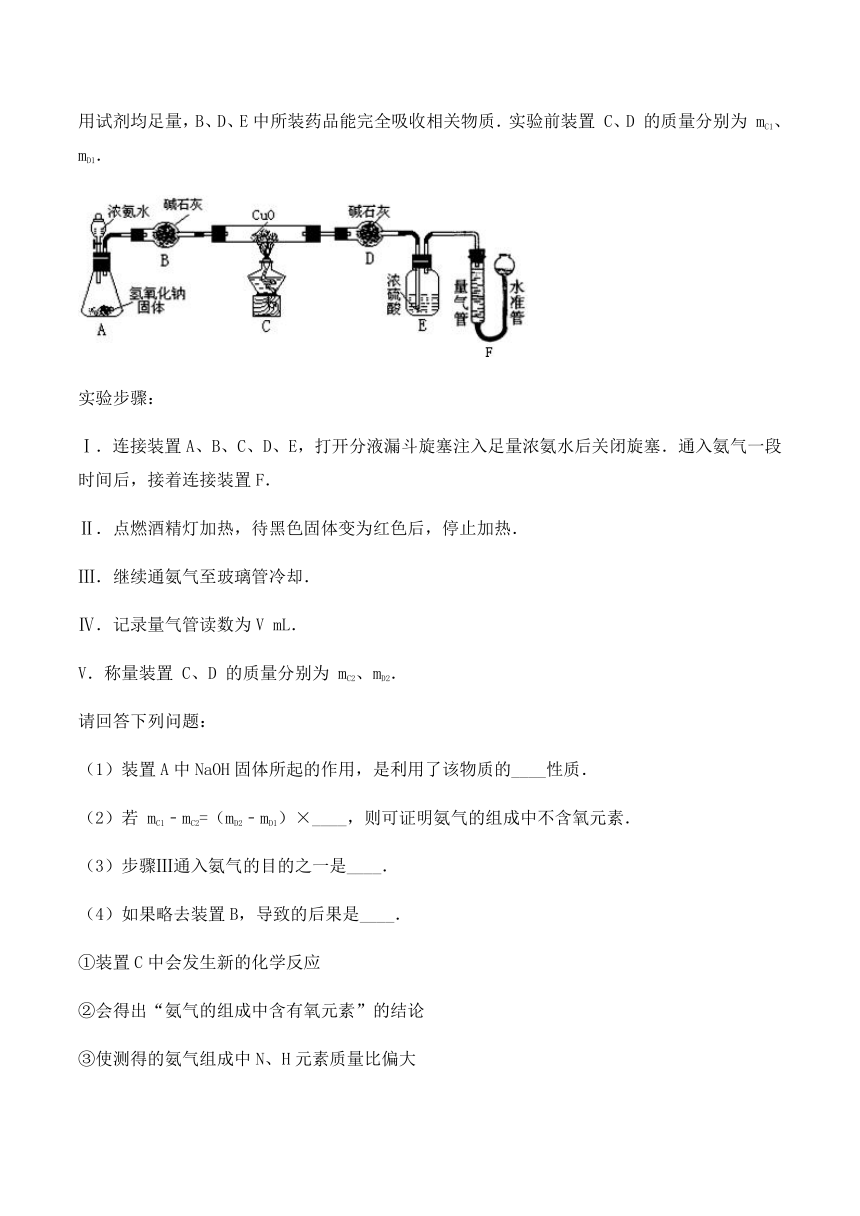
14.氨气易溶于水,易与浓硫酸反应,不与碱石灰(干燥剂)反应.氨气还具有还原性,在加热的条件下能还原氧化铜:2NH3+3CuON2+3Cu+3H2O,某化学兴趣小组同学设计下图所示实验来验证氨气的组成(图中夹持、固定装置部分均略去).已知整套装置气密性良好,且实验中所用试剂均足量,B、D、E中所装药品能完全吸收相关物质.实验前装置 C、D 的质量分别为 mC1、mD1.
实验步骤:
Ⅰ.连接装置A、B、C、D、E,打开分液漏斗旋塞注入足量浓氨水后关闭旋塞.通入氨气一段时间后,接着连接装置F.
Ⅱ.点燃酒精灯加热,待黑色固体变为红色后,停止加热.
Ⅲ.继续通氨气至玻璃管冷却.
Ⅳ.记录量气管读数为V mL.
V.称量装置 C、D 的质量分别为 mC2、mD2.
请回答下列问题:
(1)装置A中NaOH固体所起的作用,是利用了该物质的____性质.
(2)若 mC1﹣mC2=(mD2﹣mD1)×____,则可证明氨气的组成中不含氧元素.
(3)步骤Ⅲ通入氨气的目的之一是____.
(4)如果略去装置B,导致的后果是____.
①装置C中会发生新的化学反应
②会得出“氨气的组成中含有氧元素”的结论
③使测得的氨气组成中N、H元素质量比偏大
(5)为减小误差,在读取量气管读数前必须进行的操作是____.
(6)步骤Ⅱ中氧化铜是否完全反应,对实验结果____(填“有”、“没有”或“不确定有没有”)影响.
15.将一定量的硝酸钾和氯化钠(溶解度如下表)的混合物投入适量热水中充分溶解,对该溶液进行如图所示实验(假设实验过程各物质无损耗)。
温度/℃ 20 40 60 80 100
溶解度/g 31.6 64 110 169 246
35.8 35.4 37 38.4 39.8
(1)上述两种物质中,____________的溶解度受温度影响较大。
(2)甲烧杯中热水的温度(t)范围为____________
(3)若将乙烧杯____________(填“趁热”或“冷却”)过滤,可获得更多量晶体。
(4)丙烧杯中的溶液为________________________的饱和溶液.
(5)时,若仅析出氯化钠晶体,则蒸发去水的质量最多不超过____________g(结果保留整数位)。
三、推断题
16.A~H是初中化学中的常见物质,A、B、C含有相同的金属元素,B固体的溶解度随温度的升高而减小;C、D、E为氧化物; F、H为非金属单质,G、I为金属单质且I单质显红色。图中“﹣”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物或生成物已略去。
(1)写化学式:B_____、E_____。
(2)写出D﹣F反应的化学方程式_____,该反应过程_____热量(填“放出”或“吸收”)。
(3)写出G→I反应的化学方程式_____,该反应的基本类型是_____。
17.化学就在我们身边,认识和探究身边的化学物质、了解化学的奥秘,是学习化学的重要内容。
(1)A、B、C是三种常见的含钙化合物。它们之间有如图所示的转化关系(部分产物略去):请写出下列物质的化学式:A__________;B_________;C______。
(2)反应①的化学方程式:__________。
(3)我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 ______的功能。
四、科学探究题
18.请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制质量分数为的硝酸钾溶液,所需硝酸钾质量为______,所需蒸馏水的体积为______ (水的密度约为)。
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应______(填字母)。
A 先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡
B 先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡
(探究一)在称量过程中,某同学的称量操作如图
所示,你认为该操作对本次实验的数据处理的正确性______(填“有”或“没有”)影响,理由是________。
(3)量取:准确量取所需蒸馏水要用到的仪器是______(选填图中的标号)。
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解。
(探究二)时,将质量分数为的
硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液。从表中找出计算所需的数据为______。
硝酸钾溶液的密度(单位:)
20 40 60
4 1.023 1.106 1.007
10 1.063 1.054 1.044
五、计算题
19.为了测定某钢铁样品(主要成分是铁,少量的碳,其他杂质忽略不计)中碳的质量分数,现取一定质量的废钢粉末,向其中逐滴加入稀硫酸,至刚好不再产生气泡,用去稀硫酸100g,过滤、洗涤、干燥,得滤渣0.1g,生成氢气0.3g,求:
(1)所取样品中铁的质量。
(2)该样品中碳的质量分数(精确到0.1%)。
(3)稀硫酸的质量分数。
参考答案
1.D2.D3.A4.A5.B6.A7.C8.D9.D10.D11.D12.A 13.B
14.遇水溶解放热 排出装置内生成物,减小误差 ② 调节水准管,使量气管与水准管液面相平 没有
15.硝酸钾 冷却 硝酸钾、氯化钠 74
16.Ca(OH)2; H2O; CO2+C2CO; 吸收; Fe+CuSO4=Cu+FeSO4; 置换反应;
17.CaO Ca(OH)2 CaCO3 CaO+H2O=Ca(OH)2 乳化
18.5 45 A 没有 称量过程中没有使用游码 BC 1.063
19.(1)8.4g(2)1.2%(3)14.7%
同课章节目录
