人教版高中化学选修4第四章第一节 原电池 课件 (共25张PPT)
文档属性
| 名称 | 人教版高中化学选修4第四章第一节 原电池 课件 (共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-18 15:57:19 | ||
图片预览





文档简介
(共25张PPT)
第一节 原电池
请问:
Zn和稀硫酸反应是吸热反应还是放热反应?
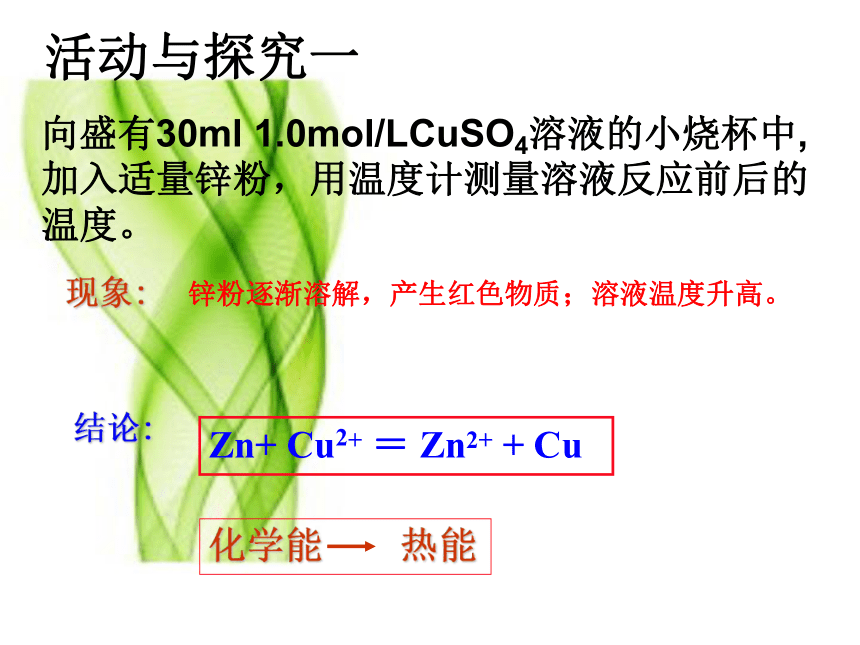
活动与探究一
向盛有30ml 1.0mol/LCuSO4溶液的小烧杯中,加入适量锌粉,用温度计测量溶液反应前后的温度。
现象:
结论:
Zn+ Cu2+ = Zn2+ + Cu
锌粉逐渐溶解,产生红色物质;溶液温度升高。
请问:
有没有方法将前面两个反应中的热能以电能的形式释放出来呢?
原电池:将化学能转化为电能的装置。
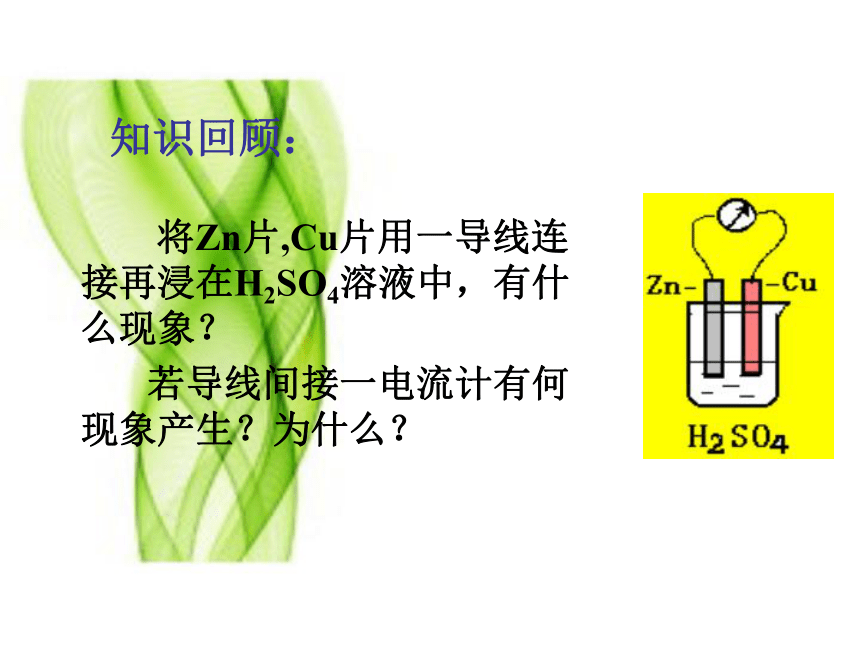
将Zn片,Cu片用一导线连接再浸在H2SO4溶液中,有什么现象?
若导线间接一电流计有何现象产生?为什么?
知识回顾:
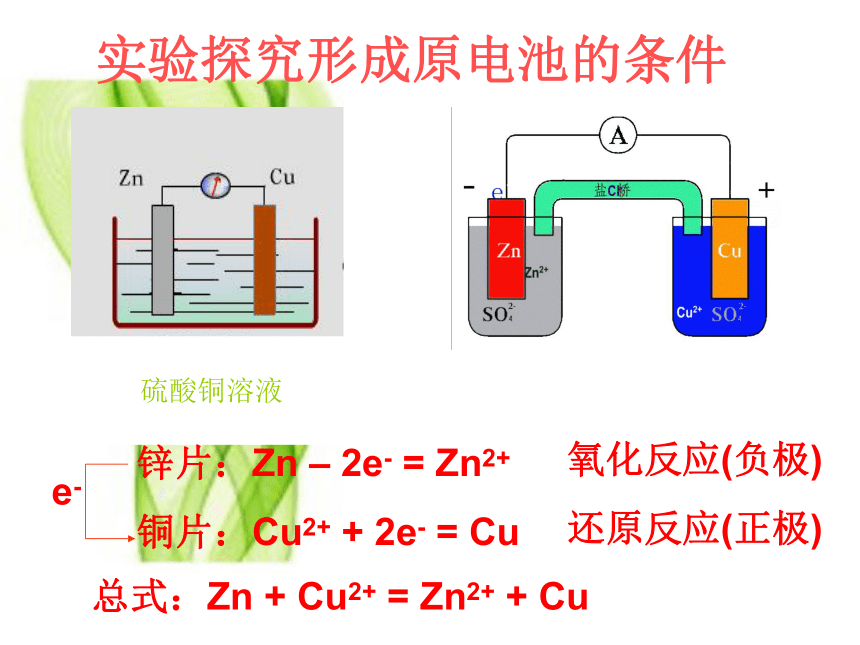
锌片(-):Zn – 2e- = Zn2+
铜片(+):2H+ + 2e- = H2↑
电池反应:Zn + 2H+ = Zn2+ + H2↑
探究
请你设计实验把Zn + Cu2+ = Zn2+ + Cu
这个反应释放的能量转化成电能,并通
过实验现象证明电能的产生。
实验探究形成原电池的条件
总式:Zn + Cu2+ = Zn2+ + Cu
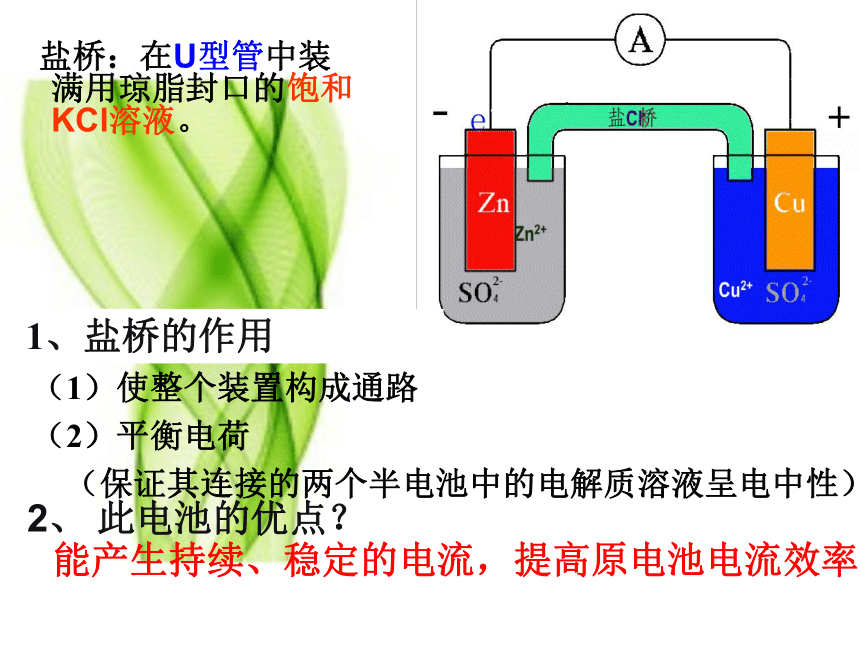
盐桥:在U型管中装 满用琼脂封口的饱和KCl溶液。
1、盐桥的作用
(1)使整个装置构成通路
(2)平衡电荷
(保证其连接的两个半电池中的电解质溶液呈电中性)
2、 此电池的优点?
能产生持续、稳定的电流,提高原电池电流效率。
实验探究形成原电池的条件
小结:
一、原电池形成的条件
1. 由两个半电池组成(用盐桥连接)
半电池: 电极材料(金属或石墨)和电解质溶液
2.两个半电池和外电路要形成闭合回路
3.有自发的氧化还原反应发生
A
B
C
D
E
F
下列哪些装置能构成原电池?
G
C
想一想
电解质溶液
失e-,沿导线传递,有电流产生
阳离子
负极
正极
阳离子
二、原电池工作原理:
发生氧化反应
发生还原反应
阴离子
正、负极的确定
阳离子
负极(–):
电 子
电 流
是不活泼金属或非金属,
正极(+):
是活泼金属,
本身失去电子,
发生氧化反应,
进电子 ,
本身不反应,
得电子发生还原反应,
是溶液中的阳离子
要用到金属活动性顺序表:
注意:
K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au…
活泼性,还原性依次减弱。
三、简单原电池正负极的判断方法:
质量减小。
质量增加 或 生成气体
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上 有大量气泡产生,则四种金属的活动性顺序由强到弱为 ( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
B
四、原电池电极反应式的书写:
1.先判断正负极:
2.负极: M-ne- = Mn+
3.正极:
(1)在酸溶液中: 2H+ + 2e- =H2↑(析氢腐蚀)
(2)在含不活泼金属阳离子的盐溶液中:
例如: Cu2+ + 2e- = Cu 或 Ag+ + e- =Ag
(3)在中性或碱性溶液中(NaCl、NaOH):
O2+ 2H2O + 4e- = 4OH– (吸氧腐蚀)
4.检查: 正负电极得失电子守恒
写一写
判断下列原电池正负极,写出电极反应式和电池反应式.
负极( ) ________________
正极( ) _______________
电池反应: _________________
活动与探究
根据离子反应Fe+Cu 2+ =Fe 2+ +Cu 设计一个原电池,并与同学讨论解决课本P14“活动与探究”中问题1和2。
根据离子反应
Cu+2Fe 3+ =2Fe 2+ +Cu 2+
设计一个原电池。
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。
原电池的设计:
方法点拨:
理论上能自发进行的氧化还原反应都可以设计成原电池。
1、将氧化还原反应拆成氧化反应和还原反应两个半反应,分别做原电池的负极和正极。
2、确定电极材料
如发生氧化反应的物质为金属单质,可用该金属直接做负极,如为气体或溶液中的还原性离子可用惰性电极做负极;发生还原反应的电极材料必须不如负极材料活泼。
3、确定电解质溶液
一般选用反应物中的电解质溶液
4、构成闭合回路
注意点:
1、原电池的工作原理是将氧化还原反应分在正(还原)、负(氧化)两极进行,负极上失去的电子沿导线流入正极,从而产生电流。
2、正负两极上进出电子总数相等,根据电子守恒原理可进行许多有关电极反应的计算。
3、原电池反应跟直接反应差别:反应速率加快。
4、利用原电池原理可制作各种化学电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池……。
课堂练习:
下图各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
A.②①③④ B.④③①②
C.④②①③ D.③②④①
C
高考回顾
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是 ( )
A.正极附近的SO42 -离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
D
高考回顾:
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
A
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
C
高考回顾:
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;
电解质溶液Y是___________;
(2)银电极为电池的________极,
发生的电极反应为_________________
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
铜(或Cu)
AgNO3溶液
正
Ag++e- → Ag
Cu -2e- → Cu2+
负(Cu)
正(Ag)
第一节 原电池
请问:
Zn和稀硫酸反应是吸热反应还是放热反应?
活动与探究一
向盛有30ml 1.0mol/LCuSO4溶液的小烧杯中,加入适量锌粉,用温度计测量溶液反应前后的温度。
现象:
结论:
Zn+ Cu2+ = Zn2+ + Cu
锌粉逐渐溶解,产生红色物质;溶液温度升高。
请问:
有没有方法将前面两个反应中的热能以电能的形式释放出来呢?
原电池:将化学能转化为电能的装置。
将Zn片,Cu片用一导线连接再浸在H2SO4溶液中,有什么现象?
若导线间接一电流计有何现象产生?为什么?
知识回顾:
锌片(-):Zn – 2e- = Zn2+
铜片(+):2H+ + 2e- = H2↑
电池反应:Zn + 2H+ = Zn2+ + H2↑
探究
请你设计实验把Zn + Cu2+ = Zn2+ + Cu
这个反应释放的能量转化成电能,并通
过实验现象证明电能的产生。
实验探究形成原电池的条件
总式:Zn + Cu2+ = Zn2+ + Cu
盐桥:在U型管中装 满用琼脂封口的饱和KCl溶液。
1、盐桥的作用
(1)使整个装置构成通路
(2)平衡电荷
(保证其连接的两个半电池中的电解质溶液呈电中性)
2、 此电池的优点?
能产生持续、稳定的电流,提高原电池电流效率。
实验探究形成原电池的条件
小结:
一、原电池形成的条件
1. 由两个半电池组成(用盐桥连接)
半电池: 电极材料(金属或石墨)和电解质溶液
2.两个半电池和外电路要形成闭合回路
3.有自发的氧化还原反应发生
A
B
C
D
E
F
下列哪些装置能构成原电池?
G
C
想一想
电解质溶液
失e-,沿导线传递,有电流产生
阳离子
负极
正极
阳离子
二、原电池工作原理:
发生氧化反应
发生还原反应
阴离子
正、负极的确定
阳离子
负极(–):
电 子
电 流
是不活泼金属或非金属,
正极(+):
是活泼金属,
本身失去电子,
发生氧化反应,
进电子 ,
本身不反应,
得电子发生还原反应,
是溶液中的阳离子
要用到金属活动性顺序表:
注意:
K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au…
活泼性,还原性依次减弱。
三、简单原电池正负极的判断方法:
质量减小。
质量增加 或 生成气体
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上 有大量气泡产生,则四种金属的活动性顺序由强到弱为 ( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
B
四、原电池电极反应式的书写:
1.先判断正负极:
2.负极: M-ne- = Mn+
3.正极:
(1)在酸溶液中: 2H+ + 2e- =H2↑(析氢腐蚀)
(2)在含不活泼金属阳离子的盐溶液中:
例如: Cu2+ + 2e- = Cu 或 Ag+ + e- =Ag
(3)在中性或碱性溶液中(NaCl、NaOH):
O2+ 2H2O + 4e- = 4OH– (吸氧腐蚀)
4.检查: 正负电极得失电子守恒
写一写
判断下列原电池正负极,写出电极反应式和电池反应式.
负极( ) ________________
正极( ) _______________
电池反应: _________________
活动与探究
根据离子反应Fe+Cu 2+ =Fe 2+ +Cu 设计一个原电池,并与同学讨论解决课本P14“活动与探究”中问题1和2。
根据离子反应
Cu+2Fe 3+ =2Fe 2+ +Cu 2+
设计一个原电池。
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。
原电池的设计:
方法点拨:
理论上能自发进行的氧化还原反应都可以设计成原电池。
1、将氧化还原反应拆成氧化反应和还原反应两个半反应,分别做原电池的负极和正极。
2、确定电极材料
如发生氧化反应的物质为金属单质,可用该金属直接做负极,如为气体或溶液中的还原性离子可用惰性电极做负极;发生还原反应的电极材料必须不如负极材料活泼。
3、确定电解质溶液
一般选用反应物中的电解质溶液
4、构成闭合回路
注意点:
1、原电池的工作原理是将氧化还原反应分在正(还原)、负(氧化)两极进行,负极上失去的电子沿导线流入正极,从而产生电流。
2、正负两极上进出电子总数相等,根据电子守恒原理可进行许多有关电极反应的计算。
3、原电池反应跟直接反应差别:反应速率加快。
4、利用原电池原理可制作各种化学电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池……。
课堂练习:
下图各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
A.②①③④ B.④③①②
C.④②①③ D.③②④①
C
高考回顾
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是 ( )
A.正极附近的SO42 -离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
D
高考回顾:
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
A
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
C
高考回顾:
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;
电解质溶液Y是___________;
(2)银电极为电池的________极,
发生的电极反应为_________________
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
铜(或Cu)
AgNO3溶液
正
Ag++e- → Ag
Cu -2e- → Cu2+
负(Cu)
正(Ag)
