人教版高中化学选修5 第三章第一节《醇酚》 课件(共21张PPT)
文档属性
| 名称 | 人教版高中化学选修5 第三章第一节《醇酚》 课件(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-18 15:58:12 | ||
图片预览




文档简介
(共21张PPT)
第一节 醇 酚
新课标人教版选修五《 有机化学基础》
第三章 烃的含氧衍生物
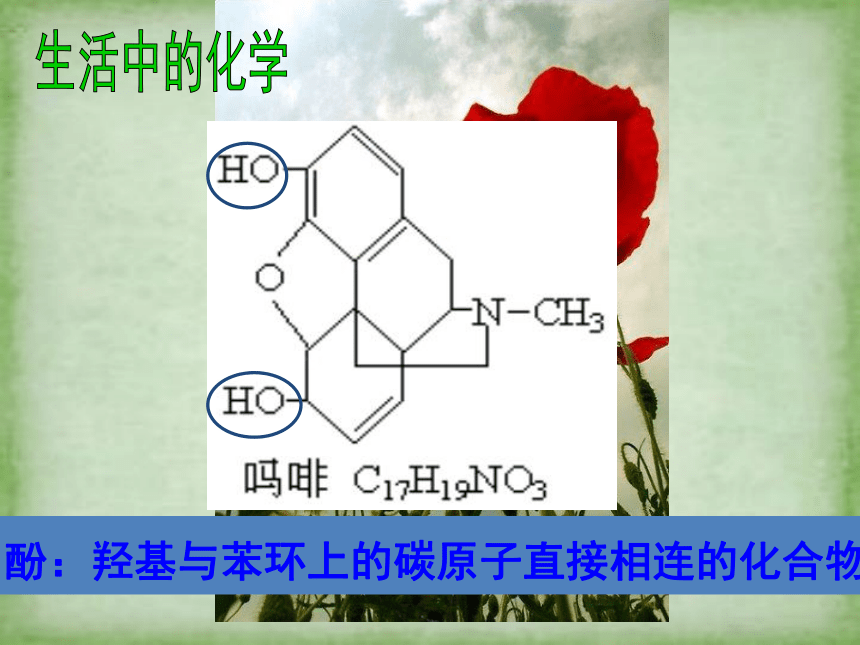
吗啡分子两个羟基均可说明吗啡属于醇类吗?
酚:羟基与苯环上的碳原子直接相连的化合物
1、苯酚:结构
分子组成和结构
分子式:C6H6O
结构简式:C6H5OH或
苯酚的性质=苯的性质+醇的性质?
2、苯酚:物理性质
无色晶体;具有特殊气味;常温下可溶于水,易溶于乙醇等有机溶剂。650C以上时,能与水混溶 ;有毒。
带粉红色
放置时间长的苯酚往往是粉红色,因为空气中的氧气就能使苯酚慢慢地氧化成对-苯醌。
小资料:酚易被氧化
推测:苯酚能否与酸性高锰酸钾溶液反应?
探究1:苯酚的酸性如何?
小资料:苯酚、碳酸的电离平衡常数
理论猜想(酸性): 碳酸〉苯酚〉碳酸氢根
弱酸 电离平衡常数(25℃)
苯酚 1.02×10-10
碳酸(第一步电离) 4.4×10-7
碳酸氢根 4.7×10-11
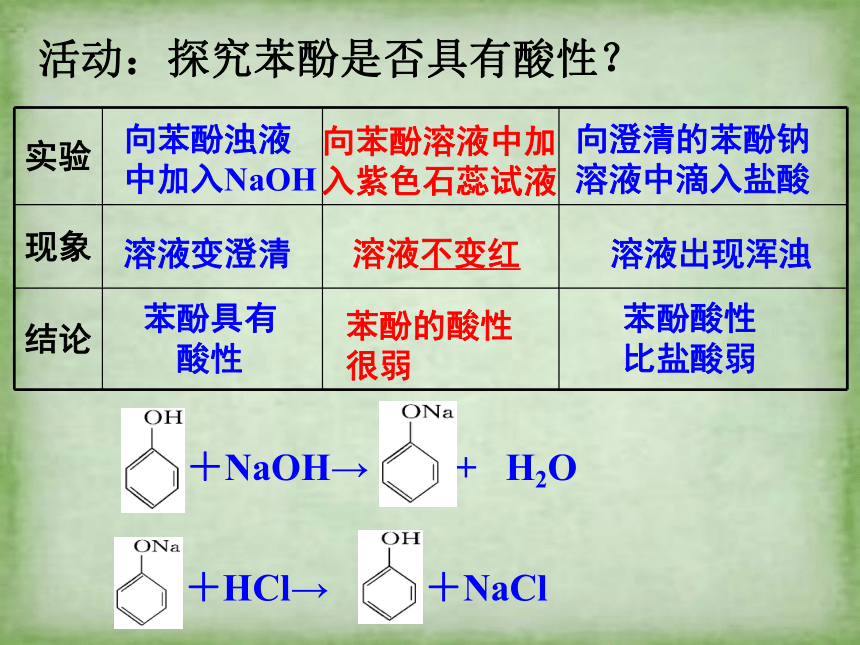
活动:探究苯酚是否具有酸性?
溶液变澄清
溶液出现浑浊
苯酚酸性比盐酸弱
苯酚具有酸性
溶液不变红
苯酚的酸性很弱
向苯酚浊液
中加入NaOH
向苯酚溶液中加
入紫色石蕊试液
向澄清的苯酚钠
溶液中滴入盐酸
实验
现象
结论
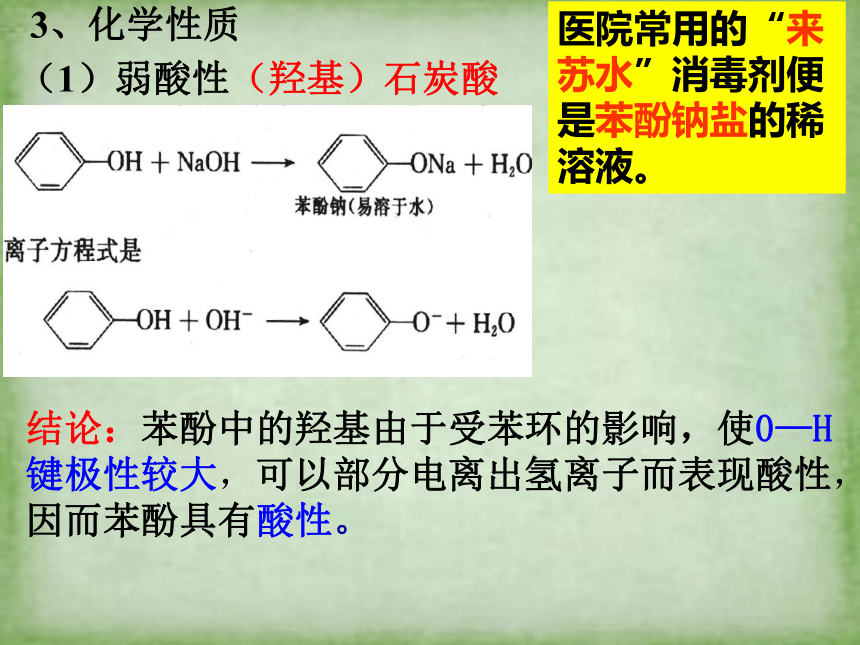
3、化学性质
(1)弱酸性(羟基)石炭酸
医院常用的“来苏水”消毒剂便是苯酚钠盐的稀溶液。
结论:苯酚中的羟基由于受苯环的影响,使0—H键极性较大,可以部分电离出氢离子而表现酸性,因而苯酚具有酸性。
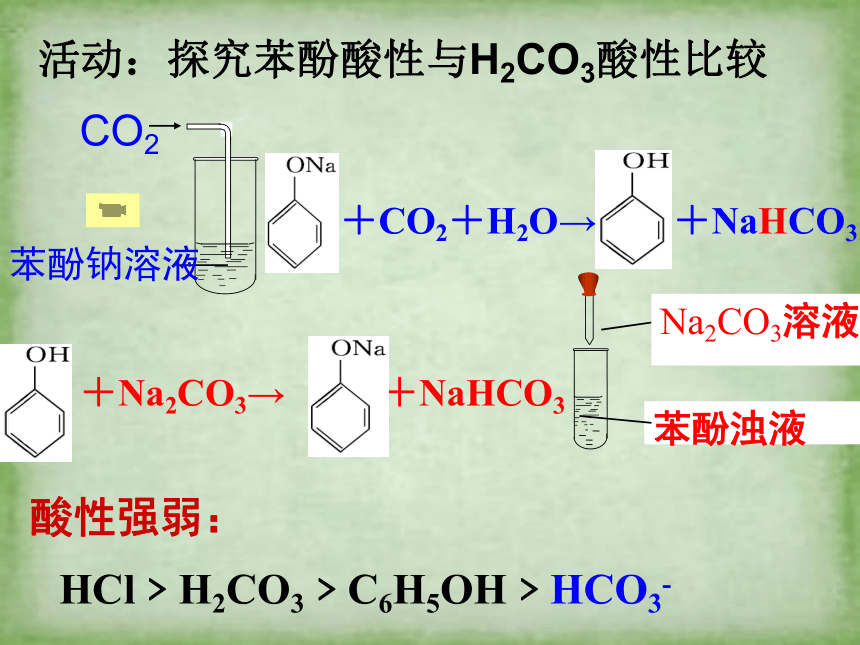
活动:探究苯酚酸性与H2CO3酸性比较
酸性强弱:
HCl﹥H2CO3﹥C6H5OH﹥HCO3-
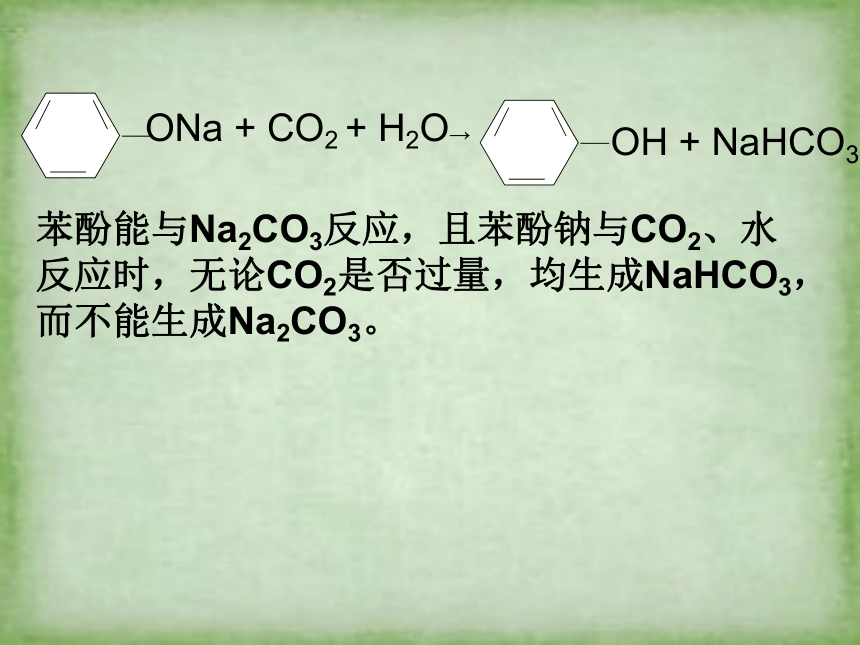
ONa + CO2 + H2O→
OH + NaHCO3
苯酚能与Na2CO3反应,且苯酚钠与CO2、水反应时,无论CO2是否过量,均生成NaHCO3,而不能生成Na2CO3。
在苯酚分子中,苯环对羟基的
影响,导致苯酚有弱酸性,
那羟基是否会对苯环产生影响?
【想一想???】
课本P54,实验3-4
向盛有少量苯酚稀溶液的试管里逐滴加入饱和溴水,边加边振荡,观察并记录实验现象。
(2)与溴的取代反应(与苯相似)
对比苯和溴的反应情况:反应物状态,反应条件、产物的结构?
可用于苯酚定性检验与定量测定!
溴水与苯酚溶液
液溴与纯苯
不用催化剂
FeBr3作催化剂
取代苯环上三个H
取代苯环上一个H
瞬时完成
初始缓慢,后加快
苯酚与溴取代反应比苯容易
酚羟基对苯环影响,
使苯环上氢原子变得活泼
苯酚与苯溴代反应的比较
苯酚 苯
反应物
反应条件
取代苯环上H数
反应速率
结论
原因
思考:能够跟1mol该化合物起反应的Br2反应的最大用量是多少?
思考:能够跟1mol该化合物起反应的Br2反应的最大用量是多少?
Br2 6mol
(3)苯酚的特征反应(显色反应)
实验现象:溶液显紫色。
原理:苯酚遇FeCl3溶液显紫色。
应用:定性检验苯酚或Fe3+的存在。
演示实验:苯酚溶液+FeCl3溶液
实验步骤:取一试管,装入少量苯酚水溶液,倒去试管中的溶液,然后再向试管中滴加几滴FeCl3溶液。观察现象
苯酚的用途
酚醛树脂
合成纤维
合成香料
医药
消毒剂
染料
农药
防腐剂
本课小结
一、苯酚的物理性质:溶解性、颜色、状态
二、结构特点:羟基、苯环、基团间相互影响
三、化学性质:
1、还原性:空气中变粉红色
2、弱酸性:石炭酸(熟记化学方程式)
3、取代反应:与卤素水溶液
4、显色反应:与FeCl3溶液
5. 加成反应:与H2反应
随堂练习
1、下列物质不属于酚的是( )
A、
CH2OH
B、
OH
OH
HO
C、
OH
D、
OH
CH3
2、能鉴别C2H5OH、C6H5OH、AgNO3、Na2CO3、KI五种物质的一种试剂是( )
A、稀盐酸 B、浓溴水
C、高锰酸钾酸性溶液
D、FeCl3溶液
3(双选)、下列物质中,既能使溴水褪色,又能产生沉淀的是( )
A、丁烯 B、乙醇
C、苯酚 D、硫化氢
4、某些芳香族化合物的分子式为C7H8O,其中与FeCl3溶液混合后发生显色反应和不发生显色反应的种类分别为( )
A2种和1种 B、2种和3种
C、3种和2种 D、3种和1种
第一节 醇 酚
新课标人教版选修五《 有机化学基础》
第三章 烃的含氧衍生物
吗啡分子两个羟基均可说明吗啡属于醇类吗?
酚:羟基与苯环上的碳原子直接相连的化合物
1、苯酚:结构
分子组成和结构
分子式:C6H6O
结构简式:C6H5OH或
苯酚的性质=苯的性质+醇的性质?
2、苯酚:物理性质
无色晶体;具有特殊气味;常温下可溶于水,易溶于乙醇等有机溶剂。650C以上时,能与水混溶 ;有毒。
带粉红色
放置时间长的苯酚往往是粉红色,因为空气中的氧气就能使苯酚慢慢地氧化成对-苯醌。
小资料:酚易被氧化
推测:苯酚能否与酸性高锰酸钾溶液反应?
探究1:苯酚的酸性如何?
小资料:苯酚、碳酸的电离平衡常数
理论猜想(酸性): 碳酸〉苯酚〉碳酸氢根
弱酸 电离平衡常数(25℃)
苯酚 1.02×10-10
碳酸(第一步电离) 4.4×10-7
碳酸氢根 4.7×10-11
活动:探究苯酚是否具有酸性?
溶液变澄清
溶液出现浑浊
苯酚酸性比盐酸弱
苯酚具有酸性
溶液不变红
苯酚的酸性很弱
向苯酚浊液
中加入NaOH
向苯酚溶液中加
入紫色石蕊试液
向澄清的苯酚钠
溶液中滴入盐酸
实验
现象
结论
3、化学性质
(1)弱酸性(羟基)石炭酸
医院常用的“来苏水”消毒剂便是苯酚钠盐的稀溶液。
结论:苯酚中的羟基由于受苯环的影响,使0—H键极性较大,可以部分电离出氢离子而表现酸性,因而苯酚具有酸性。
活动:探究苯酚酸性与H2CO3酸性比较
酸性强弱:
HCl﹥H2CO3﹥C6H5OH﹥HCO3-
ONa + CO2 + H2O→
OH + NaHCO3
苯酚能与Na2CO3反应,且苯酚钠与CO2、水反应时,无论CO2是否过量,均生成NaHCO3,而不能生成Na2CO3。
在苯酚分子中,苯环对羟基的
影响,导致苯酚有弱酸性,
那羟基是否会对苯环产生影响?
【想一想???】
课本P54,实验3-4
向盛有少量苯酚稀溶液的试管里逐滴加入饱和溴水,边加边振荡,观察并记录实验现象。
(2)与溴的取代反应(与苯相似)
对比苯和溴的反应情况:反应物状态,反应条件、产物的结构?
可用于苯酚定性检验与定量测定!
溴水与苯酚溶液
液溴与纯苯
不用催化剂
FeBr3作催化剂
取代苯环上三个H
取代苯环上一个H
瞬时完成
初始缓慢,后加快
苯酚与溴取代反应比苯容易
酚羟基对苯环影响,
使苯环上氢原子变得活泼
苯酚与苯溴代反应的比较
苯酚 苯
反应物
反应条件
取代苯环上H数
反应速率
结论
原因
思考:能够跟1mol该化合物起反应的Br2反应的最大用量是多少?
思考:能够跟1mol该化合物起反应的Br2反应的最大用量是多少?
Br2 6mol
(3)苯酚的特征反应(显色反应)
实验现象:溶液显紫色。
原理:苯酚遇FeCl3溶液显紫色。
应用:定性检验苯酚或Fe3+的存在。
演示实验:苯酚溶液+FeCl3溶液
实验步骤:取一试管,装入少量苯酚水溶液,倒去试管中的溶液,然后再向试管中滴加几滴FeCl3溶液。观察现象
苯酚的用途
酚醛树脂
合成纤维
合成香料
医药
消毒剂
染料
农药
防腐剂
本课小结
一、苯酚的物理性质:溶解性、颜色、状态
二、结构特点:羟基、苯环、基团间相互影响
三、化学性质:
1、还原性:空气中变粉红色
2、弱酸性:石炭酸(熟记化学方程式)
3、取代反应:与卤素水溶液
4、显色反应:与FeCl3溶液
5. 加成反应:与H2反应
随堂练习
1、下列物质不属于酚的是( )
A、
CH2OH
B、
OH
OH
HO
C、
OH
D、
OH
CH3
2、能鉴别C2H5OH、C6H5OH、AgNO3、Na2CO3、KI五种物质的一种试剂是( )
A、稀盐酸 B、浓溴水
C、高锰酸钾酸性溶液
D、FeCl3溶液
3(双选)、下列物质中,既能使溴水褪色,又能产生沉淀的是( )
A、丁烯 B、乙醇
C、苯酚 D、硫化氢
4、某些芳香族化合物的分子式为C7H8O,其中与FeCl3溶液混合后发生显色反应和不发生显色反应的种类分别为( )
A2种和1种 B、2种和3种
C、3种和2种 D、3种和1种
