人教版高中化学必修二教学资料,复习补习资料(巩固练习):32【提高】金属矿物的开发利用
文档属性
| 名称 | 人教版高中化学必修二教学资料,复习补习资料(巩固练习):32【提高】金属矿物的开发利用 |

|
|
| 格式 | zip | ||
| 文件大小 | 93.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-18 00:00:00 | ||
图片预览


文档简介
金属矿物的开发利用
【学习目标】
了解金属冶炼的化学反应原理和基本方法; 2、了解金属回收与资源的保护方法。
【巩固练习】
一、选择题(每题有1-2个选项符合题意)
1.人造光卤石(KCl·MgCl2·6H2O)是盐化工生产的中间产物。以光卤石为原料制得金属镁,可有下列步骤: ①过滤 ②溶解 ③加入适量Ca(OH)2 ④蒸发 ⑤用盐酸溶解 ⑥电解熔融MgCl2 ⑦在HCl气流中强热MgCl2·6H2O晶体正确的顺序是( )。 A.⑤③①②④⑥⑦ B.②③①⑤④⑦⑥ C.②④①③⑦⑤⑥ D.⑤③①④②⑦⑥
2.(2019 河南省安阳市高考模拟)下列制备金属单质的方法或原理正确的是( )。
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
3.我国古代湿法炼铜的反应原理是( )。 A.CuO+H2Cu+H2O B.CuO+COCu+CO2 C.CuSO4+Fe=Cu+ FeSO4 D.2CuO+C2Cu+ CO2↑
4.(2019 吉林市期末考)下列反应原理中,不符合工业冶炼金属实际情况的是( )。
A.2HgO2Hg+O2↑
B.4Al+3MnO22Al2O3+3Mn
C.2MgO2Mg+O2↑
D.4CO+Fe3O43Fe+4CO2
5.(2019 北京市东城区期末考)用铝热法还原下列氧化物,分别制得金属各1 mol时,理论上消耗铝最少的是( )。 A.WO3 B.MnO2 C.FeO D.Cr2O3
6.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O6Cu+SO2↑,关于该反应的说法正确的是( )。
A.Cu2S在反应中既是氧化剂,又是还原剂 B.该反应的氧化剂只有Cu2O C.Cu既是氧化产物又是还原产物 D.每生成19.2gCu,反应中转移0.6mol电子
7.金属汞在自然界的主要矿物为辰砂(又名朱砂),其主要成分是HgS。将该矿物在空气中焙烧,把汞蒸气蒸馏出来而得到汞,反应方程式为:HgS + O2?= Hg + SO2,下列对于该反应的说法一定正确的是( )。 A.HgS只是还原剂 B.SO2只是还原产物 C.O2是氧化剂 D.Hg是氧化产物
8.(2019 云南省旧三中期末考)铝能用于冶炼金属(如:铁、钒、铬、锰等),这是因为铝( )。
A.具有较强的还原性 B.既能与酸反应,又能与碱反应 C.熔点低 D.导电性好
9.下列各组金属中,前者可以用热分解法制得,后者可以用氢气还原制得的是( )。 A.Hg;Fe B.Fe; Al C.Ag;K D.Cu;Na
10.H2作还原剂和金属作还原剂相比,有关所得金属纯度的说法正确的是( )。
A.用H2的高 B.用金属的高 C.二者相同 D.无法比较
11.下列矿石中可用作炼铁原料的有( )。
①赤铁矿;②黄铁矿;③磁铁矿;④闪锌矿;⑤菱铁矿
A.只有①和② B.只有①和③
C.有①③⑤ D.①②③⑤
12.化学学科的发展对人类文明进步起到了极为重要的作用。下列认识正确的是 ( )。 A.人类对金、银、铜、铁、铝的认识与其在自然界分布无关 B.人类解决吃、穿、住、行最有效的方法就是大力开发石油及其产品 C.工业上可用电解熔融态的MgCl2、AlCl3来制备Mg、Al D.工业上可用空气、Cu、稀硫酸来制备CuSO4
二、非选择题
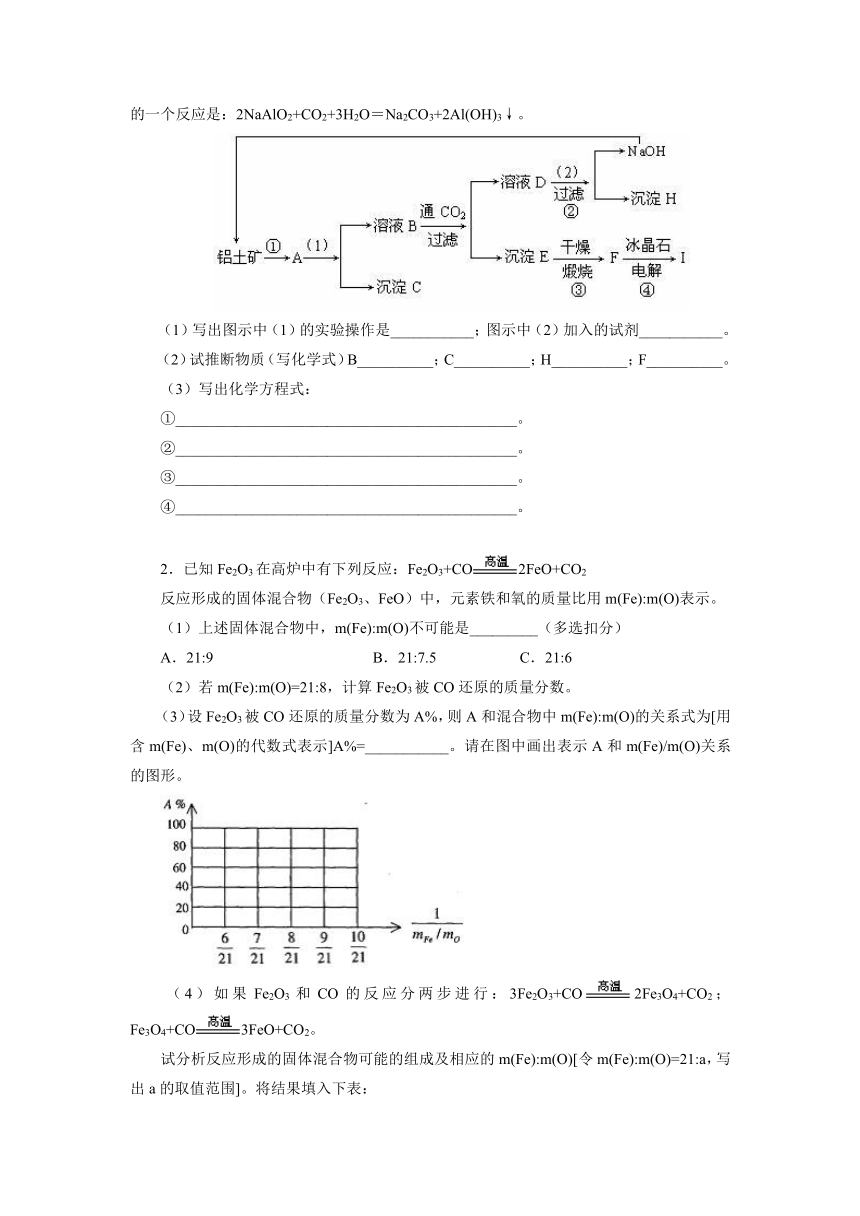
1.工业制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的是Al2O3,然后电解是Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中牵涉到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。 (1)写出图示中(1)的实验操作是___________;图示中(2)加入的试剂___________。 (2)试推断物质(写化学式)B__________;C__________;H__________;F__________。 (3)写出化学方程式: ①_____________________________________________。 ②_____________________________________________。 ③_____________________________________________。 ④_____________________________________________。
2.已知Fe2O3在高炉中有下列反应:Fe2O3+CO2FeO+CO2 反应形成的固体混合物(Fe2O3、FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。 (1)上述固体混合物中,m(Fe):m(O)不可能是_________(多选扣分) A.21:9 B.21:7.5 C.21:6 (2)若m(Fe):m(O)=21:8,计算Fe2O3被CO还原的质量分数。 (3)设Fe2O3被CO还原的质量分数为A%,则A和混合物中m(Fe):m(O)的关系式为[用含m(Fe)、m(O)的代数式表示]A%=___________。请在图中画出表示A和m(Fe)/m(O)关系的图形。
(4)如果Fe2O3和CO的反应分两步进行:3Fe2O3+CO2Fe3O4+CO2;Fe3O4+CO3FeO+CO2。 试分析反应形成的固体混合物可能的组成及相应的m(Fe):m(O)[令m(Fe):m(O)=21:a,写出a的取值范围]。将结果填入下表:
3.工业上用铝土矿(主要成分是Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料。提取时操作过程表示如下: (1)写出②③两处所用试剂的名称②____________③____________。? (2)写出在滤液B中加入物质③的离子方程式:__________。? (3)Al2O3熔点(2045 ℃)很高,工业上用冰晶石作助熔剂,电解熔融的Al2O3,其化学方程式是____________。某冶炼铝厂以碳为电极电解时,由于温度高,阳极生成的氧气与碳发生反应。当生成54 kg铝时,阳极消耗24 kg碳,则阳极生成的CO和CO2混合气体中,CO与CO2两种气体的分子个数比为____________。
【答案与解析】
一、选择题
1.B
【解析】提纯光卤石得到MgCl2的步骤为:先将光卤石溶解于水,因为KCl、MgCl2均易溶于水,先后沉淀Mg2+;Mg(OH)2的溶解度比Ca(OH)2更小,故加入适量的Ca(OH)2过滤后得Mg(OH)2,洗涤后溶于适量的盐酸发生反应:Mg(OH)2+2HCl==MgCl2+2H2O,蒸发溶液得MgCl2·6H2O,由于加热MgCl2·6H2O的过程中,会有部分MgCl2又与H2O反应生成Mg(OH)2。而MgCl2与H2O的反应是一个可逆反应:MgCl2+2H2O==Mg(OH)2+2HCl。根据平衡移动原理在HCl气氛中加热MgCl2·6H2O,使MgCl2与H2O的反应得到抑制,故能得到纯净的MgCl2。
2.D
【解析】金属的活泼性不同,冶炼方法不同,K、Ca、Na、Mg、Al等金属可用电解熔融的化合物的方法冶炼,Zn、Fe、Sn、Pb、Cu可用热还原发生冶炼;Hg、Ag可用分解法冶炼。
A.制备单质Mg应该用电解熔融MgCl2的方法,故A错误;
B.Al为活泼金属,应用电解熔融Al2O3制备,故B正确;
C.制备单质Na采用电解熔融NaCl的方法,电解溶液生成氢氧化钠、氢气和氯气,故C错误;
D.制备单质Cu用热还原法制备,故D错误。
3.C
4.C
【解析】A.Hg为不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,故A正确;
B.因Mn、W等高熔点金属可利用铝热反应产生的高温来冶炼,故B正确;
C.Mg为活泼金属,较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼,在加热条件下难以分解,故C错误;
D.Fe处于金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,故D正确。
5.C
【解析】根据化合价的变化判断,化合价变化的数值越小,说明发生氧化还原反应时得到的电子数目越少,则消耗铝的量最少。故选C。
6.A
【解析】根据反应前后元素化合价的变化可知Cu2S在反应中既作氧化剂又作还原剂,且Cu2O也是氧化剂,Cu是该反应的还原产物;从反应中可以看出每生成6molCu转移6mol电子,即生成19.2gCu时转移0.3mol电子。
7.C
【解析】根据化合价分析,HgS就是还原剂,又是氧化剂,A错误;SO2是氧化产物,B错误;Hg是还原产物,D错误。只有C对。
8.A
【解析】铝热反应常用于焊接铁轨,该反应中Al作还原剂,且反应为放热反应,用于提炼难熔金属,而与导电性、熔点及两性无关。
9.A
10.A
【解析】用金属作还原剂冶炼金属,金属的用量难以控制,会残留杂质;用氢气作还原剂冶炼金属,氢气可以过量,所得到的金属纯度更高。
11.D
【解析】炼铁的原料是铁矿石,所以,必须明确各种矿石的成分,题给矿石的主要成分依次为:①Fe2O3;②FeS2;③Fe3O4;④ZnS;⑤FeCO3,而FeCO3加热发生分解:FeCO3 FeO+CO2↑。故可用作炼铁原料的有①、②、③、⑤,选D。
12.D
【解析】选项A,Au是极不活泼金属,在自然界中有单质存在,古人不需冶炼即可获得,随着化学科学的进步,人类逐渐冶炼出Cu、Fe、Al等金属,可见人类认识和获取金属与金属活动性顺序密切相关。选项B,石油是不可再生资源,总有一天,石油会消耗殆尽,它不是解决人类吃、穿、住、行最有效的方法。选项C,AlCl3是共价化合物,电解熔融AlCl3得不到Al。选项D,将Cu在空气中充分燃烧后转化为CuO,CuO与稀H2SO4反应即可得到CuSO4。
二、非选择题
1.(1)过滤;Ca(OH)2; (2)NaAlO2;Fe2O3;CaCO3;Al2O3; (3)①Al2O3+2NaOH=2NaAlO2+H2O ②Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ③2Al(OH)3Al2O3+3H2O
2.(1)AC
(2)33.3%
(3)
(4)
【解析】 (1)用极限法计算Fe2O3和FeO中m(Fe):m(O),分别为21:9和 21:6,因反应形成固体混和物,故21:6﹤m(Fe):m(O)﹤21:9,选AC。 (2)解法一:取Fe2O3?m(Fe):m(O)=21:9;FeO m(Fe):m(O)=21:6 解法二:设Fe2O3原有n0?mol,还原百分率为A%,则有 (3)由化简可得,选m(Fe):m(O)从21:6到21:9之间的几个点作出下图:? (4)Fe2O3 ?Fe3O4? 8<a<9;
Fe3O4 ?FeO 6<a<8;
Fe2O3? Fe3O4? FeO 6<a<9
3.(1)氢氧化钠 二氧化碳 (2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【学习目标】
了解金属冶炼的化学反应原理和基本方法; 2、了解金属回收与资源的保护方法。
【巩固练习】
一、选择题(每题有1-2个选项符合题意)
1.人造光卤石(KCl·MgCl2·6H2O)是盐化工生产的中间产物。以光卤石为原料制得金属镁,可有下列步骤: ①过滤 ②溶解 ③加入适量Ca(OH)2 ④蒸发 ⑤用盐酸溶解 ⑥电解熔融MgCl2 ⑦在HCl气流中强热MgCl2·6H2O晶体正确的顺序是( )。 A.⑤③①②④⑥⑦ B.②③①⑤④⑦⑥ C.②④①③⑦⑤⑥ D.⑤③①④②⑦⑥
2.(2019 河南省安阳市高考模拟)下列制备金属单质的方法或原理正确的是( )。
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
3.我国古代湿法炼铜的反应原理是( )。 A.CuO+H2Cu+H2O B.CuO+COCu+CO2 C.CuSO4+Fe=Cu+ FeSO4 D.2CuO+C2Cu+ CO2↑
4.(2019 吉林市期末考)下列反应原理中,不符合工业冶炼金属实际情况的是( )。
A.2HgO2Hg+O2↑
B.4Al+3MnO22Al2O3+3Mn
C.2MgO2Mg+O2↑
D.4CO+Fe3O43Fe+4CO2
5.(2019 北京市东城区期末考)用铝热法还原下列氧化物,分别制得金属各1 mol时,理论上消耗铝最少的是( )。 A.WO3 B.MnO2 C.FeO D.Cr2O3
6.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O6Cu+SO2↑,关于该反应的说法正确的是( )。
A.Cu2S在反应中既是氧化剂,又是还原剂 B.该反应的氧化剂只有Cu2O C.Cu既是氧化产物又是还原产物 D.每生成19.2gCu,反应中转移0.6mol电子
7.金属汞在自然界的主要矿物为辰砂(又名朱砂),其主要成分是HgS。将该矿物在空气中焙烧,把汞蒸气蒸馏出来而得到汞,反应方程式为:HgS + O2?= Hg + SO2,下列对于该反应的说法一定正确的是( )。 A.HgS只是还原剂 B.SO2只是还原产物 C.O2是氧化剂 D.Hg是氧化产物
8.(2019 云南省旧三中期末考)铝能用于冶炼金属(如:铁、钒、铬、锰等),这是因为铝( )。
A.具有较强的还原性 B.既能与酸反应,又能与碱反应 C.熔点低 D.导电性好
9.下列各组金属中,前者可以用热分解法制得,后者可以用氢气还原制得的是( )。 A.Hg;Fe B.Fe; Al C.Ag;K D.Cu;Na
10.H2作还原剂和金属作还原剂相比,有关所得金属纯度的说法正确的是( )。
A.用H2的高 B.用金属的高 C.二者相同 D.无法比较
11.下列矿石中可用作炼铁原料的有( )。
①赤铁矿;②黄铁矿;③磁铁矿;④闪锌矿;⑤菱铁矿
A.只有①和② B.只有①和③
C.有①③⑤ D.①②③⑤
12.化学学科的发展对人类文明进步起到了极为重要的作用。下列认识正确的是 ( )。 A.人类对金、银、铜、铁、铝的认识与其在自然界分布无关 B.人类解决吃、穿、住、行最有效的方法就是大力开发石油及其产品 C.工业上可用电解熔融态的MgCl2、AlCl3来制备Mg、Al D.工业上可用空气、Cu、稀硫酸来制备CuSO4
二、非选择题
1.工业制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的是Al2O3,然后电解是Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中牵涉到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。 (1)写出图示中(1)的实验操作是___________;图示中(2)加入的试剂___________。 (2)试推断物质(写化学式)B__________;C__________;H__________;F__________。 (3)写出化学方程式: ①_____________________________________________。 ②_____________________________________________。 ③_____________________________________________。 ④_____________________________________________。
2.已知Fe2O3在高炉中有下列反应:Fe2O3+CO2FeO+CO2 反应形成的固体混合物(Fe2O3、FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。 (1)上述固体混合物中,m(Fe):m(O)不可能是_________(多选扣分) A.21:9 B.21:7.5 C.21:6 (2)若m(Fe):m(O)=21:8,计算Fe2O3被CO还原的质量分数。 (3)设Fe2O3被CO还原的质量分数为A%,则A和混合物中m(Fe):m(O)的关系式为[用含m(Fe)、m(O)的代数式表示]A%=___________。请在图中画出表示A和m(Fe)/m(O)关系的图形。
(4)如果Fe2O3和CO的反应分两步进行:3Fe2O3+CO2Fe3O4+CO2;Fe3O4+CO3FeO+CO2。 试分析反应形成的固体混合物可能的组成及相应的m(Fe):m(O)[令m(Fe):m(O)=21:a,写出a的取值范围]。将结果填入下表:
3.工业上用铝土矿(主要成分是Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料。提取时操作过程表示如下: (1)写出②③两处所用试剂的名称②____________③____________。? (2)写出在滤液B中加入物质③的离子方程式:__________。? (3)Al2O3熔点(2045 ℃)很高,工业上用冰晶石作助熔剂,电解熔融的Al2O3,其化学方程式是____________。某冶炼铝厂以碳为电极电解时,由于温度高,阳极生成的氧气与碳发生反应。当生成54 kg铝时,阳极消耗24 kg碳,则阳极生成的CO和CO2混合气体中,CO与CO2两种气体的分子个数比为____________。
【答案与解析】
一、选择题
1.B
【解析】提纯光卤石得到MgCl2的步骤为:先将光卤石溶解于水,因为KCl、MgCl2均易溶于水,先后沉淀Mg2+;Mg(OH)2的溶解度比Ca(OH)2更小,故加入适量的Ca(OH)2过滤后得Mg(OH)2,洗涤后溶于适量的盐酸发生反应:Mg(OH)2+2HCl==MgCl2+2H2O,蒸发溶液得MgCl2·6H2O,由于加热MgCl2·6H2O的过程中,会有部分MgCl2又与H2O反应生成Mg(OH)2。而MgCl2与H2O的反应是一个可逆反应:MgCl2+2H2O==Mg(OH)2+2HCl。根据平衡移动原理在HCl气氛中加热MgCl2·6H2O,使MgCl2与H2O的反应得到抑制,故能得到纯净的MgCl2。
2.D
【解析】金属的活泼性不同,冶炼方法不同,K、Ca、Na、Mg、Al等金属可用电解熔融的化合物的方法冶炼,Zn、Fe、Sn、Pb、Cu可用热还原发生冶炼;Hg、Ag可用分解法冶炼。
A.制备单质Mg应该用电解熔融MgCl2的方法,故A错误;
B.Al为活泼金属,应用电解熔融Al2O3制备,故B正确;
C.制备单质Na采用电解熔融NaCl的方法,电解溶液生成氢氧化钠、氢气和氯气,故C错误;
D.制备单质Cu用热还原法制备,故D错误。
3.C
4.C
【解析】A.Hg为不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,故A正确;
B.因Mn、W等高熔点金属可利用铝热反应产生的高温来冶炼,故B正确;
C.Mg为活泼金属,较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼,在加热条件下难以分解,故C错误;
D.Fe处于金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,故D正确。
5.C
【解析】根据化合价的变化判断,化合价变化的数值越小,说明发生氧化还原反应时得到的电子数目越少,则消耗铝的量最少。故选C。
6.A
【解析】根据反应前后元素化合价的变化可知Cu2S在反应中既作氧化剂又作还原剂,且Cu2O也是氧化剂,Cu是该反应的还原产物;从反应中可以看出每生成6molCu转移6mol电子,即生成19.2gCu时转移0.3mol电子。
7.C
【解析】根据化合价分析,HgS就是还原剂,又是氧化剂,A错误;SO2是氧化产物,B错误;Hg是还原产物,D错误。只有C对。
8.A
【解析】铝热反应常用于焊接铁轨,该反应中Al作还原剂,且反应为放热反应,用于提炼难熔金属,而与导电性、熔点及两性无关。
9.A
10.A
【解析】用金属作还原剂冶炼金属,金属的用量难以控制,会残留杂质;用氢气作还原剂冶炼金属,氢气可以过量,所得到的金属纯度更高。
11.D
【解析】炼铁的原料是铁矿石,所以,必须明确各种矿石的成分,题给矿石的主要成分依次为:①Fe2O3;②FeS2;③Fe3O4;④ZnS;⑤FeCO3,而FeCO3加热发生分解:FeCO3 FeO+CO2↑。故可用作炼铁原料的有①、②、③、⑤,选D。
12.D
【解析】选项A,Au是极不活泼金属,在自然界中有单质存在,古人不需冶炼即可获得,随着化学科学的进步,人类逐渐冶炼出Cu、Fe、Al等金属,可见人类认识和获取金属与金属活动性顺序密切相关。选项B,石油是不可再生资源,总有一天,石油会消耗殆尽,它不是解决人类吃、穿、住、行最有效的方法。选项C,AlCl3是共价化合物,电解熔融AlCl3得不到Al。选项D,将Cu在空气中充分燃烧后转化为CuO,CuO与稀H2SO4反应即可得到CuSO4。
二、非选择题
1.(1)过滤;Ca(OH)2; (2)NaAlO2;Fe2O3;CaCO3;Al2O3; (3)①Al2O3+2NaOH=2NaAlO2+H2O ②Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ③2Al(OH)3Al2O3+3H2O
2.(1)AC
(2)33.3%
(3)
(4)
【解析】 (1)用极限法计算Fe2O3和FeO中m(Fe):m(O),分别为21:9和 21:6,因反应形成固体混和物,故21:6﹤m(Fe):m(O)﹤21:9,选AC。 (2)解法一:取Fe2O3?m(Fe):m(O)=21:9;FeO m(Fe):m(O)=21:6 解法二:设Fe2O3原有n0?mol,还原百分率为A%,则有 (3)由化简可得,选m(Fe):m(O)从21:6到21:9之间的几个点作出下图:? (4)Fe2O3 ?Fe3O4? 8<a<9;
Fe3O4 ?FeO 6<a<8;
Fe2O3? Fe3O4? FeO 6<a<9
3.(1)氢氧化钠 二氧化碳 (2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
