人教版高中化学选修4第四章第一节 原电池 课件(共24张PPT)
文档属性
| 名称 | 人教版高中化学选修4第四章第一节 原电池 课件(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-18 00:00:00 | ||
图片预览






文档简介
(共24张PPT)
第一节 原电池
原电池原理
及其应用
学习目标
1、通过阅读课本、观察图片,记住原电池的概念,感受化学与人类生活的密切关系。
2、通过实验探究明确原电池原理和原电池的形成条件,学会判断原电池的正、负极,知道什么是电极反应式、电池总反应。
3、通过实验探究,逐步培养实验操作能力、探究意识及团队合作精神。
1.原电池是一种____________________ 的装置。
把化学能转化为电能
2.原电池中,一般用还原性较强的物质做________极,该极向外电路 电子,发生 反应;用氧化性较强的物质做 极,该极从外电路
电子,发生 反应;在电池内部,两极之间填充 。
负
正
提供
氧化
得到
还原
电解液
3.放电时,电子从 极通过 流向用电器,从 极流回电池,形成电流。
负
导线
正
【课前自学】
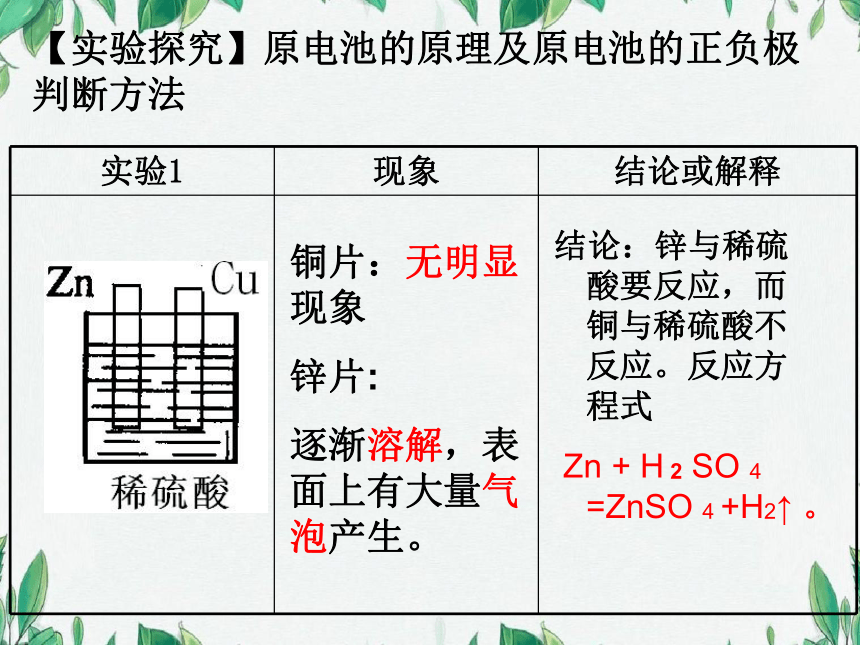
【实验探究】原电池的原理及原电池的正负极判断方法
铜片:无明显现象
锌片:
逐渐溶解,表面上有大量气泡产生。
结论:锌与稀硫酸要反应,而铜与稀硫酸不反应。反应方程式
Zn + H 2 SO 4 =ZnSO 4 +H2↑ 。
实验1 现象 结论或解释
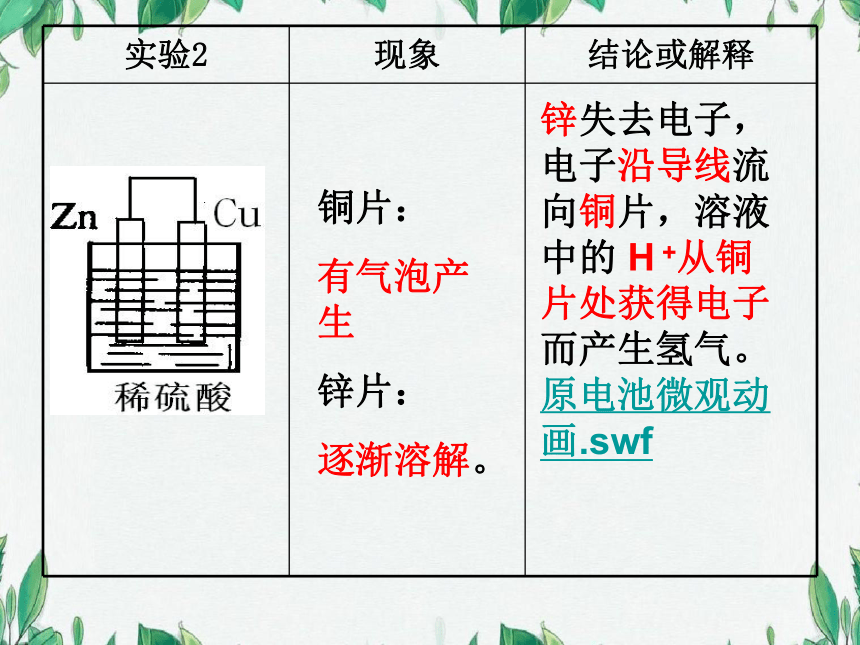
铜片:
有气泡产生
锌片:
逐渐溶解。
锌失去电子,电子沿导线流向铜片,溶液中的 H +从铜片处获得电子而产生氢气。原电池微观动画.swf
实验2 现象 结论或解释
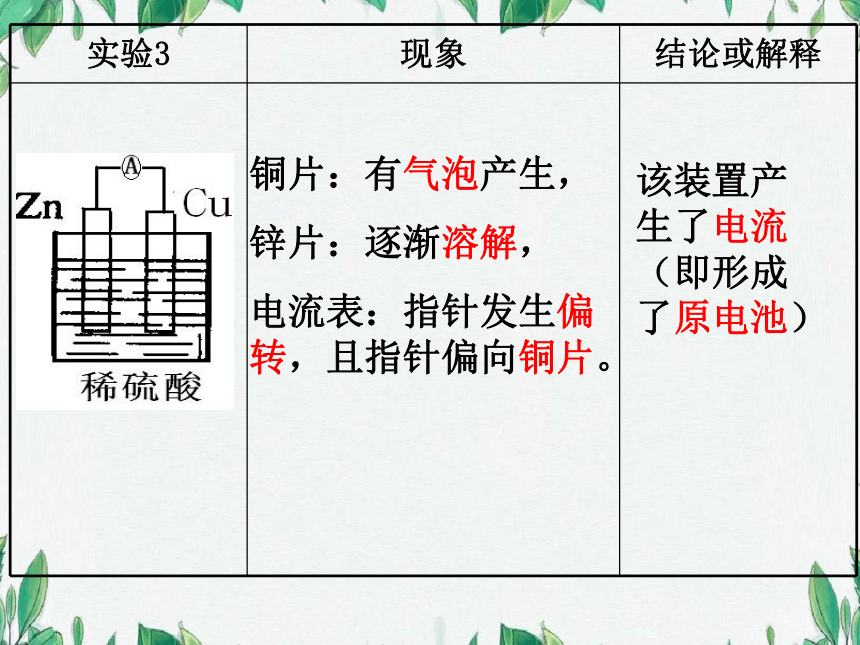
铜片:有气泡产生,
锌片:逐渐溶解,
电流表:指针发生偏转,且指针偏向铜片。
该装置产生了电流(即形成了原电池)
实验3 现象 结论或解释
电流表指针发生偏转,且偏向电池正极
实验2、3中Cu为原电池的正极
Zn为原电池的负极
实验4 现象 结论或解释
用连着电流表的导线接触废电池两极(观察电流表指针偏转方向)
<小组讨论>
1.分析铜锌原电池中涉及到哪些能量变化?
2.对比实验1、2分析原电池工作原理:
。
3.对比实验3、4分析铜锌原电池正负极及电极反应
正极 ( )
负极 ( )
电池总反应 ( )
1、原电池定义:将化学能转变为电能的装置
2、原电池原理:将还原剂失去的电子通过导线转移给氧化剂形成电流,从而实现化学能转变为电能。
铜片
锌片
2H + + 2e - = H 2↑
Zn - 2e - = Zn 2+
Zn +2 H + =Zn 2+ + H 2↑
还原反应
氧化反应
氧化还原反应
一、原电池
1、原电池定义:将化学能转变为电能的装置
2、原电池原理:将还原剂失去的电子通过导线转移给氧化剂形成电流,从而实现化学能转变为电能。
3、原电池的两电极—正、负极
负极:
正极:
还原剂失去电子发生氧化反应的一极(电子流出)
氧化剂得到电子发生还原反应的一极(电子流入)
4.铜锌原电池中电子流向?电流方向?电解质溶液中阴阳离子移动方向?
负极 正极
e-
电流
阳离子
阴离子
原电池正负极判断方法:
(1)金属活泼性:相对活泼金属作负极
(2)电子流向:负极流向正极
(3)电流方向:正极流向负极
(4)两极反应类型:负极发生氧化反应,正极发生还原反应
(5)电解质溶液中阴阳离子流动方向:阴离子移向负极,阳离子移向正极。
【归纳】
<实验探究>原电池的形成条件
序号 电流表指针有无偏转 结论或解释
实验5 无 无电流产生(电极材料相同)
实验6 无 无电流产生(电极材料相同)
实验7 有 有电流产生
实验8 无 无电流产生(无电解质溶液)
实验9 无 无电流产生(未形成闭合回路)
4、形成原电池的条件
⑴有氧化还原反应
⑵有两个活泼性不同的电极
⑶有电解质溶液
⑷电极和电解质溶液形成闭合回路
【课堂小结】
1、原电池定义
2、原电池原理
3、原电池的正负极及其判断
4、形成原电池的条件
【随堂练习】
1.以下反应不能设计成原电池的是( )
A.Zn+CuSO4=Cu+ZnSO4
B.NaOH+HCl=NaCl+H2O
C. 2H2+O2=2H2O
D. 2FeCl3+Cu=2FeCl2+CuCl2
B
—
+
—
—
—
+
+
+
2.判断以下装置哪些能构成原电池,构成原电池的请指出原电池的正负极。
3.请将氧化还原反应Fe+Cu2+=Fe2++Cu设计成原电池,并书写电极反应式。
负极:
正极:
电解质溶液:
Fe
比Fe不活泼的金属或石墨
CuSO4 、CuCl2等
负极:
正极:
Fe-2e-=Fe2+
Cu2++2e-=Cu
【课后作业】
1.预习课本87~91页后思考右图装置能否构成原电池?
2.自制水果电池;
3.教材习题一(1) 、 二(3)
—
+
—
—
—
+
+
+
1、请指出原电池的正负极,并书写电极反应式
Mg-2e-=Mg2+
负极:
正极:
{
负极:
正极:
{
2Al-6e-+8OH-=2AlO2-+4H2O
6H2O+6e-=3H2 +6OH-
{
{
负极:
正极:
负极:
正极:
Cu-2e-=Cu2+
4H++2NO3-+2e-=2NO2+2H2O
Fe-3e-=Fe3+
4H++NO3-+3e-=NO +2H2O
2、根据电池反应书写电极反应式:
锌锰干电池,电池反应:Zn+2NH4+=Zn2++2NH3+H2↑
铅蓄电池,电池反应Pb+PbO2+2H2SO4=2PbSO4+2H2O
负极:
正极:
负极:
正极:
Zn-2e-=Zn2+
2NH4++2e-=2NH3+H2
Pb+SO42--2e-=PbSO4
PbO2+SO42-+4H++2e-=PbSO4+2H2O
第一节 原电池
原电池原理
及其应用
学习目标
1、通过阅读课本、观察图片,记住原电池的概念,感受化学与人类生活的密切关系。
2、通过实验探究明确原电池原理和原电池的形成条件,学会判断原电池的正、负极,知道什么是电极反应式、电池总反应。
3、通过实验探究,逐步培养实验操作能力、探究意识及团队合作精神。
1.原电池是一种____________________ 的装置。
把化学能转化为电能
2.原电池中,一般用还原性较强的物质做________极,该极向外电路 电子,发生 反应;用氧化性较强的物质做 极,该极从外电路
电子,发生 反应;在电池内部,两极之间填充 。
负
正
提供
氧化
得到
还原
电解液
3.放电时,电子从 极通过 流向用电器,从 极流回电池,形成电流。
负
导线
正
【课前自学】
【实验探究】原电池的原理及原电池的正负极判断方法
铜片:无明显现象
锌片:
逐渐溶解,表面上有大量气泡产生。
结论:锌与稀硫酸要反应,而铜与稀硫酸不反应。反应方程式
Zn + H 2 SO 4 =ZnSO 4 +H2↑ 。
实验1 现象 结论或解释
铜片:
有气泡产生
锌片:
逐渐溶解。
锌失去电子,电子沿导线流向铜片,溶液中的 H +从铜片处获得电子而产生氢气。原电池微观动画.swf
实验2 现象 结论或解释
铜片:有气泡产生,
锌片:逐渐溶解,
电流表:指针发生偏转,且指针偏向铜片。
该装置产生了电流(即形成了原电池)
实验3 现象 结论或解释
电流表指针发生偏转,且偏向电池正极
实验2、3中Cu为原电池的正极
Zn为原电池的负极
实验4 现象 结论或解释
用连着电流表的导线接触废电池两极(观察电流表指针偏转方向)
<小组讨论>
1.分析铜锌原电池中涉及到哪些能量变化?
2.对比实验1、2分析原电池工作原理:
。
3.对比实验3、4分析铜锌原电池正负极及电极反应
正极 ( )
负极 ( )
电池总反应 ( )
1、原电池定义:将化学能转变为电能的装置
2、原电池原理:将还原剂失去的电子通过导线转移给氧化剂形成电流,从而实现化学能转变为电能。
铜片
锌片
2H + + 2e - = H 2↑
Zn - 2e - = Zn 2+
Zn +2 H + =Zn 2+ + H 2↑
还原反应
氧化反应
氧化还原反应
一、原电池
1、原电池定义:将化学能转变为电能的装置
2、原电池原理:将还原剂失去的电子通过导线转移给氧化剂形成电流,从而实现化学能转变为电能。
3、原电池的两电极—正、负极
负极:
正极:
还原剂失去电子发生氧化反应的一极(电子流出)
氧化剂得到电子发生还原反应的一极(电子流入)
4.铜锌原电池中电子流向?电流方向?电解质溶液中阴阳离子移动方向?
负极 正极
e-
电流
阳离子
阴离子
原电池正负极判断方法:
(1)金属活泼性:相对活泼金属作负极
(2)电子流向:负极流向正极
(3)电流方向:正极流向负极
(4)两极反应类型:负极发生氧化反应,正极发生还原反应
(5)电解质溶液中阴阳离子流动方向:阴离子移向负极,阳离子移向正极。
【归纳】
<实验探究>原电池的形成条件
序号 电流表指针有无偏转 结论或解释
实验5 无 无电流产生(电极材料相同)
实验6 无 无电流产生(电极材料相同)
实验7 有 有电流产生
实验8 无 无电流产生(无电解质溶液)
实验9 无 无电流产生(未形成闭合回路)
4、形成原电池的条件
⑴有氧化还原反应
⑵有两个活泼性不同的电极
⑶有电解质溶液
⑷电极和电解质溶液形成闭合回路
【课堂小结】
1、原电池定义
2、原电池原理
3、原电池的正负极及其判断
4、形成原电池的条件
【随堂练习】
1.以下反应不能设计成原电池的是( )
A.Zn+CuSO4=Cu+ZnSO4
B.NaOH+HCl=NaCl+H2O
C. 2H2+O2=2H2O
D. 2FeCl3+Cu=2FeCl2+CuCl2
B
—
+
—
—
—
+
+
+
2.判断以下装置哪些能构成原电池,构成原电池的请指出原电池的正负极。
3.请将氧化还原反应Fe+Cu2+=Fe2++Cu设计成原电池,并书写电极反应式。
负极:
正极:
电解质溶液:
Fe
比Fe不活泼的金属或石墨
CuSO4 、CuCl2等
负极:
正极:
Fe-2e-=Fe2+
Cu2++2e-=Cu
【课后作业】
1.预习课本87~91页后思考右图装置能否构成原电池?
2.自制水果电池;
3.教材习题一(1) 、 二(3)
—
+
—
—
—
+
+
+
1、请指出原电池的正负极,并书写电极反应式
Mg-2e-=Mg2+
负极:
正极:
{
负极:
正极:
{
2Al-6e-+8OH-=2AlO2-+4H2O
6H2O+6e-=3H2 +6OH-
{
{
负极:
正极:
负极:
正极:
Cu-2e-=Cu2+
4H++2NO3-+2e-=2NO2+2H2O
Fe-3e-=Fe3+
4H++NO3-+3e-=NO +2H2O
2、根据电池反应书写电极反应式:
锌锰干电池,电池反应:Zn+2NH4+=Zn2++2NH3+H2↑
铅蓄电池,电池反应Pb+PbO2+2H2SO4=2PbSO4+2H2O
负极:
正极:
负极:
正极:
Zn-2e-=Zn2+
2NH4++2e-=2NH3+H2
Pb+SO42--2e-=PbSO4
PbO2+SO42-+4H++2e-=PbSO4+2H2O
