人教版高中化学选修4第四章第一节 原电池 课件(共20张PPT)
文档属性
| 名称 | 人教版高中化学选修4第四章第一节 原电池 课件(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-18 16:57:28 | ||
图片预览






文档简介
(共20张PPT)
组织建设
化学 · 选修4《化学反应原理》
原电池
市售“热敷袋”主要成分是:铁屑、炭粉、木屑与少量NaCl、水等。它在使用之前需要与空气隔绝,使用时开启塑料袋上的小孔,轻轻揉搓就会有热量放出,当使用完后还会发现有铁锈生成。
(1) 热敷袋使用时,为什么会放出热量?
(3)试写出有关的电极反应式和化学方程式。
(2)碳粉的主要作用是什么?氯化钠又起了什么作用?
生活化学
利用铁被氧气氧化时放热反应所放出的热量
负极:2Fe - 4e- = 2Fe2+
正极:O2+2H2O + 4e- = 4OH-
总反应:2Fe+O2+2H2O = 2Fe(OH)2
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
碳粉的主要作用是和铁粉、氯化钠溶液一起构成原电池,加速铁屑的氧化。氯化钠溶于水,形成了电解质溶液。
(1) 热敷袋使用时,为什么会放出热量?
(3)试写出有关的电极反应式和化学方程式。
(2)碳粉的主要作用是什么?氯化钠又起了什么作用?
生活化学
形形色色的电池
生活化学
一、原电池的改进
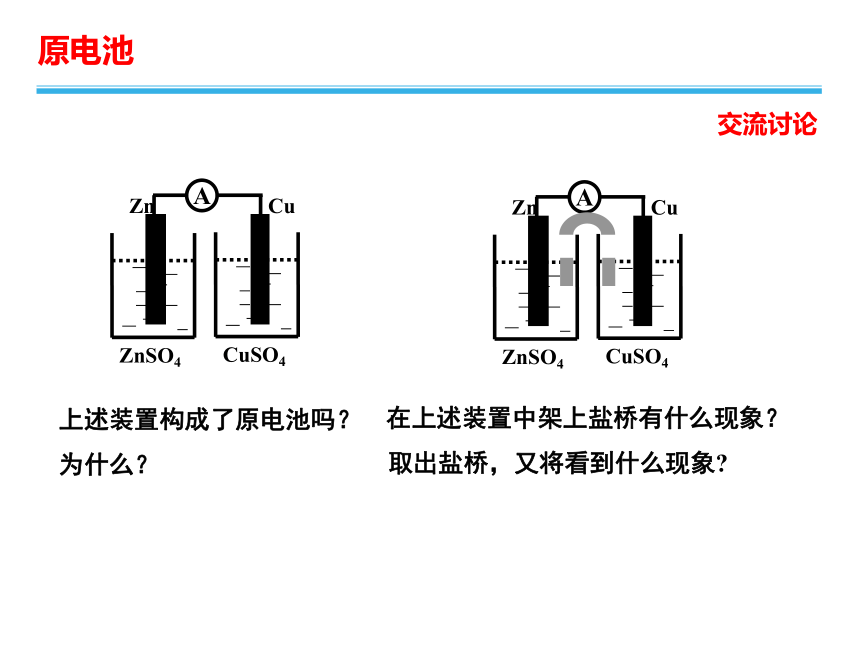
左图是原电池,如果用它做电源,效率比较低,时间稍长电流就很快减弱,不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
问题导学
上述装置构成了原电池吗?
为什么?
在上述装置中架上盐桥有什么现象?
取出盐桥,又将看到什么现象?
交流讨论
交流总结
(1)盐桥的成分:饱和的KCl溶液和琼脂
(2)盐桥的作用:
①可使由它连接的两溶液保持电中性。
②保障整个电路闭合,维持反应进行。
③转移离子,沟通内电路。
认识盐桥
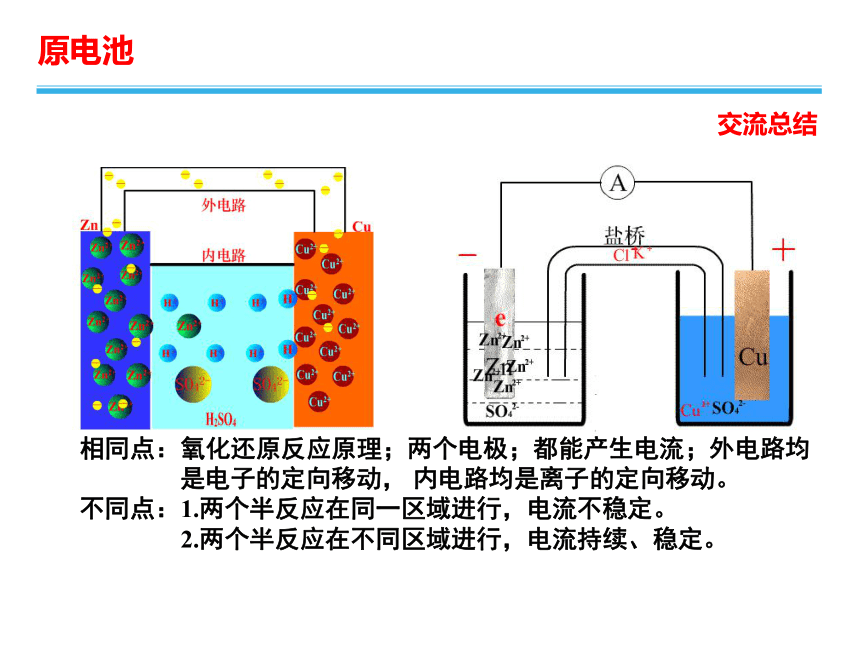
相同点:氧化还原反应原理;两个电极;都能产生电流;外电路均
是电子的定向移动, 内电路均是离子的定向移动。
不同点:1.两个半反应在同一区域进行,电流不稳定。
2.两个半反应在不同区域进行,电流持续、稳定。
交流总结
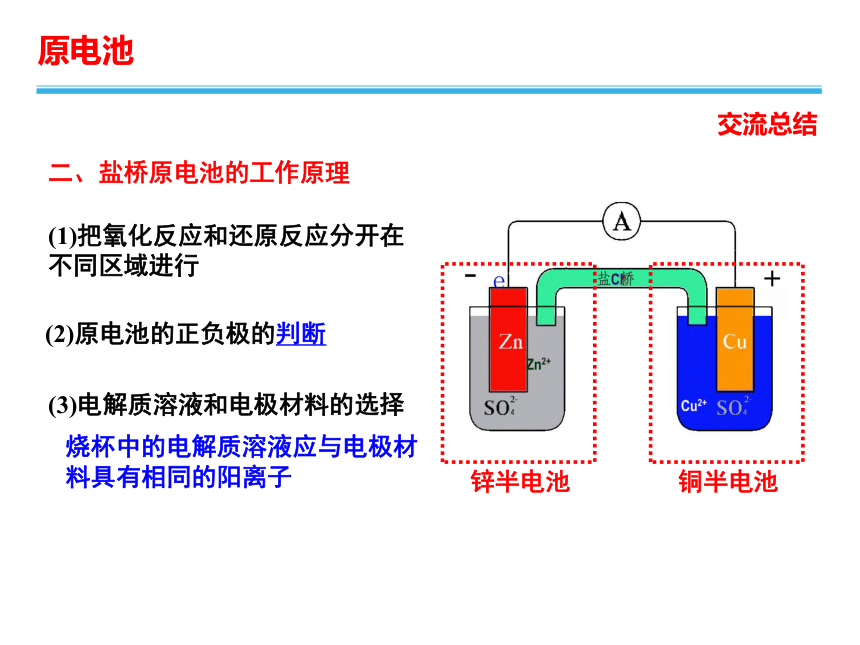
二、盐桥原电池的工作原理
(1)把氧化反应和还原反应分开在不同区域进行
锌半电池
铜半电池
(2)原电池的正负极的判断
(3)电解质溶液和电极材料的选择
烧杯中的电解质溶液应与电极材料具有相同的阳离子
交流总结
反应实质
电子流出
电子流入
——正极
较活泼的电极材料
较不活泼的电极材料
反应类型
发生氧化反应的极
发生还原反应的极
电极材料
电极质量
质量增加的电极
质量减少的电极
——负极
——负极
——负极
——负极
——正极
——正极
——正极
总结感悟
判断右边原电池的正、负极,并写出电极反应式。
负极: Cu - 2e- = Cu2+
正极: 2Fe3+ + 2e- = 2Fe2+
Cu+2FeCl3 = CuCl2 +2FeCl2
先写出总反应:
拆成离子方程式:
Cu + 2Fe3+ = Cu2+ + 2Fe2+
根据化合价升降判断正负极
三、电极方程式的书写
1.简单原电池电极方程式的写法
习题导学
总反应方程式
负极:2Al - 6e- = 2Al3+
2Al3+ + 8OH- =2AlO2- + 4H2O
负极总反应: 2Al +8OH- -6e- =2AlO2- + 4H2O
正极:总反应-负极反应
6H2O +6e- =6OH—+ 3H2↑
离子方程式
2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
根据化合价升降判断正负极
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2.复杂原电池电极方程式的书写
习题导学
1、根据氧化还原反应电子转移判断电极反应
2、根据电极反应确定合适的电极材料和电解质溶液
利用Fe + Cu2+=Fe2+ +Cu,设计一个原电池
四、原电池的设计
交流总结
习题导学
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 设计出原电池,并写出电极反应
负极:Zn-2e-=Zn2+(氧化反应)
正极:2Fe3++2e-=2Fe2+(还原反应)
1.利用原电池原理设计新型化学电池
2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气
3.进行金属活动性强弱比较
4.保护金属不受腐蚀,即将金属作为原电池的正极而受到保护
五、原电池原理的应用
5.解释某些化学现象
1.在理论上不能用于设计成原电池的化学反应是( )
A.4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3 ΔH<0
B.CH3CH2OH(l)+3O2(g)―→2CO2(g)+3H2O(l) ΔH<0
C.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+2H2O ΔH<0
D.H2(g)+Cl2(g)===2HCl(g) ΔH<0
C
课堂巩固
2、把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极.则这四种金属的活动性顺序由大到小为( )
A.a>b>c>d??? B.a>c>d>b
C.c>a>b>d????? D.b>d>c>a
B
课堂巩固
课堂巩固
3、在铜一锌一硫酸构成的原电池中,当导线中有1mol电子通时,理论上的两极变化是( )
①锌片溶解32.5g ②锌片增重32.5g
③铜片上析出1 gH2 ④铜片上析出1mol H2
A. ①③ B. ①④
C. ②③ D. ②④
A
4、某原电池的总反应的离子方程式为:
2Fe3++Fe == 3Fe2+,不能实现该反应的原电池组成是( )
A、正极为铜,负极为铁,电解质溶液为FeCl3溶液
B、正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C、正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D、正极为银,负极为铁,电解质溶液为CuSO4溶液
C
课堂巩固
课堂总结
一、单池原电池
二、盐桥原电池的工作原理
五、原电池原理的应用
四、由反应设计原电池
三、电极方程式的书写
组织建设
化学 · 选修4《化学反应原理》
原电池
市售“热敷袋”主要成分是:铁屑、炭粉、木屑与少量NaCl、水等。它在使用之前需要与空气隔绝,使用时开启塑料袋上的小孔,轻轻揉搓就会有热量放出,当使用完后还会发现有铁锈生成。
(1) 热敷袋使用时,为什么会放出热量?
(3)试写出有关的电极反应式和化学方程式。
(2)碳粉的主要作用是什么?氯化钠又起了什么作用?
生活化学
利用铁被氧气氧化时放热反应所放出的热量
负极:2Fe - 4e- = 2Fe2+
正极:O2+2H2O + 4e- = 4OH-
总反应:2Fe+O2+2H2O = 2Fe(OH)2
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
碳粉的主要作用是和铁粉、氯化钠溶液一起构成原电池,加速铁屑的氧化。氯化钠溶于水,形成了电解质溶液。
(1) 热敷袋使用时,为什么会放出热量?
(3)试写出有关的电极反应式和化学方程式。
(2)碳粉的主要作用是什么?氯化钠又起了什么作用?
生活化学
形形色色的电池
生活化学
一、原电池的改进
左图是原电池,如果用它做电源,效率比较低,时间稍长电流就很快减弱,不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
问题导学
上述装置构成了原电池吗?
为什么?
在上述装置中架上盐桥有什么现象?
取出盐桥,又将看到什么现象?
交流讨论
交流总结
(1)盐桥的成分:饱和的KCl溶液和琼脂
(2)盐桥的作用:
①可使由它连接的两溶液保持电中性。
②保障整个电路闭合,维持反应进行。
③转移离子,沟通内电路。
认识盐桥
相同点:氧化还原反应原理;两个电极;都能产生电流;外电路均
是电子的定向移动, 内电路均是离子的定向移动。
不同点:1.两个半反应在同一区域进行,电流不稳定。
2.两个半反应在不同区域进行,电流持续、稳定。
交流总结
二、盐桥原电池的工作原理
(1)把氧化反应和还原反应分开在不同区域进行
锌半电池
铜半电池
(2)原电池的正负极的判断
(3)电解质溶液和电极材料的选择
烧杯中的电解质溶液应与电极材料具有相同的阳离子
交流总结
反应实质
电子流出
电子流入
——正极
较活泼的电极材料
较不活泼的电极材料
反应类型
发生氧化反应的极
发生还原反应的极
电极材料
电极质量
质量增加的电极
质量减少的电极
——负极
——负极
——负极
——负极
——正极
——正极
——正极
总结感悟
判断右边原电池的正、负极,并写出电极反应式。
负极: Cu - 2e- = Cu2+
正极: 2Fe3+ + 2e- = 2Fe2+
Cu+2FeCl3 = CuCl2 +2FeCl2
先写出总反应:
拆成离子方程式:
Cu + 2Fe3+ = Cu2+ + 2Fe2+
根据化合价升降判断正负极
三、电极方程式的书写
1.简单原电池电极方程式的写法
习题导学
总反应方程式
负极:2Al - 6e- = 2Al3+
2Al3+ + 8OH- =2AlO2- + 4H2O
负极总反应: 2Al +8OH- -6e- =2AlO2- + 4H2O
正极:总反应-负极反应
6H2O +6e- =6OH—+ 3H2↑
离子方程式
2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
根据化合价升降判断正负极
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2.复杂原电池电极方程式的书写
习题导学
1、根据氧化还原反应电子转移判断电极反应
2、根据电极反应确定合适的电极材料和电解质溶液
利用Fe + Cu2+=Fe2+ +Cu,设计一个原电池
四、原电池的设计
交流总结
习题导学
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 设计出原电池,并写出电极反应
负极:Zn-2e-=Zn2+(氧化反应)
正极:2Fe3++2e-=2Fe2+(还原反应)
1.利用原电池原理设计新型化学电池
2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气
3.进行金属活动性强弱比较
4.保护金属不受腐蚀,即将金属作为原电池的正极而受到保护
五、原电池原理的应用
5.解释某些化学现象
1.在理论上不能用于设计成原电池的化学反应是( )
A.4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3 ΔH<0
B.CH3CH2OH(l)+3O2(g)―→2CO2(g)+3H2O(l) ΔH<0
C.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+2H2O ΔH<0
D.H2(g)+Cl2(g)===2HCl(g) ΔH<0
C
课堂巩固
2、把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极.则这四种金属的活动性顺序由大到小为( )
A.a>b>c>d??? B.a>c>d>b
C.c>a>b>d????? D.b>d>c>a
B
课堂巩固
课堂巩固
3、在铜一锌一硫酸构成的原电池中,当导线中有1mol电子通时,理论上的两极变化是( )
①锌片溶解32.5g ②锌片增重32.5g
③铜片上析出1 gH2 ④铜片上析出1mol H2
A. ①③ B. ①④
C. ②③ D. ②④
A
4、某原电池的总反应的离子方程式为:
2Fe3++Fe == 3Fe2+,不能实现该反应的原电池组成是( )
A、正极为铜,负极为铁,电解质溶液为FeCl3溶液
B、正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C、正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D、正极为银,负极为铁,电解质溶液为CuSO4溶液
C
课堂巩固
课堂总结
一、单池原电池
二、盐桥原电池的工作原理
五、原电池原理的应用
四、由反应设计原电池
三、电极方程式的书写
