人教版九年级下册 第八单元 课题3 金属资源的利用与保护 第二课时 金属资源保护(21张PPT)
文档属性
| 名称 | 人教版九年级下册 第八单元 课题3 金属资源的利用与保护 第二课时 金属资源保护(21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-19 18:11:15 | ||
图片预览







文档简介
(共21张PPT)
课题3 金属资源的利用和保护
第二课时 金属资源保护
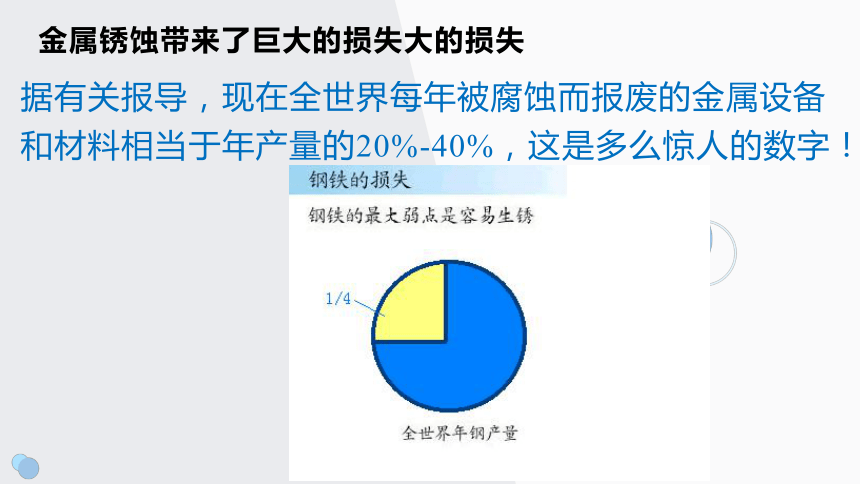
金属锈蚀带来了巨大的损失大的损失
据有关报导,现在全世界每年被腐蚀而报废的金属设备和材料相当于年产量的20%-40%,这是多么惊人的数字!
铁轨的锈蚀
铁钉的生锈
各种铁制品的锈蚀
为了减少损失,需要探究金属锈蚀的原因、防护的方法和废金属的回收利用
金属锈蚀给人类带来了巨大的损失。
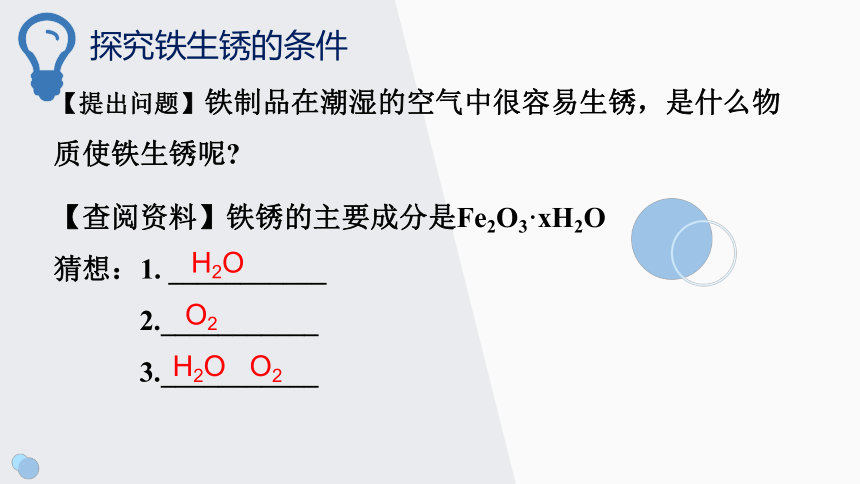
探究铁生锈的条件
【提出问题】铁制品在潮湿的空气中很容易生锈,是什么物质使铁生锈呢?
【查阅资料】铁锈的主要成分是Fe2O3·xH2O
猜想:1. ___________
2.___________
3.___________
H2O
O2
H2O O2
实验:探究铁生锈的条件
一半在水中
全浸在水中
干燥空气中
设计实验
植物油的作用
干燥剂
氯化钙的作用
煮沸冷却的蒸馏水
一周后
铁钉浸没一半在水中: 铁在空气、水的界面处生锈
铁钉完全浸没在水中(上面还加植物油): 铁未生锈
铁钉放在干燥的空气中(加干燥剂等): 铁未生锈
全浸在水中
一半在水中
干燥空气中
现象
分析:
A与B比较可得出: 生锈需要与氧气接触
A与C比较可得出:生锈需要与水接触
1.铁生锈是铁与氧气、水等物质相互作用。
(缓慢氧化,放热)
2.铁锈(混合物)的主要成分是氧化铁,
结论:
Fe2O3·xH2O
红棕色.
【小试牛刀1】钢铁是使用最多的金属材料.
(1)
如图是同学们为探究铁锈蚀条件所设计的一组对比实验装置.调节L端与R端的液面高度一致,塞紧木塞,一周后观察,
L端液面高于R端.该实验说明铁锈蚀的条件之一是 .
水
(19年广东中考 )探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是( )
A.甲和乙:水 B.乙和丙:空气
C.甲和丙:空气 D.甲和丁:水
D
【应用提升】
1.如图是小江借助U形管探究钢铁锈蚀的条件的装置图。一段时间后观察,发现钢丝棉1和钢丝棉2表面都出现不同程度的红褐色锈斑。手摸钢丝棉1、2周围的玻璃管外壁,感觉有不同程度的热量。24h后,钢丝棉3、4表面仍然没有明显变化。请根据以上信息回答下列问题:
(1)由于盐水会加快钢铁的生锈速率,实验
开始一段时间后可观察到U形管中液面情况是 ;
(2)该实验可以证明钢铁锈蚀的条件是
________________________________
左端液面高,右端液面低
钢铁锈蚀的条件是必须同时与水、氧气接触
活动三 谈谈铁生锈的利和弊
弊:铁生锈会加快铁制品腐蚀,造成资源浪费。
利:利用铁生锈缓慢氧化产生的热量,制造输液加温器,暖身贴等。
铁生锈
【对接中考】某“取暖片”外包装的图片.该“取暖片”中发热剂的主要成分有铁粉、活性炭、氯化钠、水等,其原理是铁生锈放热.
(1)发热剂需接触到空气才会发热,原因是铁要与_ _ _等物质共同作用才会生锈.
(2)发热剂成分中氯化钠的作用是 .
氧气、水
加速铁粉生锈,更快地放出热量
课堂小结
主要成分
共同作用
铁生锈的条件
课后延伸:
你知道哪些加快铁生锈速率的情况?
你能否根据铁生锈的条件提出防止铁制品生锈的原理吗?
感谢您的聆听
加快铁生锈速率的情况
酸性污染物的存在
(酸雨)
加快生锈速度
离子化合物的存在
(氯化钠)
高溫
(加快化学反应速度)
较不活泼金属接触(置换反应)
经刮擦或凹凸扭曲表面(增加接触面)
铁
在空气中锈蚀,实际上是铁跟氧气、水等物质相互作用,发生一系列复杂的化学变化,使铁转化为铁的化合物的过程。
因此,铁与空气接触,又有水分时,最易生锈!
铁锈成分复杂,主要是Fe2O3·XH2O
它是一种疏松多孔的物质
铁锈
铁锈这种多孔性的物质,能让水分和空气穿过它的空隙,不断向里层渗透,继续跟铁反应,直至铁被完全锈蚀。
氧化铁与铝壶表面的氧化铝膜性质比较
铁锈
(Fe2O3) 氧化铝
(Al2O3)
结构特点
若不除去结果
疏松多孔
完全锈蚀
致密结实
使铝“自我保护”
铁
铁锈
与空气(氧气)接触
与水接触
思考:根据铜绿的化学式Cu2(OH)2CO3分析铜生锈的条件又是什么?
推理依据是按铜绿的化学式
可知:铜绿含C、H、O、Cu四种
元素,若无空气中的O2、H2O、CO2 等对铜发生作用则铜绿中不可能含O、C、H等元素。在潮湿的空气中铜与氧气、水、二氧化碳等作用生成了铜绿。
用白醋浸泡可除去铜锈。
氧化铁与铝壶表面的氧化铝膜性质比较
铁锈
(Fe2O3) 氧化铝
(Al2O3)
结构特点
若不除去结果
疏松多孔
完全锈蚀
致密结实
使铝“自我保护”
铁
铁锈
与空气(氧气)接触
与水接触
课题3 金属资源的利用和保护
第二课时 金属资源保护
金属锈蚀带来了巨大的损失大的损失
据有关报导,现在全世界每年被腐蚀而报废的金属设备和材料相当于年产量的20%-40%,这是多么惊人的数字!
铁轨的锈蚀
铁钉的生锈
各种铁制品的锈蚀
为了减少损失,需要探究金属锈蚀的原因、防护的方法和废金属的回收利用
金属锈蚀给人类带来了巨大的损失。
探究铁生锈的条件
【提出问题】铁制品在潮湿的空气中很容易生锈,是什么物质使铁生锈呢?
【查阅资料】铁锈的主要成分是Fe2O3·xH2O
猜想:1. ___________
2.___________
3.___________
H2O
O2
H2O O2
实验:探究铁生锈的条件
一半在水中
全浸在水中
干燥空气中
设计实验
植物油的作用
干燥剂
氯化钙的作用
煮沸冷却的蒸馏水
一周后
铁钉浸没一半在水中: 铁在空气、水的界面处生锈
铁钉完全浸没在水中(上面还加植物油): 铁未生锈
铁钉放在干燥的空气中(加干燥剂等): 铁未生锈
全浸在水中
一半在水中
干燥空气中
现象
分析:
A与B比较可得出: 生锈需要与氧气接触
A与C比较可得出:生锈需要与水接触
1.铁生锈是铁与氧气、水等物质相互作用。
(缓慢氧化,放热)
2.铁锈(混合物)的主要成分是氧化铁,
结论:
Fe2O3·xH2O
红棕色.
【小试牛刀1】钢铁是使用最多的金属材料.
(1)
如图是同学们为探究铁锈蚀条件所设计的一组对比实验装置.调节L端与R端的液面高度一致,塞紧木塞,一周后观察,
L端液面高于R端.该实验说明铁锈蚀的条件之一是 .
水
(19年广东中考 )探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是( )
A.甲和乙:水 B.乙和丙:空气
C.甲和丙:空气 D.甲和丁:水
D
【应用提升】
1.如图是小江借助U形管探究钢铁锈蚀的条件的装置图。一段时间后观察,发现钢丝棉1和钢丝棉2表面都出现不同程度的红褐色锈斑。手摸钢丝棉1、2周围的玻璃管外壁,感觉有不同程度的热量。24h后,钢丝棉3、4表面仍然没有明显变化。请根据以上信息回答下列问题:
(1)由于盐水会加快钢铁的生锈速率,实验
开始一段时间后可观察到U形管中液面情况是 ;
(2)该实验可以证明钢铁锈蚀的条件是
________________________________
左端液面高,右端液面低
钢铁锈蚀的条件是必须同时与水、氧气接触
活动三 谈谈铁生锈的利和弊
弊:铁生锈会加快铁制品腐蚀,造成资源浪费。
利:利用铁生锈缓慢氧化产生的热量,制造输液加温器,暖身贴等。
铁生锈
【对接中考】某“取暖片”外包装的图片.该“取暖片”中发热剂的主要成分有铁粉、活性炭、氯化钠、水等,其原理是铁生锈放热.
(1)发热剂需接触到空气才会发热,原因是铁要与_ _ _等物质共同作用才会生锈.
(2)发热剂成分中氯化钠的作用是 .
氧气、水
加速铁粉生锈,更快地放出热量
课堂小结
主要成分
共同作用
铁生锈的条件
课后延伸:
你知道哪些加快铁生锈速率的情况?
你能否根据铁生锈的条件提出防止铁制品生锈的原理吗?
感谢您的聆听
加快铁生锈速率的情况
酸性污染物的存在
(酸雨)
加快生锈速度
离子化合物的存在
(氯化钠)
高溫
(加快化学反应速度)
较不活泼金属接触(置换反应)
经刮擦或凹凸扭曲表面(增加接触面)
铁
在空气中锈蚀,实际上是铁跟氧气、水等物质相互作用,发生一系列复杂的化学变化,使铁转化为铁的化合物的过程。
因此,铁与空气接触,又有水分时,最易生锈!
铁锈成分复杂,主要是Fe2O3·XH2O
它是一种疏松多孔的物质
铁锈
铁锈这种多孔性的物质,能让水分和空气穿过它的空隙,不断向里层渗透,继续跟铁反应,直至铁被完全锈蚀。
氧化铁与铝壶表面的氧化铝膜性质比较
铁锈
(Fe2O3) 氧化铝
(Al2O3)
结构特点
若不除去结果
疏松多孔
完全锈蚀
致密结实
使铝“自我保护”
铁
铁锈
与空气(氧气)接触
与水接触
思考:根据铜绿的化学式Cu2(OH)2CO3分析铜生锈的条件又是什么?
推理依据是按铜绿的化学式
可知:铜绿含C、H、O、Cu四种
元素,若无空气中的O2、H2O、CO2 等对铜发生作用则铜绿中不可能含O、C、H等元素。在潮湿的空气中铜与氧气、水、二氧化碳等作用生成了铜绿。
用白醋浸泡可除去铜锈。
氧化铁与铝壶表面的氧化铝膜性质比较
铁锈
(Fe2O3) 氧化铝
(Al2O3)
结构特点
若不除去结果
疏松多孔
完全锈蚀
致密结实
使铝“自我保护”
铁
铁锈
与空气(氧气)接触
与水接触
同课章节目录
