2020届人教版九年级化学下册课件:第十单元课题2酸和碱的中和反应(共21张PPT)
文档属性
| 名称 | 2020届人教版九年级化学下册课件:第十单元课题2酸和碱的中和反应(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-19 18:17:09 | ||
图片预览







文档简介
(共21张PPT)
第十单元 酸和碱
课题2 酸和碱的中和反应
课前准备
教学分析
1.理解掌握酸碱中和反应的概念,为复分解反应的认识作铺垫。
学习目标
2.初步体验酸碱指示剂在中和反应探究实验中的应用。
3.了解中和反应在工农业生产、生活等方面的应用。
4.理解溶液酸碱度的表示法——pH,以及溶液的酸碱度和pH的范围划分。
5.会用pH试纸测定溶液的酸碱度并熟练掌握相关的基本操作。
课前准备
教学分析
学习重点 理解中和反应的概念和反应特征;会用pH试纸测定溶液的酸碱度。
学习难点 酸碱指示剂与溶液的酸碱性的联系。
学习方法 联系实际、大胆猜测、认真观察、积极思考。
学具准备 稀盐酸、稀硫酸、氢氧化钠溶液、酚酞溶液、pH试纸、玻璃片、
玻璃棒等
教学内容
01
情景引入
02
互动新授
03
巩固扩展
04
课堂小结
点我喔
情景引入
在生活中,肥皂中含有氢氧化钠,用肥皂洗衣服之后手有干涩的感觉,用加了醋的清水浸泡一会儿,干涩感就会缓解。那么碱和酸之间到底发生了什么反应?
互动新授
(中和反应)
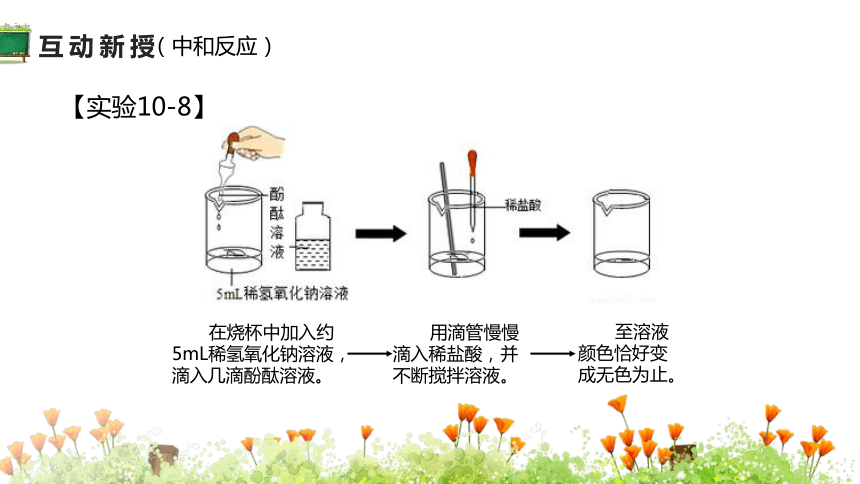
【实验10-8】
在烧杯中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液。
用滴管慢慢滴入稀盐酸,并不断搅拌溶液。
至溶液颜色恰好变成无色为止。
互动新授
(中和反应)
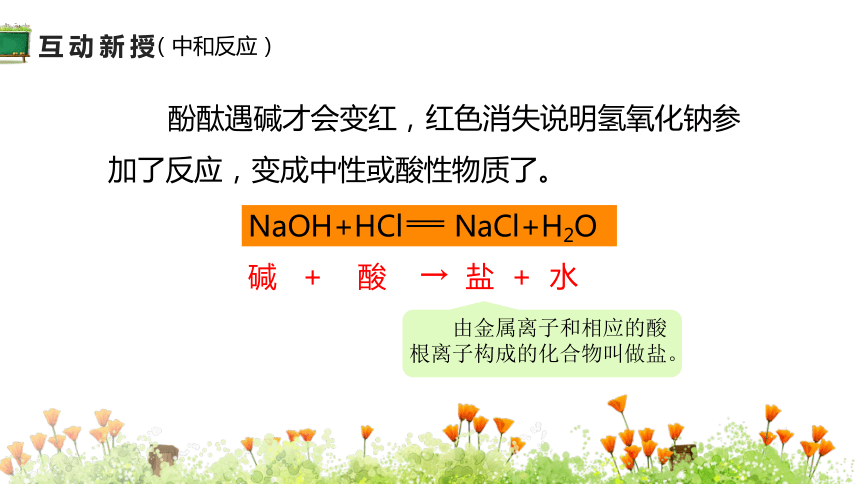
NaOH+HCl NaCl+H2O
碱 + 酸 → 盐 + 水
由金属离子和相应的酸根离子构成的化合物叫做盐。
酚酞遇碱才会变红,红色消失说明氢氧化钠参加了反应,变成中性或酸性物质了。
互动新授
(中和反应)
其他酸与碱也能发生类似的反应。例如
Ca(OH)2+2HCl CaCl2+2H2O
2NaOH+H2SO4 Na2SO4+2H2O
酸与碱作用生成盐和水的反应,叫做中和反应。
互动新授
(中和反应在实际中的应用)
(1)改变土壤的酸碱性——熟石灰改良酸性土壤
(2)处理工厂的废水——熟石灰中和处理硫酸厂污水
(3)用于医药——含有碱性物质的药物治疗胃酸过多
中和反应的应用
互动新授
(溶液酸碱度的表示法——pH)
溶液的酸碱度常用pH来表示,pH的范围通常是0~14。测定pH最简便的方法是使用pH试纸。
一种pH试纸和比色卡
互动新授
(溶液酸碱度的表示法——pH)
中性
酸性增强
碱性增强
【实验10-9】
在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH 。
互动新授
(溶液酸碱度的表示法——pH)
pH 酸碱性
稀盐酸 2 酸性
2
稀硫酸 1 酸性
1
稀氢氧化钠溶液 11 碱性
11
氯化钠溶液 7 中性
7
酸性溶液的pH<7;中性溶液的pH=7;碱性溶液的pH>7。
互动新授
(溶液酸碱度的表示法——pH)
【实验10-10】测定生活中一些物质的pH
身边一些物质的PH
互动新授
(溶液酸碱度的表示法——pH)
pH试纸注意事项
互动新授
(溶液酸碱度的表示法——pH)
化工生产中,许多反应必须在一定pH溶液里才能进行。
在农业生产中,农作物一般适宜在pH=7或接近7的土壤中生长。
互动新授
(溶液酸碱度的表示法——pH)
测定人体内或排出的液体的pH,可以了解人体的健康状况。
测定雨水的pH可以了解空气污染情况(正常雨水pH约为5.6,酸雨的pH<5.6)。
互动新授
(溶液酸碱度的表示法——pH)
(1)一般情况下,我们使用的洗发用品是酸性的还是碱性的?
(2)洗发时,一般是用过洗发剂再用护发剂,为什么?
探究
洗发水呈碱性,能够帮助头发的毛鳞片打开,彻底清洁的同时还能吸收营养;护发素呈酸性,能关闭头发的毛鳞片,使头发顺滑。
巩固扩展
例 制作馒头时,需加入面碱(主要含碳酸钠),如果面碱放多了,蒸出的馒头会发黄,且口感不好。为除去过多的面碱,做馒头时可加入适量的( )。
A.食醋 B.食盐
C.料酒 D.味精
A
巩固扩展
例 某化学兴趣小组,在家中测得了石灰水、肥皂水、食醋及食盐水等溶液的pH,右图中箭头方向表示pH逐渐增大,则表示食盐水的是( )。
A.A处 B.B处 C.C处 D.D处
B
巩固扩展
例 不同物质的溶液的酸碱性不同,根据下表中pH的情况判断,下列说法中正确的是( )。
A. pH<7一定是酸的溶液 B. pH>7一定是酸的溶液
C. pH=7一定是酸的溶液 D. 盐的溶液可能显酸性、碱性或中性
? 盐酸 CuSO4溶液 NaCl溶液 水 Na2CO3溶液 NaOH溶液
pH <7 <7 =7 =7 >7 >7
D
课堂小结
1.中和反应:酸和碱作用生成盐和水的反应。
2.中和反应的实质:酸在水中解离出的H+和碱在水中解离出的OH-结合生成水。
3.盐:在水溶液中会解离产生金属离子和酸根离子的化合物。
4.中和反应在实际中的应用:用熟石灰改良酸性土壤和处理硫酸厂污水等。
5.溶液酸碱度:指溶液的酸碱性强弱程度,用pH表示酸碱度。酸性pH<7;中性pH=7;碱性pH>7。
第十单元 酸和碱
课题2 酸和碱的中和反应
课前准备
教学分析
1.理解掌握酸碱中和反应的概念,为复分解反应的认识作铺垫。
学习目标
2.初步体验酸碱指示剂在中和反应探究实验中的应用。
3.了解中和反应在工农业生产、生活等方面的应用。
4.理解溶液酸碱度的表示法——pH,以及溶液的酸碱度和pH的范围划分。
5.会用pH试纸测定溶液的酸碱度并熟练掌握相关的基本操作。
课前准备
教学分析
学习重点 理解中和反应的概念和反应特征;会用pH试纸测定溶液的酸碱度。
学习难点 酸碱指示剂与溶液的酸碱性的联系。
学习方法 联系实际、大胆猜测、认真观察、积极思考。
学具准备 稀盐酸、稀硫酸、氢氧化钠溶液、酚酞溶液、pH试纸、玻璃片、
玻璃棒等
教学内容
01
情景引入
02
互动新授
03
巩固扩展
04
课堂小结
点我喔
情景引入
在生活中,肥皂中含有氢氧化钠,用肥皂洗衣服之后手有干涩的感觉,用加了醋的清水浸泡一会儿,干涩感就会缓解。那么碱和酸之间到底发生了什么反应?
互动新授
(中和反应)
【实验10-8】
在烧杯中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液。
用滴管慢慢滴入稀盐酸,并不断搅拌溶液。
至溶液颜色恰好变成无色为止。
互动新授
(中和反应)
NaOH+HCl NaCl+H2O
碱 + 酸 → 盐 + 水
由金属离子和相应的酸根离子构成的化合物叫做盐。
酚酞遇碱才会变红,红色消失说明氢氧化钠参加了反应,变成中性或酸性物质了。
互动新授
(中和反应)
其他酸与碱也能发生类似的反应。例如
Ca(OH)2+2HCl CaCl2+2H2O
2NaOH+H2SO4 Na2SO4+2H2O
酸与碱作用生成盐和水的反应,叫做中和反应。
互动新授
(中和反应在实际中的应用)
(1)改变土壤的酸碱性——熟石灰改良酸性土壤
(2)处理工厂的废水——熟石灰中和处理硫酸厂污水
(3)用于医药——含有碱性物质的药物治疗胃酸过多
中和反应的应用
互动新授
(溶液酸碱度的表示法——pH)
溶液的酸碱度常用pH来表示,pH的范围通常是0~14。测定pH最简便的方法是使用pH试纸。
一种pH试纸和比色卡
互动新授
(溶液酸碱度的表示法——pH)
中性
酸性增强
碱性增强
【实验10-9】
在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH 。
互动新授
(溶液酸碱度的表示法——pH)
pH 酸碱性
稀盐酸 2 酸性
2
稀硫酸 1 酸性
1
稀氢氧化钠溶液 11 碱性
11
氯化钠溶液 7 中性
7
酸性溶液的pH<7;中性溶液的pH=7;碱性溶液的pH>7。
互动新授
(溶液酸碱度的表示法——pH)
【实验10-10】测定生活中一些物质的pH
身边一些物质的PH
互动新授
(溶液酸碱度的表示法——pH)
pH试纸注意事项
互动新授
(溶液酸碱度的表示法——pH)
化工生产中,许多反应必须在一定pH溶液里才能进行。
在农业生产中,农作物一般适宜在pH=7或接近7的土壤中生长。
互动新授
(溶液酸碱度的表示法——pH)
测定人体内或排出的液体的pH,可以了解人体的健康状况。
测定雨水的pH可以了解空气污染情况(正常雨水pH约为5.6,酸雨的pH<5.6)。
互动新授
(溶液酸碱度的表示法——pH)
(1)一般情况下,我们使用的洗发用品是酸性的还是碱性的?
(2)洗发时,一般是用过洗发剂再用护发剂,为什么?
探究
洗发水呈碱性,能够帮助头发的毛鳞片打开,彻底清洁的同时还能吸收营养;护发素呈酸性,能关闭头发的毛鳞片,使头发顺滑。
巩固扩展
例 制作馒头时,需加入面碱(主要含碳酸钠),如果面碱放多了,蒸出的馒头会发黄,且口感不好。为除去过多的面碱,做馒头时可加入适量的( )。
A.食醋 B.食盐
C.料酒 D.味精
A
巩固扩展
例 某化学兴趣小组,在家中测得了石灰水、肥皂水、食醋及食盐水等溶液的pH,右图中箭头方向表示pH逐渐增大,则表示食盐水的是( )。
A.A处 B.B处 C.C处 D.D处
B
巩固扩展
例 不同物质的溶液的酸碱性不同,根据下表中pH的情况判断,下列说法中正确的是( )。
A. pH<7一定是酸的溶液 B. pH>7一定是酸的溶液
C. pH=7一定是酸的溶液 D. 盐的溶液可能显酸性、碱性或中性
? 盐酸 CuSO4溶液 NaCl溶液 水 Na2CO3溶液 NaOH溶液
pH <7 <7 =7 =7 >7 >7
D
课堂小结
1.中和反应:酸和碱作用生成盐和水的反应。
2.中和反应的实质:酸在水中解离出的H+和碱在水中解离出的OH-结合生成水。
3.盐:在水溶液中会解离产生金属离子和酸根离子的化合物。
4.中和反应在实际中的应用:用熟石灰改良酸性土壤和处理硫酸厂污水等。
5.溶液酸碱度:指溶液的酸碱性强弱程度,用pH表示酸碱度。酸性pH<7;中性pH=7;碱性pH>7。
同课章节目录
