人教版九年级化学5.1质量守恒定律第一课时(共42张PPT)
文档属性
| 名称 | 人教版九年级化学5.1质量守恒定律第一课时(共42张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-21 11:15:12 | ||
图片预览









文档简介
(共42张PPT)
第五单元
课题1
质量守恒定律
(第一课时)
植物的生长与光合作用息息相关
参加化学反应的各物质质量总和与反应后生成的各物质质量总和之间有何关系?
提出问题
反应前、后各物质总质量是相等还是不等?
你的猜想: 。
● 猜想假设
用什么仪器可以来测出反应前后质量的变化?
天平
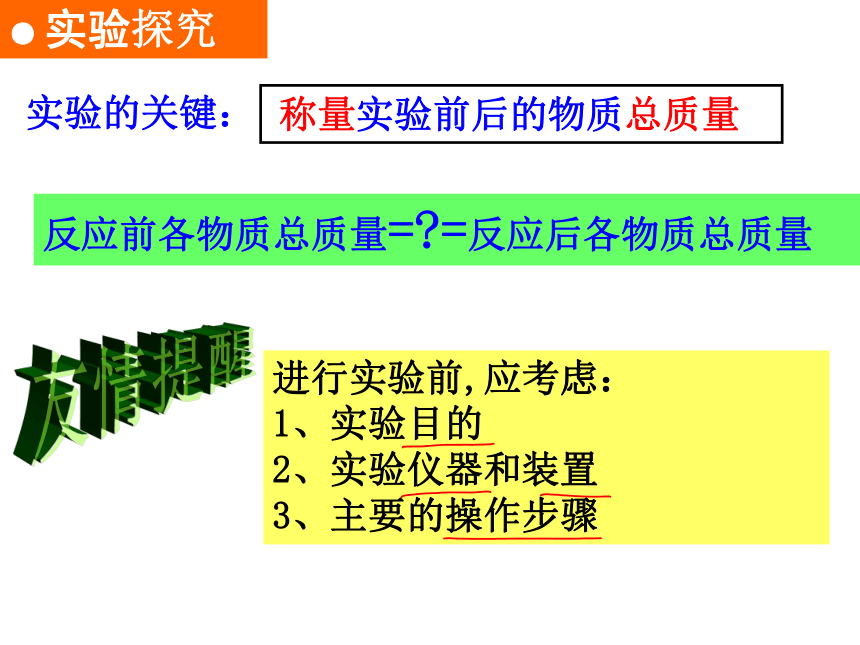
反应前各物质总质量=?=反应后各物质总质量
友情提醒
进行实验前,应考虑:
1、实验目的
2、实验仪器和装置
3、主要的操作步骤
● 实验探究
称量实验前后的物质总质量
实验的关键:
● 分组探究实验
实验1 铁钉跟硫酸铜溶液反应
Fe + CuSO4 Cu + FeSO4
实验原理:
实验步骤:
1、称量反应前物质的总质量,如图所示
2、把铁钉放到小试管中,观察现象;
3、称量反应后物质的总质量
溶液为蓝色
序号 实验现象(P94)
实验1 ① 铁钉表面有红色物质出现; 溶液由蓝色渐渐变成浅绿色。
② 反应后,天平平衡。
● 实验现象
Fe + CuSO4 Cu + FeSO4
溶液为浅绿色
反应前质量总和
反应后质量总和
铁的质量
硫酸铜的质量
生成铜的质量
生成硫酸亚铁质量
没反应铁的质量
烧杯的质量
水的质量
烧杯的质量
水的质量
=
=
参加反应的铁
没反应的铁
=
【数据分析】
参加反应的Fe和CuSO4的质量总和
等于生成的Cu和FeSO4的质量。
Fe + CuSO4 == Cu + FeSO4
硫酸铜的质量
生成铜的质量
生成硫酸亚铁质量
参加反应的铁
=
实验结论 参加反应的 和 质量之和
(大于/小于/等于)生成的
和 质量。
● 实验结论
Fe CuSO4
Cu FeSO4
等 于
Fe + CuSO4 Cu + FeSO4
实验步骤:
1、称量反应前物质的总质量
2、引燃白磷,观察现象
3、冷却后,称量反应后物质的
总质量,观察天平是否平衡
● 实验探究
实验2 白磷在密闭容器中燃烧
P + O2 P2O5
点燃
实验原理:
实验目的:探究反前物质的总质量和反应后物质的总质量
是否相等?
要求:认真观察实验现象,并在学案相应位置记录
序号 实验现象
实验1 ① 白磷燃烧,产生大量白烟;放热,气球先胀大,再变扁。
② 反应后,天平平衡。
● 实验现象
思考:
① 气球变化的原因
P + O2 P2O5
点燃
白磷燃烧放热,气体受热膨胀,压强增大,气球膨胀;消耗氧气,生成固体,压强变小,气球被压扁。
序号 实验现象
实验1 ① 白磷燃烧,产生大量白烟; 气球先胀大,最后压扁。
② 反应后,天平平衡。
● 实验现象
② 气球的作用
③ 细沙的作用
—— 防止锥形瓶受热不均而炸裂
—— 防止胶塞被冲开
思考:
① 气球变化的原因
P + O2 P2O5
点燃
氧气
五氧化二磷
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
=
白磷
剩余的磷
=
参加反应的磷
反应前质量总和
反应后质量总和
剩余的磷
=
【数据分析】
氧 气
五氧化二磷
参加反应的磷
参加反应的磷和氧气的质量总和
等于生成的五氧化二磷的质量。
P + O2 P2O5
点燃
实验结论 参加反应的 和 质量之和
(大于/小于/等于)生成的
质量。
● 实验结论
P + O2 P2O5
点燃
P O2
P2O5
等 于
● 实验结论
实验2
P + O2 P2O5
点燃
实验1
Fe + CuSO4 — Cu + FeSO4
实验1、2:
反应前后,天平平衡
化学反应前后物质的总质量相等。
一、质量守恒定律(教材94页)
无数实验证明:
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
● 获得规律
质量守恒定律只适用于化学变化
(适用于一切化学变化)
注意:
1、质量守恒定律只适用于化学变化
2、强调“参加”二字,未参加的不能计算在内
3、质量总和:包括反应物和生成物固、液、气
的质量总和
4、是质量守恒不是体积守恒
分子
原子
新分子
种类不变
数目不变
质量不变
质量守恒
原子
● 实验剖析 —— 微观分析
质量守恒的微观解释(实质):化学变化前后
原子数目
原子质量
原子种类
微 观
元素质量
元素种类
不 变
物质种类
分子种类
改变
宏 观
物质总质量
化学反应前后:
【质量守恒定律发展史】
1912年
英国 曼莱
精密测定
确认守恒
1774年
拉瓦锡
实验验证
揭示规律
1916年
爱因斯坦
质能守恒
敞口称量
质量增加
1673年
波义耳
密闭称量
质量相等
1756年
罗蒙诺索夫
【质量守恒定律发展史】
● 演示实验
实验步骤:
1、称量反应前的物质总质量,如图所示
2、将试管内的稀盐酸倒入小烧杯中,观察
实验现象
3、称量反应后的物质的总质量
实验3:碳酸钠粉末与稀盐酸反应
稀HCl
碳酸钠粉末
实验原理:
Na2CO3 + HCl NaCl + CO2 + H2O
序号 实验现象
实验3 ① 产生大量气泡。
② 反应后,天平不平衡。
● 实验现象
Na2CO3 + HCl NaCl + CO2 + H2O
是否还遵守质量守恒定律?
序号 实验现象
实验3 ① 产生大量气泡。
② 反应后,天平不平衡。
● 分析现象
Na2CO3 + HCl NaCl + CO2 + H2O
参加反应的碳酸钠Na2CO3和氯化氢HCl的总质量等于 反应生成的氯化钠NaCl 、CO2和H2O的总质量。
由于没称量到生成CO2 ,因此反应后天平不平衡。
● 实验现象
Na2CO3 + HCl NaCl + CO2 + H2O
如何解决上述问题,
让反应后天平依然平衡?
序号 实验现象(P94)
实验3 ① 产生大量气泡。
② 反应后,天平 。
不平衡
● 实验现象
碳酸钠粉末
稀盐酸
气球
密封
如用气球密封,一般不会考虑气球胀大时所受的空气浮力。
Na2CO3 + HCl NaCl + CO2 + H2O
序号 实验现象(P94)
实验3 ① 产生大量气泡。
② 反应后,天平 。
不平衡
● 实验现象
Na2CO3 + HCl NaCl + CO2 + H2O
密封
序号 实验现象(P94)
实验3 ① 产生大量气泡。
② 反应后,天平 。
不平衡
● 实验探究
问. 若在敞口装置中点燃镁条,你猜,反应后
物质的质量会 (偏大、偏小或不变)。
实验4 镁条在空气中燃烧
实验原理:
Mg + O2 MgO
点燃
● 实验探究
实验步骤 1. 称量反应前镁条、石棉网的质量总和。
2. 点燃镁条,置于石棉网上方,
(保护眼睛, 不要一直看)观察现象。
3. 将反应后燃烧产物与石棉网放到
天平上称量。
实验4 镁条在空气中燃烧
实验原理:
Mg + O2 MgO
点燃
● 实验现象
实验现象 ① 镁条燃烧,发出耀眼的白光,产生白烟,生成白色粉末。
② 反应后,天平 。
不平衡
实验4 镁条在空气中燃烧
实验原理:
Mg + O2 MgO
点燃
● 实验现象
【质量守恒】参加反应的镁和氧气的总质量等于
燃烧生成的氧化镁的质量。
【天平不平衡】原因:
① 没称量到 参加反应的O2,
② 有一部分 MgO 残留在坩埚钳上,
③ 有一部分 MgO 以白烟形式扩散到空气中。
实验现象 ① 镁条燃烧,发出耀眼的白光,产生白烟,生成白色粉末
② 反应后,天平 。
不平衡
实验4 镁条在空气中燃烧
实验原理:
Mg + O2 MgO
点燃
● 归纳小结
有气体参加、气体生成反应,验证质量守恒实验应在( )容器中进行!
密闭
碳酸钠粉末
稀盐酸
气球
气球
P + O2 P2O5
点燃
Na2CO3 + HCl
NaCl + CO2 + H2O
如用气球密封,气球所受的空气浮力可忽略不计
现有24.5克氯酸钾和 2克二氧化锰 的混合物,加热完全反应后得到氯化钾固体14.9克,则生成氧气的质量为 .
24.5 - 14.9 = 9.6
KClO3 KCl + O2
MnO2
△
质量守恒:mKClO3 = mKCl + mO2
mO2 = mKClO3 - mKCl
mO2 = m(KClO3+MnO2)- m(KCl+MnO2)
= 24.5-14.9=9.6
= (24.5+2)- 14.9 = 11.6
剩余固体14.9克
【课堂练习】
由此能推测石蜡含有哪些元素吗?
一定含 元素,可能含 元素
点燃
石蜡 + O2 CO2 + H2O
C、H O
C、H、O
O
三、质量守恒定律的应用
元素种类不变→
(一)定性分析: 元素种类 反应前后不变!
【元素只讲种类,不讲个数】
学案:P90
2、某纯净物稍加热就分解为氨气(NH3)、CO2
和 H2O。根据事实能得出的结论是( )
A. 它由四种元素组成
B. 它是氧化物
C. 它有水
D. 它很稳定
A
N、 H、 C、O
X NH3 + CO2 + H2O
(一)定性分析: 元素种类 反应前后不变!
【元素只讲种类,不讲个数】
3. 已知 A + B == C + D 反应中,生成物
C与D质量比为 1∶3,若反应物A与B在反应中共耗 2.4 g,则生成C g。
0.6
【课堂练习】
2.2g 6.6g 3.6g
(二)定量计算:元素质量 反应前后不变!
6.6g CO2中mC =
3.6g H2O中mH =
R元素的质量 = 化合物质量×R%
C
CO2
6.6g×
=
12
44
6.6g×
= 1.8g
2H
H2O
3.6g×
=
2
18
3.6g×
= 0.4g
X + O2 CO2 + H2O
点燃
求出X的化学式
练习:你认为下列说法对吗?为什么?
1、10g的水加热沸腾变成10g水蒸气,此变化
符合质量守恒定律
2、白磷的质量与氧气的质量总和等于生成的
五氧化二磷的质量
3、纸张燃烧后,剩下的灰烬比原来轻,此反
应不符合质量守恒定律
4、1L的氢气和8L的氧气反应后生成9L的水
【课堂练习】
1、在 A + B === C 的化学反应中,
4g 12g
则参加反应的B的质量是( )
A. 6g
B. 8g
C. 10g
D. 16g
B
【课堂练习】
1、不能用质量守恒定律解释的现象是( )
D. 蜡烛燃烧后,越来越短,最后消失
A
A. 湿衣服在阳光下晒干
B. 铁丝燃烧,其固体质量增加
C. 高锰酸钾受热后,固体质量减少
判断依据:
质量守恒定律适用于一切化学变化;
物理变化不适用!
第五单元
课题1
质量守恒定律
(第一课时)
植物的生长与光合作用息息相关
参加化学反应的各物质质量总和与反应后生成的各物质质量总和之间有何关系?
提出问题
反应前、后各物质总质量是相等还是不等?
你的猜想: 。
● 猜想假设
用什么仪器可以来测出反应前后质量的变化?
天平
反应前各物质总质量=?=反应后各物质总质量
友情提醒
进行实验前,应考虑:
1、实验目的
2、实验仪器和装置
3、主要的操作步骤
● 实验探究
称量实验前后的物质总质量
实验的关键:
● 分组探究实验
实验1 铁钉跟硫酸铜溶液反应
Fe + CuSO4 Cu + FeSO4
实验原理:
实验步骤:
1、称量反应前物质的总质量,如图所示
2、把铁钉放到小试管中,观察现象;
3、称量反应后物质的总质量
溶液为蓝色
序号 实验现象(P94)
实验1 ① 铁钉表面有红色物质出现; 溶液由蓝色渐渐变成浅绿色。
② 反应后,天平平衡。
● 实验现象
Fe + CuSO4 Cu + FeSO4
溶液为浅绿色
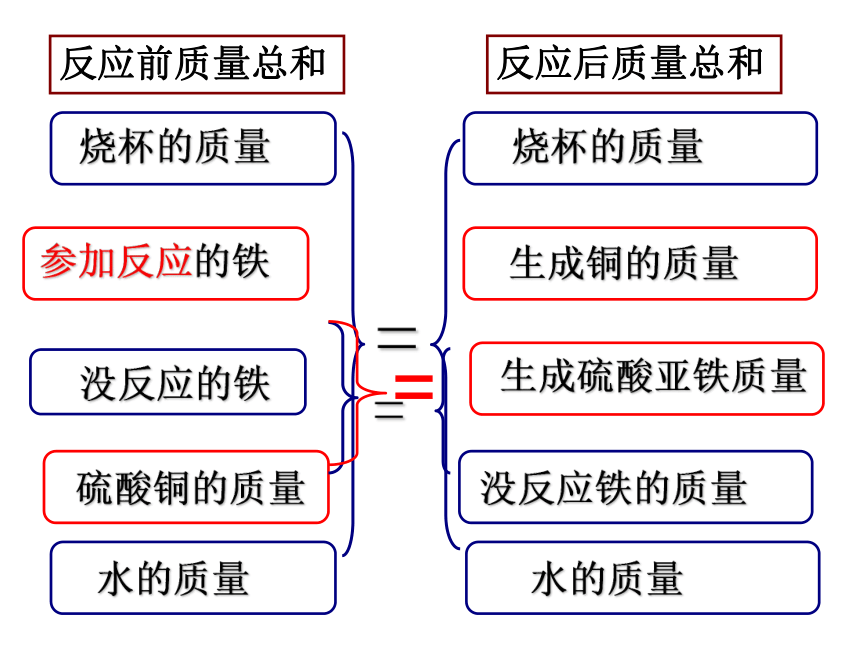
反应前质量总和
反应后质量总和
铁的质量
硫酸铜的质量
生成铜的质量
生成硫酸亚铁质量
没反应铁的质量
烧杯的质量
水的质量
烧杯的质量
水的质量
=
=
参加反应的铁
没反应的铁
=
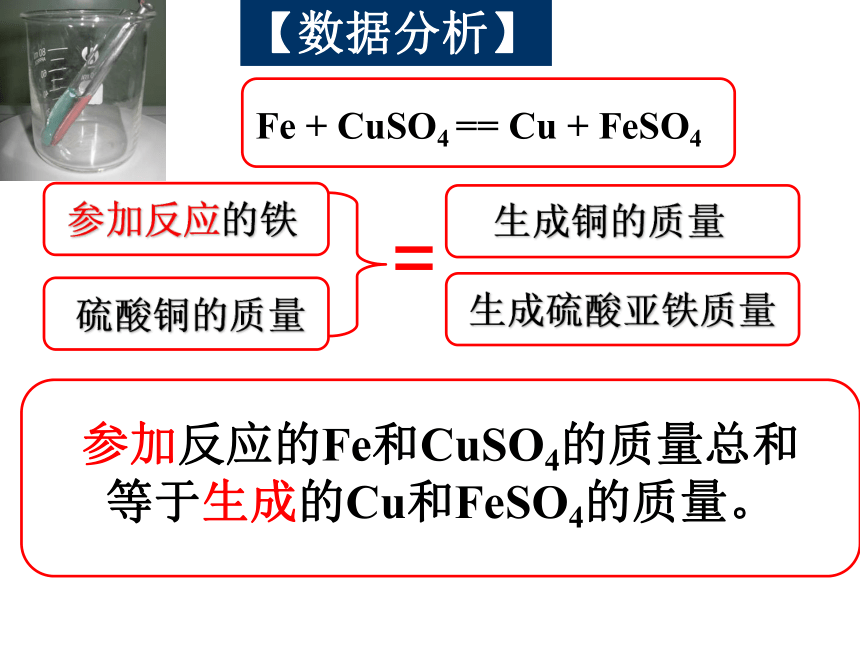
【数据分析】
参加反应的Fe和CuSO4的质量总和
等于生成的Cu和FeSO4的质量。
Fe + CuSO4 == Cu + FeSO4
硫酸铜的质量
生成铜的质量
生成硫酸亚铁质量
参加反应的铁
=
实验结论 参加反应的 和 质量之和
(大于/小于/等于)生成的
和 质量。
● 实验结论
Fe CuSO4
Cu FeSO4
等 于
Fe + CuSO4 Cu + FeSO4
实验步骤:
1、称量反应前物质的总质量
2、引燃白磷,观察现象
3、冷却后,称量反应后物质的
总质量,观察天平是否平衡
● 实验探究
实验2 白磷在密闭容器中燃烧
P + O2 P2O5
点燃
实验原理:
实验目的:探究反前物质的总质量和反应后物质的总质量
是否相等?
要求:认真观察实验现象,并在学案相应位置记录
序号 实验现象
实验1 ① 白磷燃烧,产生大量白烟;放热,气球先胀大,再变扁。
② 反应后,天平平衡。
● 实验现象
思考:
① 气球变化的原因
P + O2 P2O5
点燃
白磷燃烧放热,气体受热膨胀,压强增大,气球膨胀;消耗氧气,生成固体,压强变小,气球被压扁。
序号 实验现象
实验1 ① 白磷燃烧,产生大量白烟; 气球先胀大,最后压扁。
② 反应后,天平平衡。
● 实验现象
② 气球的作用
③ 细沙的作用
—— 防止锥形瓶受热不均而炸裂
—— 防止胶塞被冲开
思考:
① 气球变化的原因
P + O2 P2O5
点燃
氧气
五氧化二磷
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
锥形瓶(及细沙)
单孔橡皮塞
(连气球和玻璃管)
氮气、稀有气体等
=
白磷
剩余的磷
=
参加反应的磷
反应前质量总和
反应后质量总和
剩余的磷
=
【数据分析】
氧 气
五氧化二磷
参加反应的磷
参加反应的磷和氧气的质量总和
等于生成的五氧化二磷的质量。
P + O2 P2O5
点燃
实验结论 参加反应的 和 质量之和
(大于/小于/等于)生成的
质量。
● 实验结论
P + O2 P2O5
点燃
P O2
P2O5
等 于
● 实验结论
实验2
P + O2 P2O5
点燃
实验1
Fe + CuSO4 — Cu + FeSO4
实验1、2:
反应前后,天平平衡
化学反应前后物质的总质量相等。
一、质量守恒定律(教材94页)
无数实验证明:
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
● 获得规律
质量守恒定律只适用于化学变化
(适用于一切化学变化)
注意:
1、质量守恒定律只适用于化学变化
2、强调“参加”二字,未参加的不能计算在内
3、质量总和:包括反应物和生成物固、液、气
的质量总和
4、是质量守恒不是体积守恒
分子
原子
新分子
种类不变
数目不变
质量不变
质量守恒
原子
● 实验剖析 —— 微观分析
质量守恒的微观解释(实质):化学变化前后
原子数目
原子质量
原子种类
微 观
元素质量
元素种类
不 变
物质种类
分子种类
改变
宏 观
物质总质量
化学反应前后:
【质量守恒定律发展史】
1912年
英国 曼莱
精密测定
确认守恒
1774年
拉瓦锡
实验验证
揭示规律
1916年
爱因斯坦
质能守恒
敞口称量
质量增加
1673年
波义耳
密闭称量
质量相等
1756年
罗蒙诺索夫
【质量守恒定律发展史】
● 演示实验
实验步骤:
1、称量反应前的物质总质量,如图所示
2、将试管内的稀盐酸倒入小烧杯中,观察
实验现象
3、称量反应后的物质的总质量
实验3:碳酸钠粉末与稀盐酸反应
稀HCl
碳酸钠粉末
实验原理:
Na2CO3 + HCl NaCl + CO2 + H2O
序号 实验现象
实验3 ① 产生大量气泡。
② 反应后,天平不平衡。
● 实验现象
Na2CO3 + HCl NaCl + CO2 + H2O
是否还遵守质量守恒定律?
序号 实验现象
实验3 ① 产生大量气泡。
② 反应后,天平不平衡。
● 分析现象
Na2CO3 + HCl NaCl + CO2 + H2O
参加反应的碳酸钠Na2CO3和氯化氢HCl的总质量等于 反应生成的氯化钠NaCl 、CO2和H2O的总质量。
由于没称量到生成CO2 ,因此反应后天平不平衡。
● 实验现象
Na2CO3 + HCl NaCl + CO2 + H2O
如何解决上述问题,
让反应后天平依然平衡?
序号 实验现象(P94)
实验3 ① 产生大量气泡。
② 反应后,天平 。
不平衡
● 实验现象
碳酸钠粉末
稀盐酸
气球
密封
如用气球密封,一般不会考虑气球胀大时所受的空气浮力。
Na2CO3 + HCl NaCl + CO2 + H2O
序号 实验现象(P94)
实验3 ① 产生大量气泡。
② 反应后,天平 。
不平衡
● 实验现象
Na2CO3 + HCl NaCl + CO2 + H2O
密封
序号 实验现象(P94)
实验3 ① 产生大量气泡。
② 反应后,天平 。
不平衡
● 实验探究
问. 若在敞口装置中点燃镁条,你猜,反应后
物质的质量会 (偏大、偏小或不变)。
实验4 镁条在空气中燃烧
实验原理:
Mg + O2 MgO
点燃
● 实验探究
实验步骤 1. 称量反应前镁条、石棉网的质量总和。
2. 点燃镁条,置于石棉网上方,
(保护眼睛, 不要一直看)观察现象。
3. 将反应后燃烧产物与石棉网放到
天平上称量。
实验4 镁条在空气中燃烧
实验原理:
Mg + O2 MgO
点燃
● 实验现象
实验现象 ① 镁条燃烧,发出耀眼的白光,产生白烟,生成白色粉末。
② 反应后,天平 。
不平衡
实验4 镁条在空气中燃烧
实验原理:
Mg + O2 MgO
点燃
● 实验现象
【质量守恒】参加反应的镁和氧气的总质量等于
燃烧生成的氧化镁的质量。
【天平不平衡】原因:
① 没称量到 参加反应的O2,
② 有一部分 MgO 残留在坩埚钳上,
③ 有一部分 MgO 以白烟形式扩散到空气中。
实验现象 ① 镁条燃烧,发出耀眼的白光,产生白烟,生成白色粉末
② 反应后,天平 。
不平衡
实验4 镁条在空气中燃烧
实验原理:
Mg + O2 MgO
点燃
● 归纳小结
有气体参加、气体生成反应,验证质量守恒实验应在( )容器中进行!
密闭
碳酸钠粉末
稀盐酸
气球
气球
P + O2 P2O5
点燃
Na2CO3 + HCl
NaCl + CO2 + H2O
如用气球密封,气球所受的空气浮力可忽略不计
现有24.5克氯酸钾和 2克二氧化锰 的混合物,加热完全反应后得到氯化钾固体14.9克,则生成氧气的质量为 .
24.5 - 14.9 = 9.6
KClO3 KCl + O2
MnO2
△
质量守恒:mKClO3 = mKCl + mO2
mO2 = mKClO3 - mKCl
mO2 = m(KClO3+MnO2)- m(KCl+MnO2)
= 24.5-14.9=9.6
= (24.5+2)- 14.9 = 11.6
剩余固体14.9克
【课堂练习】
由此能推测石蜡含有哪些元素吗?
一定含 元素,可能含 元素
点燃
石蜡 + O2 CO2 + H2O
C、H O
C、H、O
O
三、质量守恒定律的应用
元素种类不变→
(一)定性分析: 元素种类 反应前后不变!
【元素只讲种类,不讲个数】
学案:P90
2、某纯净物稍加热就分解为氨气(NH3)、CO2
和 H2O。根据事实能得出的结论是( )
A. 它由四种元素组成
B. 它是氧化物
C. 它有水
D. 它很稳定
A
N、 H、 C、O
X NH3 + CO2 + H2O
(一)定性分析: 元素种类 反应前后不变!
【元素只讲种类,不讲个数】
3. 已知 A + B == C + D 反应中,生成物
C与D质量比为 1∶3,若反应物A与B在反应中共耗 2.4 g,则生成C g。
0.6
【课堂练习】
2.2g 6.6g 3.6g
(二)定量计算:元素质量 反应前后不变!
6.6g CO2中mC =
3.6g H2O中mH =
R元素的质量 = 化合物质量×R%
C
CO2
6.6g×
=
12
44
6.6g×
= 1.8g
2H
H2O
3.6g×
=
2
18
3.6g×
= 0.4g
X + O2 CO2 + H2O
点燃
求出X的化学式
练习:你认为下列说法对吗?为什么?
1、10g的水加热沸腾变成10g水蒸气,此变化
符合质量守恒定律
2、白磷的质量与氧气的质量总和等于生成的
五氧化二磷的质量
3、纸张燃烧后,剩下的灰烬比原来轻,此反
应不符合质量守恒定律
4、1L的氢气和8L的氧气反应后生成9L的水
【课堂练习】
1、在 A + B === C 的化学反应中,
4g 12g
则参加反应的B的质量是( )
A. 6g
B. 8g
C. 10g
D. 16g
B
【课堂练习】
1、不能用质量守恒定律解释的现象是( )
D. 蜡烛燃烧后,越来越短,最后消失
A
A. 湿衣服在阳光下晒干
B. 铁丝燃烧,其固体质量增加
C. 高锰酸钾受热后,固体质量减少
判断依据:
质量守恒定律适用于一切化学变化;
物理变化不适用!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
