鲁教版初中化学九年级下册第八单元《海水中的化学》测试题(含答案)
文档属性
| 名称 | 鲁教版初中化学九年级下册第八单元《海水中的化学》测试题(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 177.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-21 00:00:00 | ||
图片预览


文档简介
第八单元《海水中的化学》测试题
一、单选题(每小题只有一个正确答案)
1.下列变化中是物理变化的是( )
A.用鲜牛奶和乳酸菌制酸牛奶 B.用熟石灰改良酸性土壤
C.用稀有气体制电光源 D.用面粉和小苏打发酵做馒头
2.下列反应中既属于氧化反应又属于化合反应的是( )
A.过氧化氢水 + 氧气
B.碳 + 氧气二氧化碳
C.石蜡 + 氧气二氧化碳 + 水
D.碳酸钙 + 盐酸氯化钙 + 水 + 二氧化碳
3.有一种“即食即热型快餐”适合外出旅行时使用,内层是用铝箔包裹并已加工好的真空包装食品,外层有分别包装的两包化学物质,使用时拉动预留在外的拉线,可使外层两包化学物质发生反应,此时便可对内层食品进行加热。这两包化学物质的最佳选择是 ( )
A.浓硫酸和水 B.生石灰和水 C.石灰石和水 D.氯化钠和水
4.粗盐提纯的部分操作如图所示,错误的是( )
A.称量B.溶解 C.过滤D.蒸发
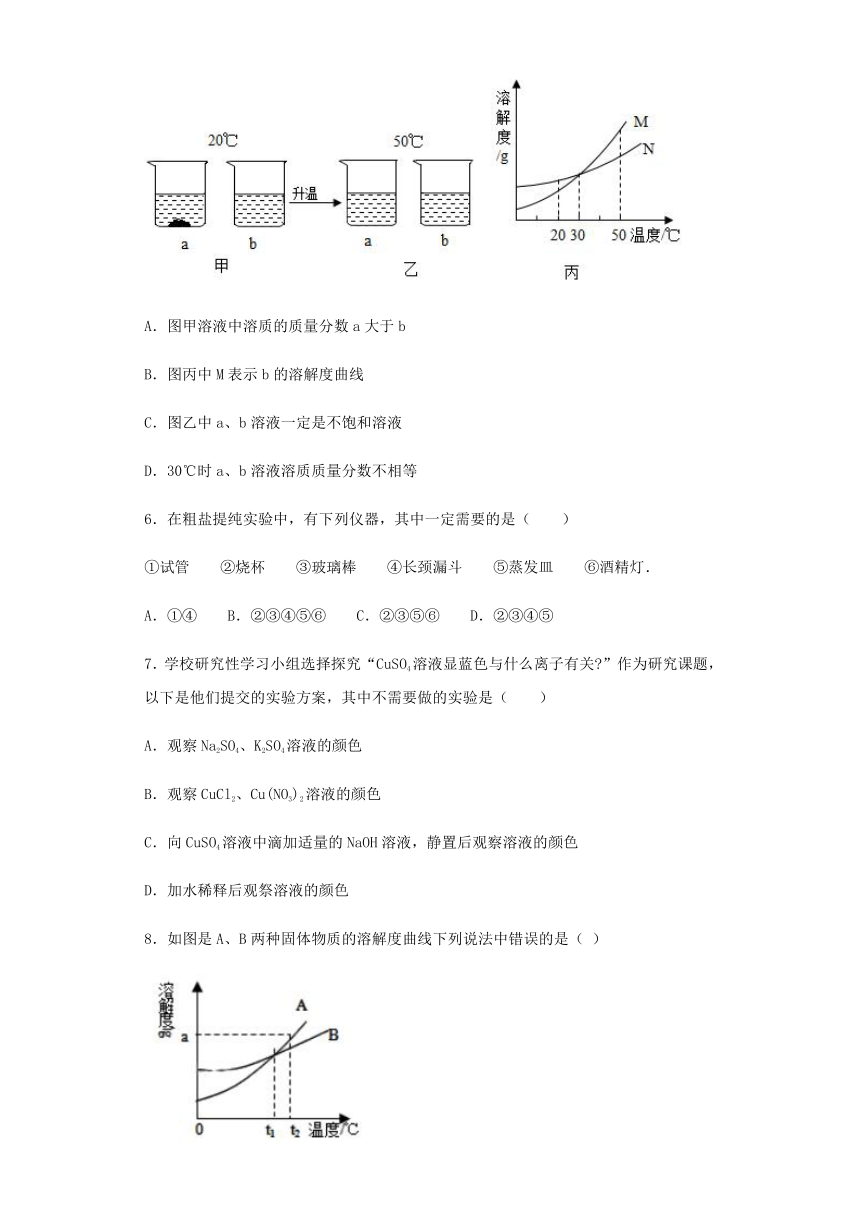
5.在20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是( )
A.图甲溶液中溶质的质量分数a大于b
B.图丙中M表示b的溶解度曲线
C.图乙中a、b溶液一定是不饱和溶液
D.30℃时a、b溶液溶质质量分数不相等
6.在粗盐提纯实验中,有下列仪器,其中一定需要的是( )
①试管 ②烧杯 ③玻璃棒 ④长颈漏斗 ⑤蒸发皿 ⑥酒精灯.
A.①④ B.②③④⑤⑥ C.②③⑤⑥ D.②③④⑤
7.学校研究性学习小组选择探究“CuSO4溶液显蓝色与什么离子有关?”作为研究课题,以下是他们提交的实验方案,其中不需要做的实验是( )
A.观察Na2SO4、K2SO4溶液的颜色
B.观察CuCl2、Cu(NO3)2溶液的颜色
C.向CuSO4溶液中滴加适量的NaOH溶液,静置后观察溶液的颜色
D.加水稀释后观祭溶液的颜色
8.如图是A、B两种固体物质的溶解度曲线下列说法中错误的是( )
A.t1℃时A、B的溶解度相等
B.t2℃时,A的饱和溶液中溶质的质量分数为×100%
C.A、B的溶解度都随温度升高而增大
D.将t2℃时B的饱和溶液降温到t1℃时,溶液变稀了
9.下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,能将它们一一鉴别的是( )
A.Na2CO3、HCl、BaCl2、NaCl B.Na2CO3、NaCl、Na2SO4、Ba(OH)2
C.H2SO4、NaOH、BaCl2、CuCl2 D.NaOH、Ba(NO3)2、NaCl、MgSO4
10.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.将40℃甲的饱和溶液降温至20℃,溶液质量不变
C.40℃时,分别在100g水中各加入30g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液
D.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数
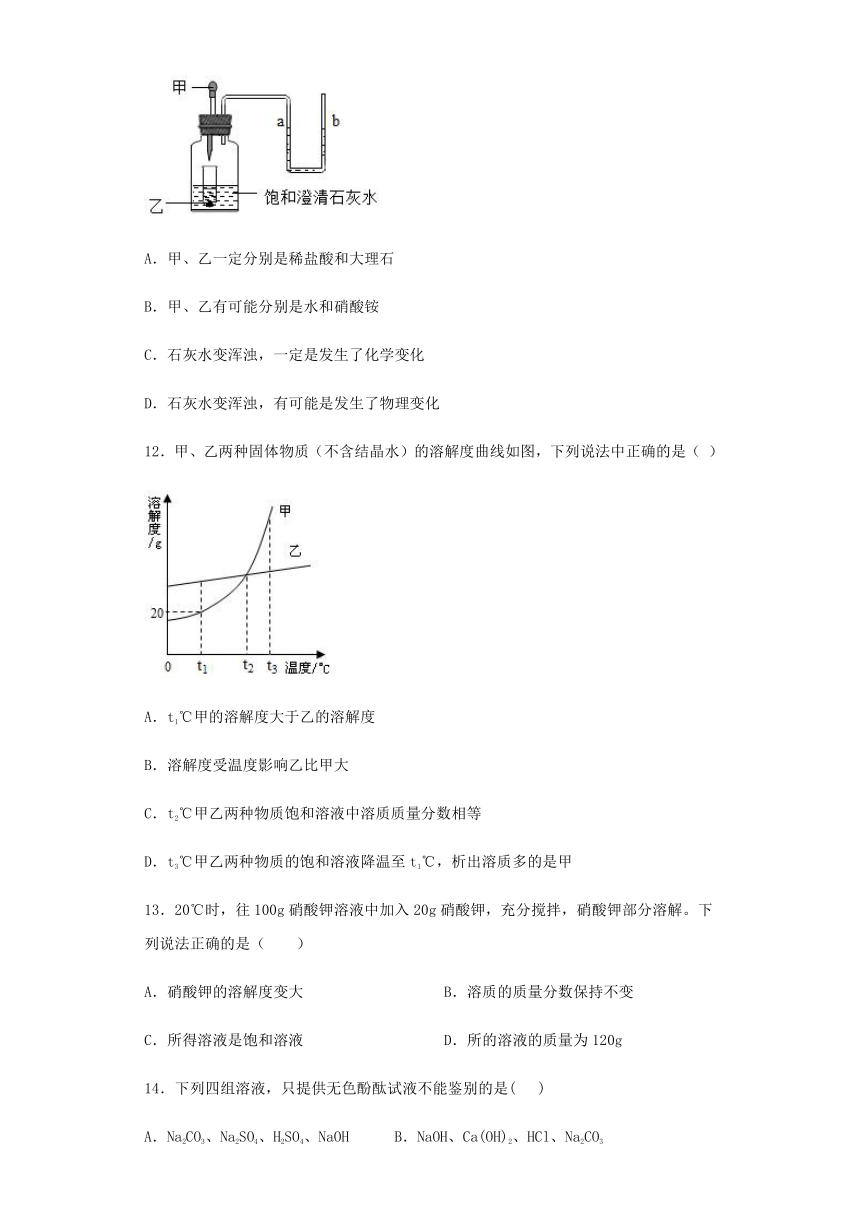
11.如图,小试管中盛放着固体乙(足量),滴管中有液体甲,广口瓶中有少量饱和的澄清石灰水(试管底部浸没在澄清石灰水中)。当把甲溶液滴加到乙中,过一会儿可看到石灰水变浑浊了,U形管中的a液面降低、b液面升高了。根据以上现象请你分析下列说法正确的是( )
A.甲、乙一定分别是稀盐酸和大理石
B.甲、乙有可能分别是水和硝酸铵
C.石灰水变浑浊,一定是发生了化学变化
D.石灰水变浑浊,有可能是发生了物理变化
12.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图,下列说法中正确的是( )
A.t1℃甲的溶解度大于乙的溶解度
B.溶解度受温度影响乙比甲大
C.t2℃甲乙两种物质饱和溶液中溶质质量分数相等
D.t3℃甲乙两种物质的饱和溶液降温至t1℃,析出溶质多的是甲
13.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。下列说法正确的是( )
A.硝酸钾的溶解度变大 B.溶质的质量分数保持不变
C.所得溶液是饱和溶液 D.所的溶液的质量为120g
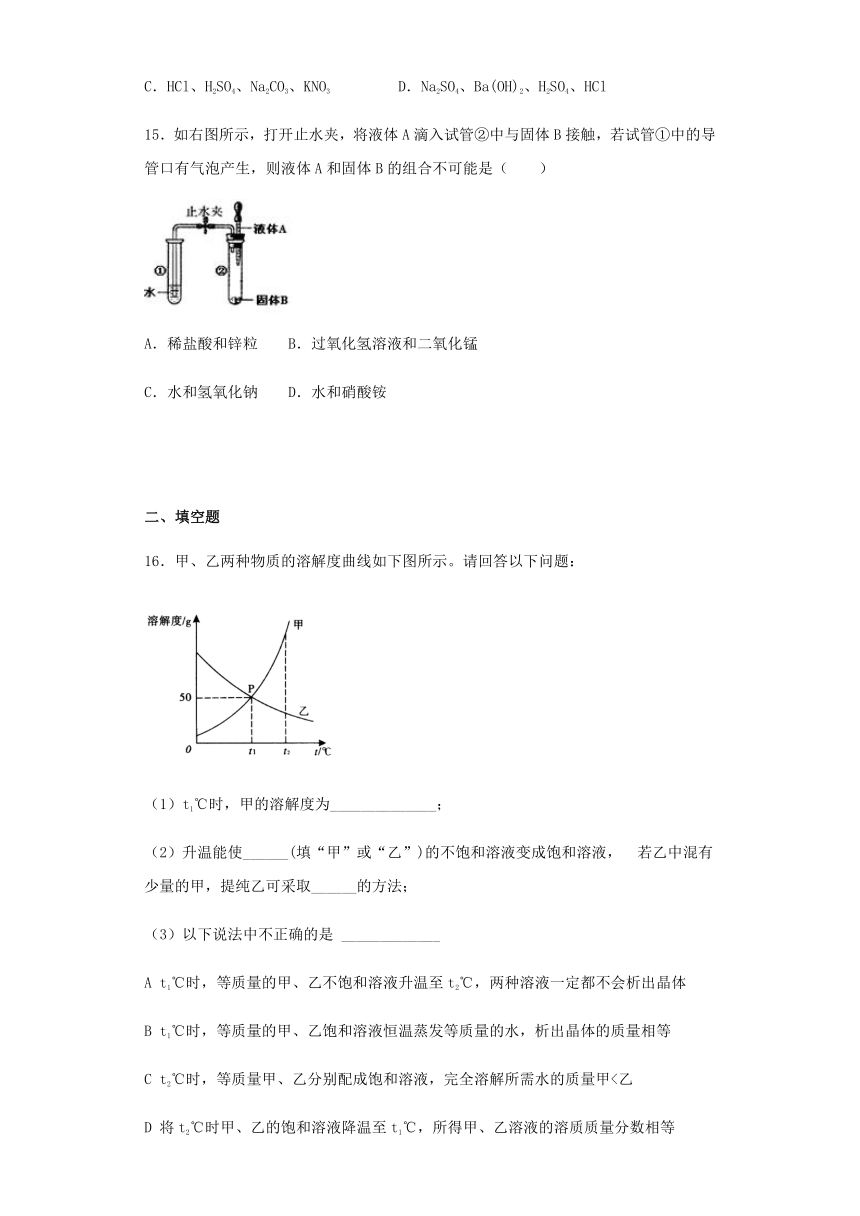
14.下列四组溶液,只提供无色酚酞试液不能鉴别的是( )
A.Na2CO3、Na2SO4、H2SO4、NaOH B.NaOH、Ca(OH)2、HCl、Na2CO3
C.HCl、H2SO4、Na2CO3、KNO3 D.Na2SO4、Ba(OH)2、H2SO4、HCl
15.如右图所示,打开止水夹,将液体A滴入试管②中与固体B接触,若试管①中的导管口有气泡产生,则液体A和固体B的组合不可能是( )
A.稀盐酸和锌粒 B.过氧化氢溶液和二氧化锰
C.水和氢氧化钠 D.水和硝酸铵
二、填空题
16.甲、乙两种物质的溶解度曲线如下图所示。请回答以下问题:
(1)t1℃时,甲的溶解度为______________;
(2)升温能使______(填“甲”或“乙”)的不饱和溶液变成饱和溶液, 若乙中混有少量的甲,提纯乙可采取______的方法;
(3)以下说法中不正确的是 _____________
A t1℃时,等质量的甲、乙不饱和溶液升温至t2℃,两种溶液一定都不会析出晶体
B t1℃时,等质量的甲、乙饱和溶液恒温蒸发等质量的水,析出晶体的质量相等
C t2℃时,等质量甲、乙分别配成饱和溶液,完全溶解所需水的质量甲<乙
D 将t2℃时甲、乙的饱和溶液降温至t1℃,所得甲、乙溶液的溶质质量分数相等
17.用化学知识回答下列问题:
(1)在H、O、C、S、Ca、Na六种元素中,选择适当的元素,组成符合下列要求的物质,将其化学式填入空格中。
可用于人工降雨的氧化物________;可用于金属表面除锈的酸_________;
可改良酸性土壤的碱____________;可作干燥剂的氧化物___________。
(2)澄清的饱和石灰水升高温度会变浑浊,原是__________;
澄清的饱和石灰水露置空气中变浑浊,原因是(方程式表示)_________。
(3)小华在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,老师告知是氢氧化钠、硫酸铜、氯化钠、碳酸钙中的一种。小华思考片刻后,认为取少量白色固体放入水中就能确定其成分,她的理由是:(以下用化学式填写)
若不溶于水,则是_________;若溶于水形成蓝色溶液,则是__________;
若溶于水溶液温度升高,则是_____;若溶于水无明显现象且溶液温度基本不变,则是 ______。
18.高纯度的单质硅是信息产业的核心材料,没有硅就没有你喜欢的计算机。请用你学过的知识回答下列问题:
(1)地壳中含有大量的硅元素,它的含量仅次于_______元素。
(2)SiO2是沙子的主要成分,工业上制取粗硅的化学方程式为:SiO2+2CSi+2R,
R的化学式为__________;该化学反应的基本类型是_______________。
(3)硅在O2中燃烧生成SiO2,并放出大量的热,有科学家正研究将硅作为新能源。与化石能源相比较,硅燃烧不排放CO2,因而有助于解决的环境问题是______________。
19.水是生命之源,人类的生产、生活都离不开水。
(1)自然界中的水含有许多可溶性和不溶性杂质。长期饮用硬水可能会引起体内结石,生活中常用 来区分软水与硬水,常用 的方法来降低水的硬度。在水的净化过程中,除去水中不溶性的固体杂质,其实验操作方法称为 。
(2)水是常用的溶剂,配制下列溶液时,以水做溶剂的是 (填序号)。
A.食盐 B.医用碘酒 C.高锰酸钾 D.植物油
(3)如图是甲、乙两种固体物质的溶解度曲线。40℃时,甲物质与乙物质的溶解度是 ;80℃时,甲物质饱和溶液中溶质的质量分数为 。
(4)世博园区内用“活性炭+超滤膜+紫外线”组合工艺获得直饮水。其中活性炭起________作用;化合物X是一种新型的自来水消毒剂,工业上制取X 的化学方程式为:Cl2 + 2 NaClO2 ="=" 2 NaCl + 2 X,则X的化学式为 ;能够充分说明水的组成的化学反应方程式为 。
20.甲、乙、丙三种固体的溶解度曲线如图所示,据图回答:
(1)30℃时,丙的溶解度是________;
(2)50℃时,在100g水中放入50g乙物质,充分搅拌后所得溶液的溶质质量分数为________。(计算结果保留至0.1%);
(3)若将20℃时甲、乙、丙三种物质的饱和溶液升温至40℃(不考虑水的蒸发),可析出晶体的是________;
(4)将50℃时甲、乙、丙三种物质的饱和溶液均降温至10℃,所得溶液的溶质质量分数从大到小的顺序是________。
三、推断题
21.实验室现有四种失去标签的白色固体,分别为无水硫酸铜、硝酸钡、氯化钡、氢氧化钠中的一种。为区分它们进行了下列实验,请回答问题。
(1)步骤Ⅰ:将这四种白色固体分别编号为A、B、C、D。
步骤Ⅱ:取少量上述四种白色固体样品分别放入四支试管中,加入足量蒸馏水,振荡,固体全部溶解,且C溶液呈蓝色,则C是_____(写化学式,下同)。
(2)步骤Ⅲ:取少量A、B、D的溶液分别放入三支试管中,向三种溶液中各加入适量C溶液,装有B溶液的试管中产生蓝色沉淀,该反应的化学方程式为_____。
(3)步骤Ⅳ:为进一步区分A和D,另有两支试管分别取少量A溶液和D溶液,加入适量_____溶液。
22.有一包粉末,已知由BaSO4、Cu(NO3)2、BaCl2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行以下实验:
(1)取一定量粉末,加足量水搅拌后过滤,得有色沉淀甲和无色溶液A,原粉末中一定含_____;
(2)向甲中加足量稀盐酸,固体全部消失并得到蓝色溶液,原粉末中一定不含_______;
(3)向A中加入过量BaCl2溶液,出现白色沉淀,过滤,取滤液少量滴加酚酞试液,试液变红。原粉末中一定还不含_______,无色溶液A至少含______种溶质(填数字);
(4)另取步骤③滤液加入过量稀硝酸和硝酸银,出现白色沉淀,则原粉末中_______(选填“一定”或“可能”)含有NaCl。
四、实验题
(1)实验1:所得溶液的溶质是_____;一定为饱和溶液的是_____(填序号).
(2)实验2:观察到碘几乎不溶,高锰酸钾全部溶解,该实验得出的结论是_____.
24.氯化钠是生活必需品,也是重要的化工原料.提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作③中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是_______(填序号)。
(2)操作④中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到___________
等仪器.该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外,你认为还可采取_______________________________等措施。
(3)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是___________(填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上
五、计算题
25.称取BaCl2和NaCl的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示。试回答下列问题:
(1) Na2SO4和NaCl中均含有钠元素,钠元素位于元素周期表第_____周期。
(2) 完全反应后生成BaSO4沉淀_____g。
(3) 恰好完全反应时消耗Na2SO4溶液质量是_____g。
(4)恰好完全反应时所得溶液中溶质的质量分数是多少? _____(精确到0.1%)(写出计算过程)
26.我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。
(1)主产品Na2CO3的俗名是_____,副产品氯化铵中阳离子符号为_____。
(2)在实际生产中,产品Na2CO3中常混有少量的NaCl,现有样品11.0g,将其放入干净的烧杯中,向烧杯中逐滴加入溶质质量分数为7.3%的稀盐酸,反应后烧杯中物质的质量与滴入稀盐酸的质量关系如图所示。
①图中A点表示_____,B点的溶质为_____。
②计算样品中Na2CO3的质量分数_____(计算结果精确至0.1%)
参考答案
1.C 2.B 3.B 4.C 5.C 6.C 7.D 8.B 9.AC 10.C 11.D 12.C 13.C 14.C 15.D 16.50g 乙 升温 AD
17.CO2 H2SO4 Ca(OH)2 CaO Ca(OH)2 溶解度随温度的升高而降低 CO2+Ca(OH)2=CaCO3+H2O CaCO3 CuSO4 NaOH NaCl
18. 氧 CO 置换反应 温室效应
19.(1)肥皂水;蒸馏;过滤(2)AC
(3)40g;50%(4)吸附;ClO2
2H2O2H2↑+O2↑或2H2+O22H2O
20.10g 28.6% 丙 乙、甲、丙
21.CuSO4 AgNO3
22.Cu(NO3)2 NaOH BaSO4 BaCl2 3 可能
23.氯化钠; B; 高锰酸钾的溶解性比碘的大
24.(1)D (2)蒸发皿,来回移动酒精灯 (3)A、B、D
25.三 23.3 142 9.3%
26.纯碱或苏打 NH4+ Na2CO3与盐酸或HCl恰好完全反应 NaCl、HCl 96.4%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
