人教版九年级化学第9单元课题3溶液的浓度 (共73张PPT)
文档属性
| 名称 | 人教版九年级化学第9单元课题3溶液的浓度 (共73张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-22 10:20:09 | ||
图片预览









文档简介
(共73张PPT)
溶液的浓度
第九单元 课题3
第1课时
第2课时
教学目标
1、溶质质量分数基本公式及应用
3、溶液的稀释
2、饱和溶液溶质质量分数的计算
4、发生化学反应的溶液的溶质质量分
数的计算
5、配制一定质量分数的溶液
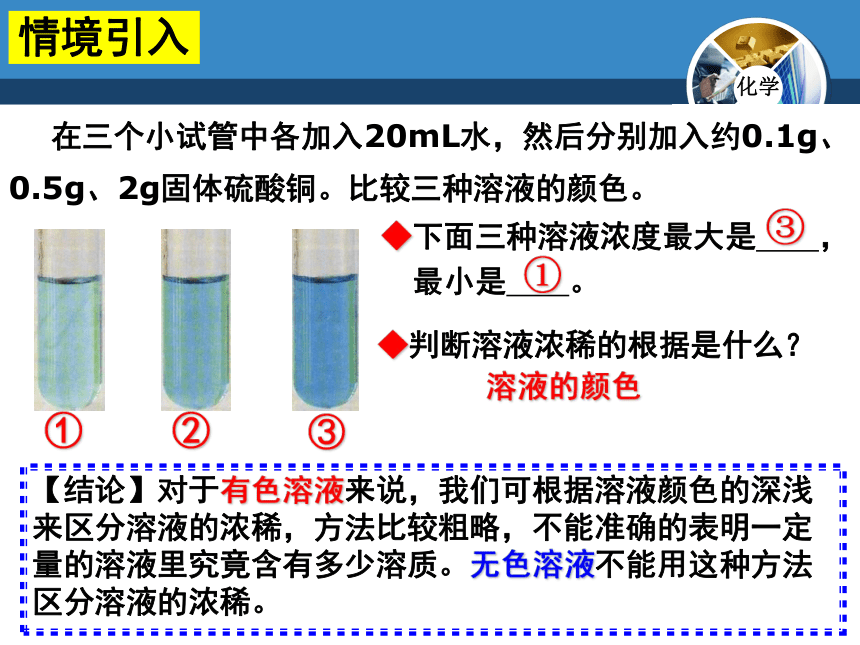
情境引入
◆判断溶液浓稀的根据是什么?
①
②
③
◆下面三种溶液浓度最大是 ,
最小是 。
③
①
【结论】对于有色溶液来说,我们可根据溶液颜色的深浅来区分溶液的浓稀,方法比较粗略,不能准确的表明一定量的溶液里究竟含有多少溶质。无色溶液不能用这种方法区分溶液的浓稀。
在三个小试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。
溶液的颜色
飞机喷洒农药
喷洒药水
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木.
在实际应用中我们常常要准确知道一定量的溶液中所含溶质的量。
实际应用
溶液的浓度
某物质含量为6mg/100ml
(见于某酱油商标)
溶液浓度的表示方法
100 ml中有某物质多少毫克(多见于各种饮料)
酒精度为54%(V/V)
(多见于饮用酒)
某物质含量为36%。
质量分数
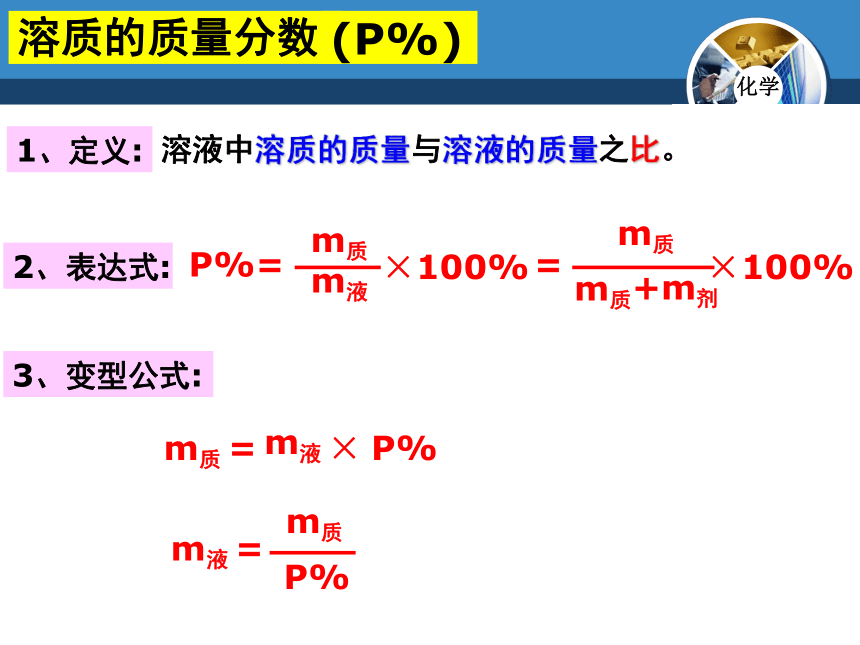
溶质的质量分数
(P%)
1、定义:
2、表达式:
3、变型公式:
溶液中溶质的质量与溶液的质量之比。
P%=
×100%
m质
m液
=
×100%
m质
m质
+m剂
m质
=
m液
× P%
m液
=
P%
m质
①
②
③
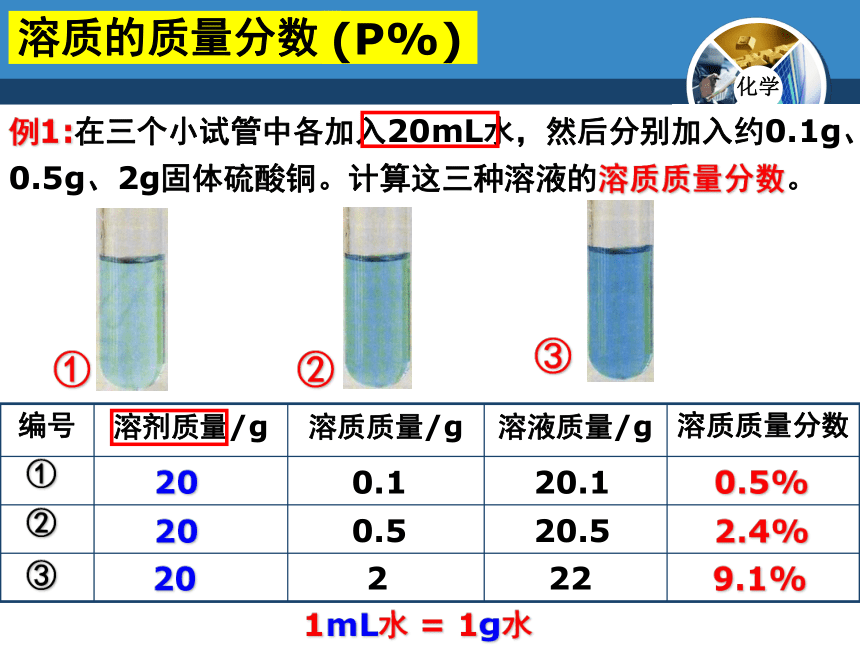
例1:在三个小试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。计算这三种溶液的溶质质量分数。
溶质的质量分数
(P%)
①
②
③
20
1mL水 = 1g水
0.1
20.1
0.5%
20
0.5
20.5
2.4%
20
2
22
9.1%
编号 溶剂质量/g 溶质质量/g 溶液质量/g 溶质质量分数
溶质的质量分数
(P%)
解:
=
m液
150Kg,
例题2:在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配置150kg这种溶液,需要氯化钠和水的质量各是多少?
已知:
=
16%
P%
求:
=
m质
?,
=
m剂
?,
因为:
m质
=
m液
× P%
所以:
m质
=
150Kg
× 16%
= 24Kg
又因为:
m液
=
m质
+ m剂
所以:
m液
=
-m质
m剂
= 160-24
= 126Kg
饱和
S
100
=
m质
m剂
S
100
=
40—8.4
100
S = 31.6
31.6
g
随堂练习
1、在20℃时,将40g硝酸钾固体加入100g水中,充分搅拌后,仍有8.4g硝酸钾固体未溶解。请填写下列空白:
(1)所得溶液是20℃时硝酸钾的 溶液(填“饱和”或“不饱和”);
(2)20℃时硝酸钾的溶解度为 ;
(3)所得溶液中硝酸钾的质量分数为 。
P%=
×100%
m质
m液
=
×100%
40—8.4
100+(40—8.4)
≈ 24%
24%
1、在20℃时,将40g硝酸钾固体加入100g水中,充分搅拌后,仍有8.4g硝酸钾固体未溶解。请填写下列空白:
(3)所得溶液中硝酸钾的质量分数为 。
随堂练习
35g KCl溶液
溶质:
溶剂:
KCl
H2O
7g
(35—7)g
28g
P%=
×100%
m质
m液
=
×100%
7
35
= 20%
随堂练习
2、某温度时,蒸干35g氯化钾溶液,得到7g氯化钾,求该溶液中溶质的质量分数。
m质
=
m液
×P%
=
(ρ·v)
×P%
= (500mL×1.1g/cm3)
×10%
= 55g
m剂
=
m液
— m质
= (500mL×1.1g/cm3)—55g
= 495g
补充练习
随堂练习
4、配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1 g/cm3),需要氢氧化钠和水的质量各是多少?
饱和溶液的溶质质量分数的计算
例题3:已知氯化钠在20℃时溶解度是36g,计算150g饱和氯化钠溶液的质量分数。
20℃
36g
100g
136g
100g水
36g氯化钠
饱和
80g溶液
P%=
×100%
m质
m液
=
×100%
36
36
+100
26.5%
≈
饱和
26.5%
50g溶液
饱和
26.5%
150g溶液
饱和
26.5%
温度 溶质质量 溶剂质量 溶液质量
饱和溶液的溶质质量分数的计算
例题3:已知氯化钠在20℃时溶解度是36g,计算150g饱和氯化钠溶液的质量分数。
100g水
36g氯化钠
饱和
80g溶液
P%=
×100%
m质
m液
=
×100%
36
36
+100
26.5%
≈
饱和
26.5%
50g溶液
饱和
26.5%
150g溶液
饱和
26.5%
饱和溶液溶质质量分数:
S
100+S
P%=
×100%
注意:同一温度下,同种饱和溶液的溶质质量分数都相同!与
溶解度有关,与溶液质量的多少没有关系!
思考与讨论
◆已知20℃时,氯化钠的溶解度是36g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
不对。
对饱和溶液而言,
S
100+S
P%=
×100%
=
×100%
36
36
+100
26.5%
≈
思考与练习
例题4:已知20℃时,氯化钠的溶解度是36g。分别计算出下列A、B、C三种溶液的溶质质量分数。
提醒:
首先要判断加进去的NaCl是否全部溶解。
S
100
=
m质
m剂
以水为基础进行计算
溶液 溶质质量/g 水的质量/g 溶质质量分数
A 10 90
B 20 80
C 30 70
思考与练习
提醒:
首先要判断加进去的NaCl是否全部溶解。
S
100
=
m质
m剂
36
100
=
m质
90
m质
=
32.4g
>
10
所以,10g溶质全部溶解,溶液为不饱和溶液。
P%=
×100%
m质
m液
=
×100%
10
10
+90
=10%
10%
例题4:已知20℃时,氯化钠的溶解度是36g。分别计算出下列A、B、C三种溶液的溶质质量分数。
溶液 溶质质量/g 水的质量/g 溶质质量分数
A 10 90
B 20 80
C 30 70
思考与练习
提醒:
首先要判断加进去的NaCl是否全部溶解。
S
100
=
m质
m剂
36
100
=
m质
80
m质
=
28.8g
>
20
所以,20g溶质全部溶解,溶液为不饱和溶液。
P%=
×100%
m质
m液
=
×100%
20
20
+80
=20%
20%
例题4:已知20℃时,氯化钠的溶解度是36g。分别计算出下列A、B、C三种溶液的溶质质量分数。
溶液 溶质质量/g 水的质量/g 溶质质量分数
B 20 80
B 20 80
C 30 70
思考与练习
提醒:
首先要判断加进去的NaCl是否全部溶解。
S
100
=
m质
m剂
36
100
=
m质
70
m质
≈
25.2g
>
30
所以,30g溶质只溶解了25.2g,溶液为饱和溶液。
S
100+S
P%=
×100%
=
×100%
36
36
+100
26.5%
≈
26.5%
例题4:已知20℃时,氯化钠的溶解度是36g。分别计算出下列A、B、C三种溶液的溶质质量分数。
溶液 溶质质量/g 水的质量/g 溶质质量分数
C 30 70
B 20 80
C 30 70
先判断加入的20克NaCl是否全部溶解呢?
据溶解度公式有:
巩固练习
◆200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数?
分析:
S
100
=
m质
m剂
36
100
=
m质
50
m质
=
18g
>
20g
所以,20g溶质只溶解了18g,溶液为饱和溶液。
S
100+S
P%=
×100%
=
×100%
36
36
+100
26.5%
≈
溶液的稀释
例题5: 20g10%的盐水中加入2g水,求:溶质的质量分数。
【分析】:
20g
× 10%
20g10%的盐水中加入2g水后,溶液的总质量变为: g。
20
+2
加水后溶液中溶质的质量 (填“变大”、
“变小”、“不变”),
溶质的质量仍为 (填表达式)。
不变
=
m液
20+2=22g,
已知:
P%=10%
所以:
=
×100%
22
≈9.1%
P%=
×100%
m质
m液
20g
×10%
由较大质量分数的溶液变为较小质量分数的溶液。
溶液的稀释:
稀释的特点:
溶液稀释前后,溶质的质量不变
m质(稀释前)
=
m质(稀释后)
m液(前)
×
P(前)%
=
m液(后)
×P(后)%
溶液的稀释
溶液的稀释
例题6: 化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设稀释后溶液的质量为X。则有:
50g
×
98%
=
20%
X
X = 245g
?
需要水的质量为:
245g—50g
=195g
50g
98%
20%
X
方法一
溶液的稀释
例题6: 化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设加入水的质量为X。则有:
50g
×
98%
=
20%
X
X = 195g
?
50g
98%
20%
X
(X+50)
+ 50
( )
方法二
稀释前后溶质质量不变
m质(稀释前)
=
m质(稀释后)
m液(前)
×
P(前)%
=
m液(后)
×P(后)%
随堂练习
3、把100g质量分数为98%的硫酸稀释成10%的稀硫酸,需要水的质量是多少?
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设稀释后溶液的质量为X。则有:
100g
×
98%
=
10%
X
X = 980g
?
需要水的质量为:
980g—100g
=880g
100g
98%
10%
X
方法一
稀释前后溶质质量不变
m质(稀释前)
=
m质(稀释后)
m液(前)
×
P(前)%
=
m液(后)
×P(后)%
随堂练习
3、把100g质量分数为98%的硫酸稀释成10%的稀硫酸,需要水的质量是多少?
100g
×
98%
=
10%
X
X = 880g
?
100g
98%
10%
X
(X+100)
+ 100
( )
方法二
随堂练习
4、配制500ml质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸多少毫升?
(备注:20%的硫酸密度为1.14g/cm3,98%的硫酸密度为1.84g/cm3)
98%
20%
500mL
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设需98%的浓硫酸体积为X
XmL
X·1.84g/cm3
( )
×98%
=
(500ml×1.14g/cm3)
×20%
X=63.2cm3
m质= (ρ液· v ) · P%
随堂练习
5、把100毫升98%的浓硫酸(密度为1.84克/毫升)稀释成10%的稀硫酸,需要加水多少毫升?
98%
10%
X克
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设稀硫酸的质量为X
100mL
X
×98%
=
10%
(100×1.84)
?
X = 184×9.8
(克)
需要加水的质量为:
184×9.8—
(100×1.84)
=184×8.8
需要加水的体积为:
184×8.8
÷1g/cm3
=1619.2cm3
方法一
随堂练习
5、把100毫升98%的浓硫酸(密度为1.84克/毫升)稀释成10%的稀硫酸,需要加水多少毫升?
98%
10%
XmL
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设需要加水的体积为X
100mL
X
×98%
=
1
(100×1.84)
?
(100×1.84)
方法二
(100×1.84) +
[ ]
×10%
X=1619.2cm3
随堂练习
6、将80克30%的硫酸稀释成20%的硫酸溶液,所得溶液的质量是多少?要水多少克
【分析】:
溶液稀释前后,溶质的质量不变
80g
30%
20%
X克
【解】:
设稀释后溶液的质量为X
80g
×
30%
=
20%
X
X =120g
?
需要加水的质量为:
120g—
80g
=120g
教学目标
1.掌握溶质质量分数计算公式及其变换计算。
2.理解溶质质量分数与溶解度的区别和联系
3.掌握溶解度与饱和溶液溶质质量分数的关系公式。
◆有客人到你家来访问,你如何泡一杯盐水给客人?
NaCl
生活场景
水
◆有客人到你家来访问,你如何泡一杯50g6%的盐水给客人?
此时,你放的盐和水的质量就要精确考虑啦!
1克水=
氯化钠:
50g × 6% = 3g
水:
50g — 3g =47g
1、计算:
2、称量:
托盘天平
量筒
1mL水
、胶头滴管
、药匙
配制一定质量分数的溶液
◆如何配制50g质量分数为6%的氯化钠溶液?
3、量取:
( )
4、溶解:
烧杯
、玻璃棒
(搅拌,加速溶解)
5、贮存:
氯化钠溶液
6%
溶液名称
质量分数
液体的质量都用量筒“量”
类型1:用“固体”配溶液
◆有客人到你家来访问,你会如何给客人泡一杯蜂蜜饮品?
生活场景
溶液的稀释
6%氯化钠溶液:
X
水:
50g— 25g =25g
1、计算:
配制一定质量分数的溶液
◆如何用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
6%
NaCl溶液
50g3%
NaCl溶液
X
溶液的稀释
6%
NaCl溶液
6% =
·
50g×3%
X = 25g
液体的质量都用量筒“量”
=25mL
=
ρ
m
V
=
25
1.04
≈24mL
类型2:用“液体”配溶液
2、量取:
配制一定质量分数的溶液
◆如何用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
6%
NaCl溶液
50g3%
NaCl溶液
X
溶液的稀释
6%
NaCl溶液
液体的质量都用量筒“量”
量筒
、胶头滴管
3、混匀:
烧杯
、玻璃棒
4、贮存:
类型2:用“液体”配溶液
浓度偏大
浓度偏小
浓度偏大
误差分析
1、在配制一定溶质质量分数的氯化钠溶液的实验中,下列操作对所配得溶液的浓度产生怎样的影响?
①向烧杯中倒入蒸馏水时,不慎有少量蒸馏水滴落到试验台上
②溶解食盐时,使用的烧杯有些湿润;
③量取蒸馏水时,采用俯视的方式读数;
溶剂减少
溶剂增加
溶剂实际量比读数少
(溶剂减少)
④将配得的溶液从烧杯中转移到干燥、洁净的试剂瓶中时,有少量液体溅出;
溶液已配制好,均有均一性
浓度没有变化
⑤称量氯化钠后,有少量氯化钠未完全转移到烧杯中进行溶解
溶质减少
浓度偏小
计算错误
溶解时有部分蒸馏水飞溅出来;
量取水时采用俯视读数;
所用的砝码已生锈
误差分析
2、在配制500g溶质质量分数为5%的氯化钠溶液的实验中,实际得到的氯化钠溶液的溶质质量分数比5%大,请你分析这其中可能有哪些原因?
从配制溶液的过程进行分析
1、计算;
2、称量;
3、量取;
4、溶解;
5、贮存。
(溶质算少了)
计算错误
固体还没溶解完时就装瓶
量取水时采用仰视读数;
误差分析
2、在配制500g溶质质量分数为5%的氯化钠溶液的实验中,实际得到的氯化钠溶液的溶质质量分数比5%小,请你分析这其中可能有哪些原因?
从配制溶液的过程进行分析
1、计算;
2、称量;
3、量取;
4、溶解;
5、贮存。
(溶剂算多了)
固体和砝码的位置颠倒;
药品中含有不溶性杂质
烧杯不干燥或烧杯有水;
量筒中的液体溶质未全部倒出;
向烧杯转移固体时,有一部分溶质洒落到烧杯外。
发生反应的溶液溶质质量分数的计算
例题:32.5 g锌粒与280 g稀硫酸恰好完全反应。试求:
(1)稀硫酸中溶质的质量分数。
(2)生成物溶液中溶质的质量分数。
Zn + H2SO4 = ZnSO4 + H2 ↑
P%=
m质
m液
×100%=
280
×100%
m质
=17.5%
65 98 161 2
32.5g
280g
X
65
32.5
=
98
X
X =49
●溶液中参与反应的是溶质;
●不能将溶液的质
量代入化学方程式
进 行计算。应代入
溶质的质量。
注意:
49
Y
P%=
m质
m液
×100%
根据质量守恒定律有:
m
Zn
+
m
H2SO4
=
m
H2
+
m
ZnSO4
32.5+280=
m
H2
+
m
ZnSO4
1
m
ZnSO4
=
311.5
65
32.5
=
2
W
W=1
65
32.5
=
161
Y
Y= 80.5
W
80.5
311.5
≈25.8%
5、100g某硫酸恰好与13 g锌完全起反应。试计算这种硫酸中溶质的质量分数。(H-1;S-32;O-16;Zn-65)
Zn + H2SO4 = ZnSO4 + H2↑
98
65
只有溶质参与反应
完全参与反应
X
13g
设参加反应的硫酸的溶质为X,则有:
65
13
=
98
X = 19.6g
X
所以硫酸中溶质的质量分数为:
P%=
×100%
m质
m液
=
×100%
19.6
100
= 19.6%
课后练习
溶质质量=( )x ( )
溶液质量=( ) ÷ ( )
溶液质量=( ) + ( )
溶液质量
溶液质量
溶质质量
溶剂质量
1.溶液中溶质的质量分数是 。溶液中溶质质量分数越大,说明溶液中溶质的相对含量越 (“高”或“低”)。
2.相关公式:
溶质质量分数=
( )
( )
X100%
3.某氯化镁溶液200g蒸干得到氯化镁10g,则该氯化镁溶液的溶质质量分数是 ;实验室需配制20%Na2CO3溶液200g,问需碳酸钠 g,水 g;10g氯化钠可配制成10%的氯化钠溶液 g。
溶质质量与溶液质量之比
高
溶质质量
溶液质量
溶质质量分数
溶质质量分数
5%
40
160
100
自学检测1(3分钟)
1.某氯化镁溶液200g蒸干得到氯化镁10g,则该氯化镁溶
液的溶质质量分数是 ;实验室需配制20%Na2CO3溶
液200g,问需碳酸钠 g,水 g;10g氯化钠可配制
成10%的氯化钠溶液 g。
2.20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液
的溶质质量分数。
3.20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质
量分数。
5%
40
160
100
学生自学,教师巡视2(6分钟)
增加溶质的质量,则溶质和溶液的质量同时增加。
增加溶剂的质量,则溶剂和溶液的质量同时增加。
剩余溶液的溶质质量分数不变,仍是 10 %
解:
20g X10%
加水:
20g +2g
=9.1%
加盐:
20g X10%+2g
20g +2g
=18.2%
2.20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
3.20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
自学检测2(3分钟)
二、 关于溶液中溶质的质量分数的计算
1.已知溶质和溶剂质量,求溶质的质量分数
2.已知溶液质量和溶质的质量分数,求溶质和溶剂的质 量
1.要配制500mL质量分数为10%的NaNO3溶液(密度为1.1 g/cm3),需要NaNO3和水质量各多少克?
(提示:想一想质量密度体积间的关系)
2.100g某稀硫酸恰好与13g锌完全起反应,试计算这种硫酸溶液中溶质的质量分数。(提示:写出化学方程式,代入方程式计算的为纯净物的质量,即溶质的质量)
3.20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
4.20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
学生自学,教师巡视2(6分钟)
1.要配制500mL质量分数为10%的NaNO3溶液(密度为1.1 g/cm3),需要NaNO3和水质量各多少克?
2.100g某稀硫酸恰好与13g锌完全起反应,试计算这种硫酸溶液中溶质的质量分数。
自学检测2(3分钟)
NaNO3的质量55g ,水的质量495g
19.6%
不能将溶液的质量代入化学方程式进行计算。应先将溶质的质量利用质量分数的表达式求出来。
点拨:溶液的质量=溶液的密度×溶液的体积
m=ρV
解:设这种硫酸溶液中溶质的质量为x
Zn +H2SO4 ═ ZnSO4 + H2↑
65 98
13g x
65:98=13g:x
X= 19.6g
答:略。
m(NaNO3)=500mL×1.1g/cm3×10%=55g
m(水)=500mL×1.1g/cm3-55g=495g
增加溶质的质量,则溶质和溶液的质量同时增加。
增加溶剂的质量,则溶剂和溶液的质量同时增加。
剩余溶液的溶质质量分数不变,仍是 10 %
解:
20g X10%
加水:
20g +2g
=9.1%
加盐:
20g X10%+2g
20g +2g
=18.2%
3.20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
4.20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
1.对“10%食盐溶液”含义的解释,一定正确的是( )
A.100g水中溶解了10g食盐
B.100g食盐溶液中含有10g食盐
C.将10g 食盐溶于90g水中所得溶液
D.食盐与溶液的质量之比是1:10
2. (t℃时该物质的溶解度为36g)
(1)t℃时,将10g某固体物质加入到50g 水中充分溶解,得到的溶液溶质质量分数为 。
(2)t℃时,将20g固体物质加入到50g 水中充分溶解,得到的溶液溶质质量分数为 。
(提示:想想50g水中最多溶解多少该溶质)
讨论1:
D
26.5%
溶质的质量是指已经溶解了那部分,没有溶解的不算在内。
点拨:
学生讨论,教师点拨2(8分钟)
16.7%
点拨:某温度下某物质的饱和溶液中,其溶质质量分数是固定值, 也是最大值。等于
3.用横坐标表示加入溶质的质量,纵坐标表示溶液的溶质质量分数,请绘制出溶质质量分数随加入溶质质量增多而变化的图像。
讨论2:
1.50℃时,氯化铵的溶解度为50g,求50℃时氯化铵饱和溶液中溶质的质量分数?(提示:50 ℃时,100g水中最多溶解氯化铵多少g?形成溶液多少g?)
2.t℃时,某固体物质的溶解度为S,则t℃时,该物质的饱和溶液中溶质的质量分数表示式 。
提示:t℃时,100 g水中最多溶解
该物质多少g?形成溶液多少g?
33.3%
溶质的质量分数36% 是指: 100g溶液中含有 溶质。
溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。溶液质量为
溶质质量分数与溶解度的比较
36g
136g
一定的温度、100克溶剂、达到饱和状态、单位:克
温度不一定、溶剂不定量、不一定饱和、无单位
溶质质量分数与溶解度的有没有什么联系呢?
点拨:溶质质量分数与溶解度的关系
溶质的质量分数=
溶质质量
溶液质量
=
溶解度
溶解度+100克
×100℅
×100℅
联系: 在一定温度下的饱和溶液中
溶解度(S) 溶质的质量分数
意义 定量地表示物质溶解能力的强弱 表示溶液中溶质质量与溶液质量之比
条件 一定的温度
100克溶剂
达到饱和状态 温度不一定
溶剂不定量
不一定饱和
单位 克 无单位(是比值)
当堂训练(15分钟)
1.某温度时,蒸干35g氯化钾溶液,得到10g 氯化钾,求该溶液中溶质质量分数。
2.农业生产中通常用10%-20%的食盐水来选种,现有配制好的15%的食盐水200kg,其中含水的质量为多少?
3.50g 质量分数为38%的盐酸与足量的大理石反应,生成二氧化碳的质量是多少?这些二氧化碳的体积(标准状况)是多少?(在标准状况下,二氧化碳的密度为1.997gL)
4.已知20 ℃时某饱和溶液溶质质量分数为20%,求该温度下该物质的溶解度 。
25g
28.6%
170g
11.45g
5.73L
5.
D
6.60℃时,100g硝酸钾的饱和溶液,恒温蒸发部分溶剂,再将溶液逐渐冷却到40℃。能表示此过程溶质质量分数a%与时间t关系的是( )
t
a %
0
A
t
a %
0
B
t
a %
0
C
t
a %
0
D
A
7.右图是A、B、C三种物质
的溶解度曲线,据图回答:
t1℃时A、B、C三种物
质的溶解度由大到小的顺序
是 (填序号,下同)
(2) t1℃时30gA物质加入到
50g水中不断搅拌,形成的溶
液质量是 g。
(3) 将t1℃时A、B、C三种物质饱和溶液的温度升高到t2时,三种溶液的溶质质量分数由大小关系是 。
(选做题)
B>C>A
65
B>C>A
1、下列叙述中正确的是( )
对于易溶物,浓度很大时,不一定达到饱和。
A、浓度大的溶液一定是饱和溶液
B、饱和溶液的浓度一定大
C、通过溶液中溶质的质量分数可以换算出该溶质的溶解度
D、通过饱和溶液中溶质的溶解度可以换算出该溶质的质量分数
对于不易溶的物质,浓度很稀时就可能已经饱和。
只有饱和溶液时,才能进行二者的换算。
√
D
综合练习
2. 将20 gKNO3溶于70 g水中,所得溶液中溶质的质量分数是多少?
3. 100 g30%的氢氧化钠溶液中溶质的质量是多少?
4. 将10 gKCl溶于100 g水中,所得溶液中溶质的质量分数是多少?
6. 20?C时食盐的溶解度是36 g,求该温度下食盐饱和溶液中溶质的质量分数。
8. 将40 g质量分数为20%的氯化钠溶液与60 g质量分数为30%的氯化钠溶液混合,所得溶液中溶质的质量分数是多少?
7. 配制质量分数为20%的氢氧化钠溶液100 g,需质量分数为80%的氢氧化钠溶液的质量是多少?
[引导讨论]:将一烧杯150克CuSO4溶液分成三等份。
1、每一份溶液的浓度是否改变?
2、向第1份溶液中加入10g水,其溶质、
溶剂、溶液的浓度是否改变?
3、将第二份溶液蒸发掉10 g水
4、向第3份溶液中加入5g CuSO4,完
全溶解后,其溶质、溶剂、溶液的浓度是否改变?
减少
减少
减少
不变
不变
增加
增加
变稀
不变
减少
减少
变浓
增加
不变
增加
变浓
溶质质量 溶剂质量 溶液质量 溶液浓度
每一份
加水10g
蒸去水
加入5g CuSO4
自我检测
10g
10%
80g
20%
NaCl溶液 水 NaCl固体 溶质的质量分数
100g 90g
100g 20g
200g 15%
380g 20g
20℃时某氯化钠溶液中溶质的质量分数为20%
(1) 此时溶液中溶质、溶剂和溶液的质量比为多少?
(2)若将100克此溶液分为二等份,则每一份溶液中溶质的质量分数为多少?
(3)向其中一份中加入10g水,则溶质的质量分数为多少?
(4)向另一份中加入2gNaCl固体全部溶解,则溶液中溶质的质量分数为多少?
20℃时某氯化钠溶液中溶质的质量分数为20%
(5)若从100g此溶液中取出5g溶液,则剩余溶液中溶质的质量分数为多少?
(6)若将其中一份溶液升温到40℃时,溶质的质量分数为多少?
(7)若要让100g的此溶液溶质的质量分数减半,则需加水多少克?
练一练
1、将200 g含水99%的食盐溶液的含水量变为98%,应蒸发掉水 g。
2、一份溶质的质量分数为2%的氯化钠溶液,蒸发掉40 g水后,其溶质的质量分数为10%,则原溶液的质量为 ( )
A. 200g B. 150g C. 100g D. 50g
100
D
练习:
1. 取10gNaCl溶于90g的水中,所得溶液的溶质质量分数为:_________
10%
3.已知t?C时NaCl的溶解度为a克,则t?C时饱和溶液溶质的质量分数为_______
2.180克10%的NaOH溶液加入①20克NaOH ②20克水,所得溶液的溶质质量分数分别是多少?
练习:
1.配制80克10%的硝酸钾溶液,需硝酸钾和水的质量分别为___克和___克。
2.配制a克质量分数为b%的氯化钠溶液,需氯化钠为____克,水为________克。
8
72
ab%
a-ab%
总结:配制(溶质质量分数一定的)溶液的步骤
例:配制50克质量分数为 6%的氯化钠溶液
步骤:1.计算:需氯化钠___克,水___克。
3
47
2.称量:固体
3.溶解:量取液体,溶解固体。
3、40g 2%的食盐溶液中含有 多少g食盐和水?
40 × 2% =
m质
×100%
P%=
m液
2
×100%=
=
20
10%
m质=
m液
×
P%=
40g – 0.8 g=
0.8g
m液—
m质=
m剂=
39.2 g
当堂练习
2、20g食盐溶液中含有 2g食盐,求:溶质的质量分数?
1、生理盐水是溶质质量分数为0.9%的氯化钠溶液,现用1000g生理盐水给病人输液,进入病人体内的氯化钠的质量为多少?水的质量是多少?
m质
=
m液
× P%
=
1000Kg
× 0.9%
= 9Kg
m液
=
-m质
m剂
= 1000-9
= 991Kg
4、从一瓶氯化钾的溶液中取出20g溶液蒸干后得到2.8g氯化钾固体,求这瓶溶液溶质的质量分数。
m质
×100%
P%=
m液
2.8
×100%=
=
20
14%
当堂练习
5、配制20mL10%的NaOH溶液(密度为1.1g/cm3) 需要NaOH 和水各多少克?
m质
=
m液
×P%
=
( )
× P%
=
ρ·v
( )
1.1
×
20
×
10%
=2.2g
m液
=
-m质
m剂
=
—2.2
( )
ρ·v
=
( )
1.1
×
20
—2.2
=19.8g
6、现有70g10%的硝酸钾溶液:
①若蒸发30g水且无晶体析出,此时溶液的质量分数为多少?
②若加入15g硝酸钾晶体并完全溶解,此时溶质的质量分数又为多少?
当堂练习
P%=
×100%
m质
m液
=
×100%
70×10%
70
=17.5%
—30
P%=
×100%
m质
m液
=
×100%
70×10%
70
+15
+15
25.9%
≈
9、20g 10%的盐水中倒出一半,求:溶质的质量分数。
溶液的浓度不变,仍是 10 %
8、20g 10%的盐水中放入 2g食盐,求:溶质的质量分数。
m质
×100%
P%=
m液
20×10%
×100%
=
20
9.1%
+
2
m质
×100%
P%=
m液
20×10%
×100%=
=
20
18.2%
+
2
+
2
≈
7、20g 10%的盐水中放入 2g水,求:溶质的质量分数。
当堂练习
溶液的浓度
第九单元 课题3
第1课时
第2课时
教学目标
1、溶质质量分数基本公式及应用
3、溶液的稀释
2、饱和溶液溶质质量分数的计算
4、发生化学反应的溶液的溶质质量分
数的计算
5、配制一定质量分数的溶液
情境引入
◆判断溶液浓稀的根据是什么?
①
②
③
◆下面三种溶液浓度最大是 ,
最小是 。
③
①
【结论】对于有色溶液来说,我们可根据溶液颜色的深浅来区分溶液的浓稀,方法比较粗略,不能准确的表明一定量的溶液里究竟含有多少溶质。无色溶液不能用这种方法区分溶液的浓稀。
在三个小试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。比较三种溶液的颜色。
溶液的颜色
飞机喷洒农药
喷洒药水
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木.
在实际应用中我们常常要准确知道一定量的溶液中所含溶质的量。
实际应用
溶液的浓度
某物质含量为6mg/100ml
(见于某酱油商标)
溶液浓度的表示方法
100 ml中有某物质多少毫克(多见于各种饮料)
酒精度为54%(V/V)
(多见于饮用酒)
某物质含量为36%。
质量分数
溶质的质量分数
(P%)
1、定义:
2、表达式:
3、变型公式:
溶液中溶质的质量与溶液的质量之比。
P%=
×100%
m质
m液
=
×100%
m质
m质
+m剂
m质
=
m液
× P%
m液
=
P%
m质
①
②
③
例1:在三个小试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g固体硫酸铜。计算这三种溶液的溶质质量分数。
溶质的质量分数
(P%)
①
②
③
20
1mL水 = 1g水
0.1
20.1
0.5%
20
0.5
20.5
2.4%
20
2
22
9.1%
编号 溶剂质量/g 溶质质量/g 溶液质量/g 溶质质量分数
溶质的质量分数
(P%)
解:
=
m液
150Kg,
例题2:在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配置150kg这种溶液,需要氯化钠和水的质量各是多少?
已知:
=
16%
P%
求:
=
m质
?,
=
m剂
?,
因为:
m质
=
m液
× P%
所以:
m质
=
150Kg
× 16%
= 24Kg
又因为:
m液
=
m质
+ m剂
所以:
m液
=
-m质
m剂
= 160-24
= 126Kg
饱和
S
100
=
m质
m剂
S
100
=
40—8.4
100
S = 31.6
31.6
g
随堂练习
1、在20℃时,将40g硝酸钾固体加入100g水中,充分搅拌后,仍有8.4g硝酸钾固体未溶解。请填写下列空白:
(1)所得溶液是20℃时硝酸钾的 溶液(填“饱和”或“不饱和”);
(2)20℃时硝酸钾的溶解度为 ;
(3)所得溶液中硝酸钾的质量分数为 。
P%=
×100%
m质
m液
=
×100%
40—8.4
100+(40—8.4)
≈ 24%
24%
1、在20℃时,将40g硝酸钾固体加入100g水中,充分搅拌后,仍有8.4g硝酸钾固体未溶解。请填写下列空白:
(3)所得溶液中硝酸钾的质量分数为 。
随堂练习
35g KCl溶液
溶质:
溶剂:
KCl
H2O
7g
(35—7)g
28g
P%=
×100%
m质
m液
=
×100%
7
35
= 20%
随堂练习
2、某温度时,蒸干35g氯化钾溶液,得到7g氯化钾,求该溶液中溶质的质量分数。
m质
=
m液
×P%
=
(ρ·v)
×P%
= (500mL×1.1g/cm3)
×10%
= 55g
m剂
=
m液
— m质
= (500mL×1.1g/cm3)—55g
= 495g
补充练习
随堂练习
4、配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1 g/cm3),需要氢氧化钠和水的质量各是多少?
饱和溶液的溶质质量分数的计算
例题3:已知氯化钠在20℃时溶解度是36g,计算150g饱和氯化钠溶液的质量分数。
20℃
36g
100g
136g
100g水
36g氯化钠
饱和
80g溶液
P%=
×100%
m质
m液
=
×100%
36
36
+100
26.5%
≈
饱和
26.5%
50g溶液
饱和
26.5%
150g溶液
饱和
26.5%
温度 溶质质量 溶剂质量 溶液质量
饱和溶液的溶质质量分数的计算
例题3:已知氯化钠在20℃时溶解度是36g,计算150g饱和氯化钠溶液的质量分数。
100g水
36g氯化钠
饱和
80g溶液
P%=
×100%
m质
m液
=
×100%
36
36
+100
26.5%
≈
饱和
26.5%
50g溶液
饱和
26.5%
150g溶液
饱和
26.5%
饱和溶液溶质质量分数:
S
100+S
P%=
×100%
注意:同一温度下,同种饱和溶液的溶质质量分数都相同!与
溶解度有关,与溶液质量的多少没有关系!
思考与讨论
◆已知20℃时,氯化钠的溶解度是36g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
不对。
对饱和溶液而言,
S
100+S
P%=
×100%
=
×100%
36
36
+100
26.5%
≈
思考与练习
例题4:已知20℃时,氯化钠的溶解度是36g。分别计算出下列A、B、C三种溶液的溶质质量分数。
提醒:
首先要判断加进去的NaCl是否全部溶解。
S
100
=
m质
m剂
以水为基础进行计算
溶液 溶质质量/g 水的质量/g 溶质质量分数
A 10 90
B 20 80
C 30 70
思考与练习
提醒:
首先要判断加进去的NaCl是否全部溶解。
S
100
=
m质
m剂
36
100
=
m质
90
m质
=
32.4g
>
10
所以,10g溶质全部溶解,溶液为不饱和溶液。
P%=
×100%
m质
m液
=
×100%
10
10
+90
=10%
10%
例题4:已知20℃时,氯化钠的溶解度是36g。分别计算出下列A、B、C三种溶液的溶质质量分数。
溶液 溶质质量/g 水的质量/g 溶质质量分数
A 10 90
B 20 80
C 30 70
思考与练习
提醒:
首先要判断加进去的NaCl是否全部溶解。
S
100
=
m质
m剂
36
100
=
m质
80
m质
=
28.8g
>
20
所以,20g溶质全部溶解,溶液为不饱和溶液。
P%=
×100%
m质
m液
=
×100%
20
20
+80
=20%
20%
例题4:已知20℃时,氯化钠的溶解度是36g。分别计算出下列A、B、C三种溶液的溶质质量分数。
溶液 溶质质量/g 水的质量/g 溶质质量分数
B 20 80
B 20 80
C 30 70
思考与练习
提醒:
首先要判断加进去的NaCl是否全部溶解。
S
100
=
m质
m剂
36
100
=
m质
70
m质
≈
25.2g
>
30
所以,30g溶质只溶解了25.2g,溶液为饱和溶液。
S
100+S
P%=
×100%
=
×100%
36
36
+100
26.5%
≈
26.5%
例题4:已知20℃时,氯化钠的溶解度是36g。分别计算出下列A、B、C三种溶液的溶质质量分数。
溶液 溶质质量/g 水的质量/g 溶质质量分数
C 30 70
B 20 80
C 30 70
先判断加入的20克NaCl是否全部溶解呢?
据溶解度公式有:
巩固练习
◆200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数?
分析:
S
100
=
m质
m剂
36
100
=
m质
50
m质
=
18g
>
20g
所以,20g溶质只溶解了18g,溶液为饱和溶液。
S
100+S
P%=
×100%
=
×100%
36
36
+100
26.5%
≈
溶液的稀释
例题5: 20g10%的盐水中加入2g水,求:溶质的质量分数。
【分析】:
20g
× 10%
20g10%的盐水中加入2g水后,溶液的总质量变为: g。
20
+2
加水后溶液中溶质的质量 (填“变大”、
“变小”、“不变”),
溶质的质量仍为 (填表达式)。
不变
=
m液
20+2=22g,
已知:
P%=10%
所以:
=
×100%
22
≈9.1%
P%=
×100%
m质
m液
20g
×10%
由较大质量分数的溶液变为较小质量分数的溶液。
溶液的稀释:
稀释的特点:
溶液稀释前后,溶质的质量不变
m质(稀释前)
=
m质(稀释后)
m液(前)
×
P(前)%
=
m液(后)
×P(后)%
溶液的稀释
溶液的稀释
例题6: 化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设稀释后溶液的质量为X。则有:
50g
×
98%
=
20%
X
X = 245g
?
需要水的质量为:
245g—50g
=195g
50g
98%
20%
X
方法一
溶液的稀释
例题6: 化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设加入水的质量为X。则有:
50g
×
98%
=
20%
X
X = 195g
?
50g
98%
20%
X
(X+50)
+ 50
( )
方法二
稀释前后溶质质量不变
m质(稀释前)
=
m质(稀释后)
m液(前)
×
P(前)%
=
m液(后)
×P(后)%
随堂练习
3、把100g质量分数为98%的硫酸稀释成10%的稀硫酸,需要水的质量是多少?
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设稀释后溶液的质量为X。则有:
100g
×
98%
=
10%
X
X = 980g
?
需要水的质量为:
980g—100g
=880g
100g
98%
10%
X
方法一
稀释前后溶质质量不变
m质(稀释前)
=
m质(稀释后)
m液(前)
×
P(前)%
=
m液(后)
×P(后)%
随堂练习
3、把100g质量分数为98%的硫酸稀释成10%的稀硫酸,需要水的质量是多少?
100g
×
98%
=
10%
X
X = 880g
?
100g
98%
10%
X
(X+100)
+ 100
( )
方法二
随堂练习
4、配制500ml质量分数为20%的稀硫酸溶液,需要质量分数为98%的浓硫酸多少毫升?
(备注:20%的硫酸密度为1.14g/cm3,98%的硫酸密度为1.84g/cm3)
98%
20%
500mL
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设需98%的浓硫酸体积为X
XmL
X·1.84g/cm3
( )
×98%
=
(500ml×1.14g/cm3)
×20%
X=63.2cm3
m质= (ρ液· v ) · P%
随堂练习
5、把100毫升98%的浓硫酸(密度为1.84克/毫升)稀释成10%的稀硫酸,需要加水多少毫升?
98%
10%
X克
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设稀硫酸的质量为X
100mL
X
×98%
=
10%
(100×1.84)
?
X = 184×9.8
(克)
需要加水的质量为:
184×9.8—
(100×1.84)
=184×8.8
需要加水的体积为:
184×8.8
÷1g/cm3
=1619.2cm3
方法一
随堂练习
5、把100毫升98%的浓硫酸(密度为1.84克/毫升)稀释成10%的稀硫酸,需要加水多少毫升?
98%
10%
XmL
【分析】:
溶液稀释前后,溶质的质量不变
【解】:
设需要加水的体积为X
100mL
X
×98%
=
1
(100×1.84)
?
(100×1.84)
方法二
(100×1.84) +
[ ]
×10%
X=1619.2cm3
随堂练习
6、将80克30%的硫酸稀释成20%的硫酸溶液,所得溶液的质量是多少?要水多少克
【分析】:
溶液稀释前后,溶质的质量不变
80g
30%
20%
X克
【解】:
设稀释后溶液的质量为X
80g
×
30%
=
20%
X
X =120g
?
需要加水的质量为:
120g—
80g
=120g
教学目标
1.掌握溶质质量分数计算公式及其变换计算。
2.理解溶质质量分数与溶解度的区别和联系
3.掌握溶解度与饱和溶液溶质质量分数的关系公式。
◆有客人到你家来访问,你如何泡一杯盐水给客人?
NaCl
生活场景
水
◆有客人到你家来访问,你如何泡一杯50g6%的盐水给客人?
此时,你放的盐和水的质量就要精确考虑啦!
1克水=
氯化钠:
50g × 6% = 3g
水:
50g — 3g =47g
1、计算:
2、称量:
托盘天平
量筒
1mL水
、胶头滴管
、药匙
配制一定质量分数的溶液
◆如何配制50g质量分数为6%的氯化钠溶液?
3、量取:
( )
4、溶解:
烧杯
、玻璃棒
(搅拌,加速溶解)
5、贮存:
氯化钠溶液
6%
溶液名称
质量分数
液体的质量都用量筒“量”
类型1:用“固体”配溶液
◆有客人到你家来访问,你会如何给客人泡一杯蜂蜜饮品?
生活场景
溶液的稀释
6%氯化钠溶液:
X
水:
50g— 25g =25g
1、计算:
配制一定质量分数的溶液
◆如何用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
6%
NaCl溶液
50g3%
NaCl溶液
X
溶液的稀释
6%
NaCl溶液
6% =
·
50g×3%
X = 25g
液体的质量都用量筒“量”
=25mL
=
ρ
m
V
=
25
1.04
≈24mL
类型2:用“液体”配溶液
2、量取:
配制一定质量分数的溶液
◆如何用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
6%
NaCl溶液
50g3%
NaCl溶液
X
溶液的稀释
6%
NaCl溶液
液体的质量都用量筒“量”
量筒
、胶头滴管
3、混匀:
烧杯
、玻璃棒
4、贮存:
类型2:用“液体”配溶液
浓度偏大
浓度偏小
浓度偏大
误差分析
1、在配制一定溶质质量分数的氯化钠溶液的实验中,下列操作对所配得溶液的浓度产生怎样的影响?
①向烧杯中倒入蒸馏水时,不慎有少量蒸馏水滴落到试验台上
②溶解食盐时,使用的烧杯有些湿润;
③量取蒸馏水时,采用俯视的方式读数;
溶剂减少
溶剂增加
溶剂实际量比读数少
(溶剂减少)
④将配得的溶液从烧杯中转移到干燥、洁净的试剂瓶中时,有少量液体溅出;
溶液已配制好,均有均一性
浓度没有变化
⑤称量氯化钠后,有少量氯化钠未完全转移到烧杯中进行溶解
溶质减少
浓度偏小
计算错误
溶解时有部分蒸馏水飞溅出来;
量取水时采用俯视读数;
所用的砝码已生锈
误差分析
2、在配制500g溶质质量分数为5%的氯化钠溶液的实验中,实际得到的氯化钠溶液的溶质质量分数比5%大,请你分析这其中可能有哪些原因?
从配制溶液的过程进行分析
1、计算;
2、称量;
3、量取;
4、溶解;
5、贮存。
(溶质算少了)
计算错误
固体还没溶解完时就装瓶
量取水时采用仰视读数;
误差分析
2、在配制500g溶质质量分数为5%的氯化钠溶液的实验中,实际得到的氯化钠溶液的溶质质量分数比5%小,请你分析这其中可能有哪些原因?
从配制溶液的过程进行分析
1、计算;
2、称量;
3、量取;
4、溶解;
5、贮存。
(溶剂算多了)
固体和砝码的位置颠倒;
药品中含有不溶性杂质
烧杯不干燥或烧杯有水;
量筒中的液体溶质未全部倒出;
向烧杯转移固体时,有一部分溶质洒落到烧杯外。
发生反应的溶液溶质质量分数的计算
例题:32.5 g锌粒与280 g稀硫酸恰好完全反应。试求:
(1)稀硫酸中溶质的质量分数。
(2)生成物溶液中溶质的质量分数。
Zn + H2SO4 = ZnSO4 + H2 ↑
P%=
m质
m液
×100%=
280
×100%
m质
=17.5%
65 98 161 2
32.5g
280g
X
65
32.5
=
98
X
X =49
●溶液中参与反应的是溶质;
●不能将溶液的质
量代入化学方程式
进 行计算。应代入
溶质的质量。
注意:
49
Y
P%=
m质
m液
×100%
根据质量守恒定律有:
m
Zn
+
m
H2SO4
=
m
H2
+
m
ZnSO4
32.5+280=
m
H2
+
m
ZnSO4
1
m
ZnSO4
=
311.5
65
32.5
=
2
W
W=1
65
32.5
=
161
Y
Y= 80.5
W
80.5
311.5
≈25.8%
5、100g某硫酸恰好与13 g锌完全起反应。试计算这种硫酸中溶质的质量分数。(H-1;S-32;O-16;Zn-65)
Zn + H2SO4 = ZnSO4 + H2↑
98
65
只有溶质参与反应
完全参与反应
X
13g
设参加反应的硫酸的溶质为X,则有:
65
13
=
98
X = 19.6g
X
所以硫酸中溶质的质量分数为:
P%=
×100%
m质
m液
=
×100%
19.6
100
= 19.6%
课后练习
溶质质量=( )x ( )
溶液质量=( ) ÷ ( )
溶液质量=( ) + ( )
溶液质量
溶液质量
溶质质量
溶剂质量
1.溶液中溶质的质量分数是 。溶液中溶质质量分数越大,说明溶液中溶质的相对含量越 (“高”或“低”)。
2.相关公式:
溶质质量分数=
( )
( )
X100%
3.某氯化镁溶液200g蒸干得到氯化镁10g,则该氯化镁溶液的溶质质量分数是 ;实验室需配制20%Na2CO3溶液200g,问需碳酸钠 g,水 g;10g氯化钠可配制成10%的氯化钠溶液 g。
溶质质量与溶液质量之比
高
溶质质量
溶液质量
溶质质量分数
溶质质量分数
5%
40
160
100
自学检测1(3分钟)
1.某氯化镁溶液200g蒸干得到氯化镁10g,则该氯化镁溶
液的溶质质量分数是 ;实验室需配制20%Na2CO3溶
液200g,问需碳酸钠 g,水 g;10g氯化钠可配制
成10%的氯化钠溶液 g。
2.20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液
的溶质质量分数。
3.20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质
量分数。
5%
40
160
100
学生自学,教师巡视2(6分钟)
增加溶质的质量,则溶质和溶液的质量同时增加。
增加溶剂的质量,则溶剂和溶液的质量同时增加。
剩余溶液的溶质质量分数不变,仍是 10 %
解:
20g X10%
加水:
20g +2g
=9.1%
加盐:
20g X10%+2g
20g +2g
=18.2%
2.20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
3.20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
自学检测2(3分钟)
二、 关于溶液中溶质的质量分数的计算
1.已知溶质和溶剂质量,求溶质的质量分数
2.已知溶液质量和溶质的质量分数,求溶质和溶剂的质 量
1.要配制500mL质量分数为10%的NaNO3溶液(密度为1.1 g/cm3),需要NaNO3和水质量各多少克?
(提示:想一想质量密度体积间的关系)
2.100g某稀硫酸恰好与13g锌完全起反应,试计算这种硫酸溶液中溶质的质量分数。(提示:写出化学方程式,代入方程式计算的为纯净物的质量,即溶质的质量)
3.20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
4.20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
学生自学,教师巡视2(6分钟)
1.要配制500mL质量分数为10%的NaNO3溶液(密度为1.1 g/cm3),需要NaNO3和水质量各多少克?
2.100g某稀硫酸恰好与13g锌完全起反应,试计算这种硫酸溶液中溶质的质量分数。
自学检测2(3分钟)
NaNO3的质量55g ,水的质量495g
19.6%
不能将溶液的质量代入化学方程式进行计算。应先将溶质的质量利用质量分数的表达式求出来。
点拨:溶液的质量=溶液的密度×溶液的体积
m=ρV
解:设这种硫酸溶液中溶质的质量为x
Zn +H2SO4 ═ ZnSO4 + H2↑
65 98
13g x
65:98=13g:x
X= 19.6g
答:略。
m(NaNO3)=500mL×1.1g/cm3×10%=55g
m(水)=500mL×1.1g/cm3-55g=495g
增加溶质的质量,则溶质和溶液的质量同时增加。
增加溶剂的质量,则溶剂和溶液的质量同时增加。
剩余溶液的溶质质量分数不变,仍是 10 %
解:
20g X10%
加水:
20g +2g
=9.1%
加盐:
20g X10%+2g
20g +2g
=18.2%
3.20g 10%的盐水中放入 2g水或2g食盐,求:所得溶液的溶质质量分数。
4.20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。
1.对“10%食盐溶液”含义的解释,一定正确的是( )
A.100g水中溶解了10g食盐
B.100g食盐溶液中含有10g食盐
C.将10g 食盐溶于90g水中所得溶液
D.食盐与溶液的质量之比是1:10
2. (t℃时该物质的溶解度为36g)
(1)t℃时,将10g某固体物质加入到50g 水中充分溶解,得到的溶液溶质质量分数为 。
(2)t℃时,将20g固体物质加入到50g 水中充分溶解,得到的溶液溶质质量分数为 。
(提示:想想50g水中最多溶解多少该溶质)
讨论1:
D
26.5%
溶质的质量是指已经溶解了那部分,没有溶解的不算在内。
点拨:
学生讨论,教师点拨2(8分钟)
16.7%
点拨:某温度下某物质的饱和溶液中,其溶质质量分数是固定值, 也是最大值。等于
3.用横坐标表示加入溶质的质量,纵坐标表示溶液的溶质质量分数,请绘制出溶质质量分数随加入溶质质量增多而变化的图像。
讨论2:
1.50℃时,氯化铵的溶解度为50g,求50℃时氯化铵饱和溶液中溶质的质量分数?(提示:50 ℃时,100g水中最多溶解氯化铵多少g?形成溶液多少g?)
2.t℃时,某固体物质的溶解度为S,则t℃时,该物质的饱和溶液中溶质的质量分数表示式 。
提示:t℃时,100 g水中最多溶解
该物质多少g?形成溶液多少g?
33.3%
溶质的质量分数36% 是指: 100g溶液中含有 溶质。
溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。溶液质量为
溶质质量分数与溶解度的比较
36g
136g
一定的温度、100克溶剂、达到饱和状态、单位:克
温度不一定、溶剂不定量、不一定饱和、无单位
溶质质量分数与溶解度的有没有什么联系呢?
点拨:溶质质量分数与溶解度的关系
溶质的质量分数=
溶质质量
溶液质量
=
溶解度
溶解度+100克
×100℅
×100℅
联系: 在一定温度下的饱和溶液中
溶解度(S) 溶质的质量分数
意义 定量地表示物质溶解能力的强弱 表示溶液中溶质质量与溶液质量之比
条件 一定的温度
100克溶剂
达到饱和状态 温度不一定
溶剂不定量
不一定饱和
单位 克 无单位(是比值)
当堂训练(15分钟)
1.某温度时,蒸干35g氯化钾溶液,得到10g 氯化钾,求该溶液中溶质质量分数。
2.农业生产中通常用10%-20%的食盐水来选种,现有配制好的15%的食盐水200kg,其中含水的质量为多少?
3.50g 质量分数为38%的盐酸与足量的大理石反应,生成二氧化碳的质量是多少?这些二氧化碳的体积(标准状况)是多少?(在标准状况下,二氧化碳的密度为1.997gL)
4.已知20 ℃时某饱和溶液溶质质量分数为20%,求该温度下该物质的溶解度 。
25g
28.6%
170g
11.45g
5.73L
5.
D
6.60℃时,100g硝酸钾的饱和溶液,恒温蒸发部分溶剂,再将溶液逐渐冷却到40℃。能表示此过程溶质质量分数a%与时间t关系的是( )
t
a %
0
A
t
a %
0
B
t
a %
0
C
t
a %
0
D
A
7.右图是A、B、C三种物质
的溶解度曲线,据图回答:
t1℃时A、B、C三种物
质的溶解度由大到小的顺序
是 (填序号,下同)
(2) t1℃时30gA物质加入到
50g水中不断搅拌,形成的溶
液质量是 g。
(3) 将t1℃时A、B、C三种物质饱和溶液的温度升高到t2时,三种溶液的溶质质量分数由大小关系是 。
(选做题)
B>C>A
65
B>C>A
1、下列叙述中正确的是( )
对于易溶物,浓度很大时,不一定达到饱和。
A、浓度大的溶液一定是饱和溶液
B、饱和溶液的浓度一定大
C、通过溶液中溶质的质量分数可以换算出该溶质的溶解度
D、通过饱和溶液中溶质的溶解度可以换算出该溶质的质量分数
对于不易溶的物质,浓度很稀时就可能已经饱和。
只有饱和溶液时,才能进行二者的换算。
√
D
综合练习
2. 将20 gKNO3溶于70 g水中,所得溶液中溶质的质量分数是多少?
3. 100 g30%的氢氧化钠溶液中溶质的质量是多少?
4. 将10 gKCl溶于100 g水中,所得溶液中溶质的质量分数是多少?
6. 20?C时食盐的溶解度是36 g,求该温度下食盐饱和溶液中溶质的质量分数。
8. 将40 g质量分数为20%的氯化钠溶液与60 g质量分数为30%的氯化钠溶液混合,所得溶液中溶质的质量分数是多少?
7. 配制质量分数为20%的氢氧化钠溶液100 g,需质量分数为80%的氢氧化钠溶液的质量是多少?
[引导讨论]:将一烧杯150克CuSO4溶液分成三等份。
1、每一份溶液的浓度是否改变?
2、向第1份溶液中加入10g水,其溶质、
溶剂、溶液的浓度是否改变?
3、将第二份溶液蒸发掉10 g水
4、向第3份溶液中加入5g CuSO4,完
全溶解后,其溶质、溶剂、溶液的浓度是否改变?
减少
减少
减少
不变
不变
增加
增加
变稀
不变
减少
减少
变浓
增加
不变
增加
变浓
溶质质量 溶剂质量 溶液质量 溶液浓度
每一份
加水10g
蒸去水
加入5g CuSO4
自我检测
10g
10%
80g
20%
NaCl溶液 水 NaCl固体 溶质的质量分数
100g 90g
100g 20g
200g 15%
380g 20g
20℃时某氯化钠溶液中溶质的质量分数为20%
(1) 此时溶液中溶质、溶剂和溶液的质量比为多少?
(2)若将100克此溶液分为二等份,则每一份溶液中溶质的质量分数为多少?
(3)向其中一份中加入10g水,则溶质的质量分数为多少?
(4)向另一份中加入2gNaCl固体全部溶解,则溶液中溶质的质量分数为多少?
20℃时某氯化钠溶液中溶质的质量分数为20%
(5)若从100g此溶液中取出5g溶液,则剩余溶液中溶质的质量分数为多少?
(6)若将其中一份溶液升温到40℃时,溶质的质量分数为多少?
(7)若要让100g的此溶液溶质的质量分数减半,则需加水多少克?
练一练
1、将200 g含水99%的食盐溶液的含水量变为98%,应蒸发掉水 g。
2、一份溶质的质量分数为2%的氯化钠溶液,蒸发掉40 g水后,其溶质的质量分数为10%,则原溶液的质量为 ( )
A. 200g B. 150g C. 100g D. 50g
100
D
练习:
1. 取10gNaCl溶于90g的水中,所得溶液的溶质质量分数为:_________
10%
3.已知t?C时NaCl的溶解度为a克,则t?C时饱和溶液溶质的质量分数为_______
2.180克10%的NaOH溶液加入①20克NaOH ②20克水,所得溶液的溶质质量分数分别是多少?
练习:
1.配制80克10%的硝酸钾溶液,需硝酸钾和水的质量分别为___克和___克。
2.配制a克质量分数为b%的氯化钠溶液,需氯化钠为____克,水为________克。
8
72
ab%
a-ab%
总结:配制(溶质质量分数一定的)溶液的步骤
例:配制50克质量分数为 6%的氯化钠溶液
步骤:1.计算:需氯化钠___克,水___克。
3
47
2.称量:固体
3.溶解:量取液体,溶解固体。
3、40g 2%的食盐溶液中含有 多少g食盐和水?
40 × 2% =
m质
×100%
P%=
m液
2
×100%=
=
20
10%
m质=
m液
×
P%=
40g – 0.8 g=
0.8g
m液—
m质=
m剂=
39.2 g
当堂练习
2、20g食盐溶液中含有 2g食盐,求:溶质的质量分数?
1、生理盐水是溶质质量分数为0.9%的氯化钠溶液,现用1000g生理盐水给病人输液,进入病人体内的氯化钠的质量为多少?水的质量是多少?
m质
=
m液
× P%
=
1000Kg
× 0.9%
= 9Kg
m液
=
-m质
m剂
= 1000-9
= 991Kg
4、从一瓶氯化钾的溶液中取出20g溶液蒸干后得到2.8g氯化钾固体,求这瓶溶液溶质的质量分数。
m质
×100%
P%=
m液
2.8
×100%=
=
20
14%
当堂练习
5、配制20mL10%的NaOH溶液(密度为1.1g/cm3) 需要NaOH 和水各多少克?
m质
=
m液
×P%
=
( )
× P%
=
ρ·v
( )
1.1
×
20
×
10%
=2.2g
m液
=
-m质
m剂
=
—2.2
( )
ρ·v
=
( )
1.1
×
20
—2.2
=19.8g
6、现有70g10%的硝酸钾溶液:
①若蒸发30g水且无晶体析出,此时溶液的质量分数为多少?
②若加入15g硝酸钾晶体并完全溶解,此时溶质的质量分数又为多少?
当堂练习
P%=
×100%
m质
m液
=
×100%
70×10%
70
=17.5%
—30
P%=
×100%
m质
m液
=
×100%
70×10%
70
+15
+15
25.9%
≈
9、20g 10%的盐水中倒出一半,求:溶质的质量分数。
溶液的浓度不变,仍是 10 %
8、20g 10%的盐水中放入 2g食盐,求:溶质的质量分数。
m质
×100%
P%=
m液
20×10%
×100%
=
20
9.1%
+
2
m质
×100%
P%=
m液
20×10%
×100%=
=
20
18.2%
+
2
+
2
≈
7、20g 10%的盐水中放入 2g水,求:溶质的质量分数。
当堂练习
同课章节目录
