科粤版化学九年级下册 8.4 常见的盐 第2课时 盐的化学性质 复分解反应发生的条件课件 (共30张PPT)
文档属性
| 名称 | 科粤版化学九年级下册 8.4 常见的盐 第2课时 盐的化学性质 复分解反应发生的条件课件 (共30张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-23 21:02:22 | ||
图片预览









文档简介
(共30张PPT)
第八章 常见的 酸、碱、盐
8.4 常见的盐
第2课时 盐的化学性质 复分解反应发生的条件
学习目标
1、回顾酸、碱、金属的化学性质的基础上总结出盐的化学性质;
2、根据复分解反应发生的条件,判断一些常见酸、碱、盐之间的反应能否发生。
氢氧化钠(碱)和稀盐酸(酸)发生了反应,生成?
NaOH + HCl === NaCl + H2O
碱
酸
水
?
盐
回顾复习
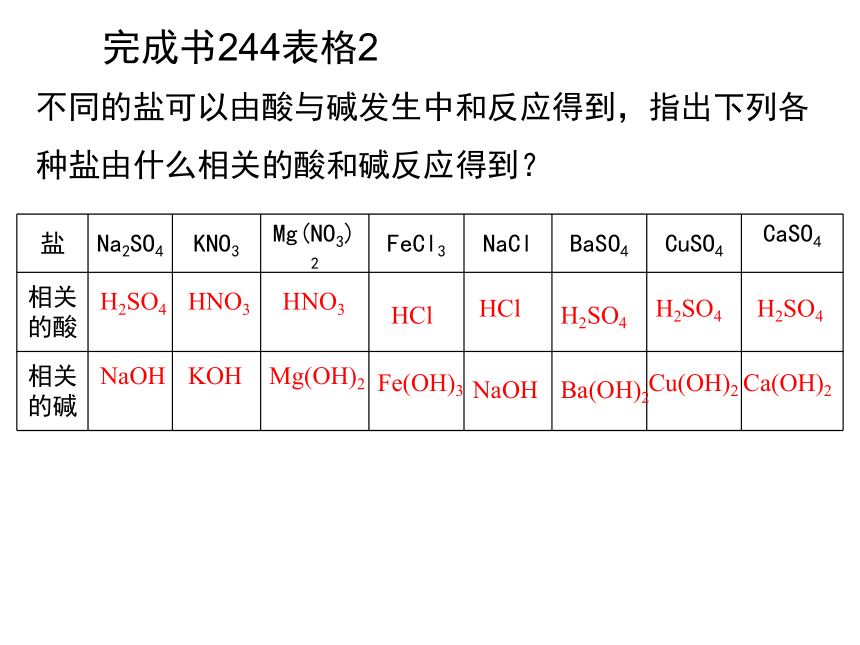
不同的盐可以由酸与碱发生中和反应得到,指出下列各种盐由什么相关的酸和碱反应得到?
H2SO4
HNO3
HNO3
HCl
HCl
NaOH
KOH
Mg(OH)2
Fe(OH)3
NaOH
Ba(OH)2
Cu(OH)2
H2SO4
H2SO4
完成书244表格2
H2SO4
Ca(OH)2
盐 Na2SO4 KNO3 Mg(NO3)2 FeCl3 NaCl BaSO4 CuSO4 CaSO4
相关的酸
相关的碱
由 和 组成的化合物通称为盐。
根据阳离子的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。(氯化钠为钠盐)
根据阴离子的不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。(氯化钠为盐酸盐)
注:铵根离子和酸根离子组成的化合物也属于盐(铵盐)
NH4Cl NH4NO3 (NH4)2SO4
金属离子
酸根离子
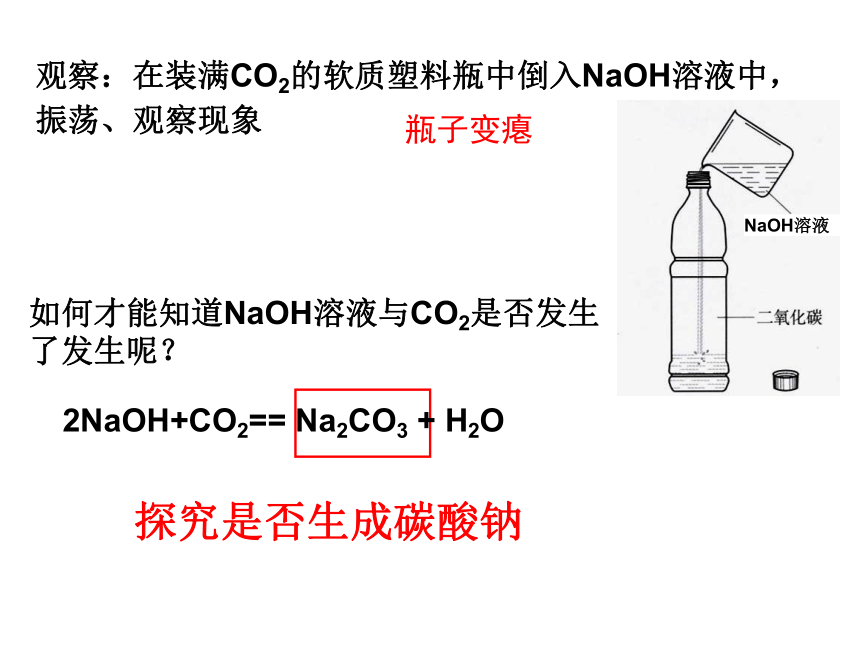
如何才能知道NaOH溶液与CO2是否发生了发生呢?
观察:在装满CO2的软质塑料瓶中倒入NaOH溶液中,振荡、观察现象
2NaOH+CO2== Na2CO3 + H2O
探究是否生成碳酸钠
瓶子变瘪
Na2CO3+2HCl == 2NaCl+H2O+CO2↑
取瓶中液体滴加足量的稀盐酸(或稀硫酸)现象:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
1.盐与酸的反应
练习:写出碳酸钙与盐酸反应、硝酸银与盐酸反应、氯化钡与硫酸反应
有气泡
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
AgNO3 + HCl == AgCl↓ + HNO3
BaCl2 + H2SO4 == BaSO4 ↓ + 2HCl
盐 + 酸 →
新盐 + 新酸
取瓶中液体滴加Ca(OH)2溶液或Ba(OH)2溶液 现象:
有白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
练习:写出硫酸铜与氢氧化钙反应
氯化铁与氢氧化钠反应
CuSO4 + Ca(OH)2 === Cu(OH)2↓ + CaSO4
FeCl3 + 3NaOH === Fe(OH)3↓ + 3NaCl
盐 + 碱 →
2.盐与碱的反应
新盐 + 新碱
取瓶中液体滴加CaCl2溶液或BaCl2溶液 现象:
有白色沉淀
Na2CO3+CaCl2=CaCO3↓+2NaCl
方程式:
Na2CO3+BaCl2=BaCO3↓+2NaCl
3.盐与盐的反应
练习:写出氯化钡与硫酸钠反应、硝酸钡与硫酸钠反应、硝酸银与氯化钠反应
BaCl2 + Na2SO4 == BaSO4 ↓ + 2NaCl
Ba(NO3)+ Na2SO4 == BaSO4 ↓ + 2NaNO3
AgNO3 + NaCl == AgCl ↓ + NaNO3
盐 + 盐 →
新盐 + 新盐
4.盐与某些金属反应
复习:⑴ 将无锈的铁钉放到CuSO4溶液中
实验现象:
铁钉表面有红色固体生成
Fe + CuSO4 = FeSO4 +Cu
⑵ 将铜片放到AgNO3溶液中
铜片表面有银白色固体析出,溶液由无色变蓝色
实验现象:
Cu+2AgNO3 = Cu(NO3)2+2Ag
盐 + 金属 → 新盐 + 新金属
⑴金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来。⑵单质铁在发生置换反应时一般生成亚铁盐。⑶钾、钙、钠化学性质很活泼,在盐溶液中不能置换其它金属。
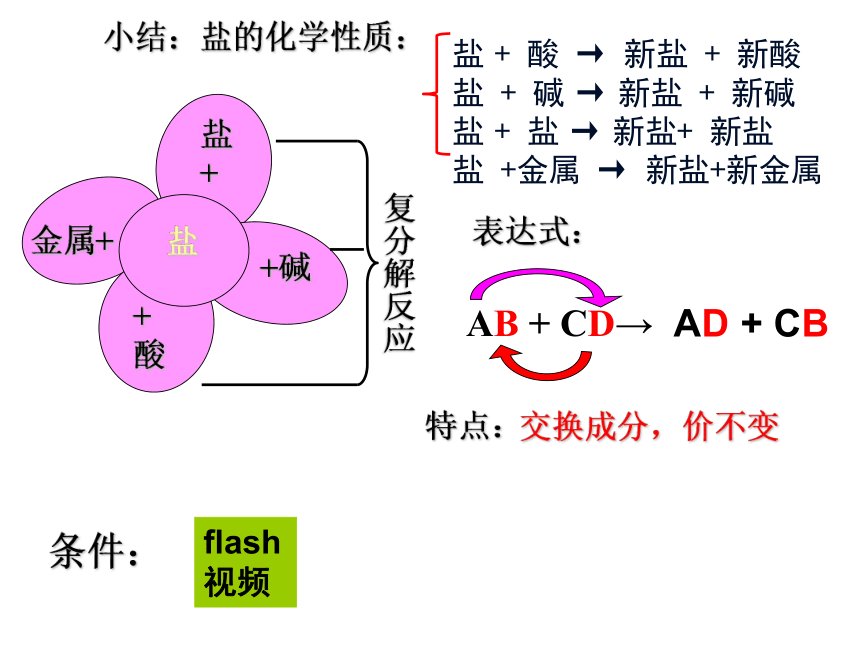
小结:盐的化学性质:
盐
+
酸
+碱
盐
+
金属+
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
盐 + 盐 → 新盐+ 新盐
盐 +金属 → 新盐+新金属
复分解反应
表达式:
AB + CD→
AD
+ CB
特点:
交换成分,价不变
条件:
flash视频
Na2CO3+2HCl == 2NaCl+H2O+CO2↑
取瓶中液体滴加足量的稀盐酸(或稀硫酸)现象:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
1.盐与酸的反应
练习:写出碳酸钙与盐酸反应、硝酸银与盐酸反应、氯化钡与硫酸反应
有气泡
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
AgNO3 + HCl == AgCl↓ + HNO3
BaCl2 + H2SO4 == BaSO4 ↓ + 2HCl
盐 + 酸 →
新盐 + 新酸
取瓶中液体滴加Ca(OH)2溶液或Ba(OH)2溶液 现象:
有白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
练习:写出硫酸铜与氢氧化钙反应
氯化铁与氢氧化钠反应
CuSO4 + Ca(OH)2 === Cu(OH)2↓ + CaSO4
FeCl3 + 3NaOH === Fe(OH)3↓ + 3NaCl
盐 + 碱 →
2.盐与碱的反应
新盐 + 新碱
取瓶中液体滴加CaCl2溶液或BaCl2溶液 现象:
有白色沉淀
Na2CO3+CaCl2=CaCO3↓+2NaCl
方程式:
Na2CO3+BaCl2=BaCO3↓+2NaCl
3.盐与盐的反应
练习:写出氯化钡与硫酸钠反应、硝酸钡与硫酸钠反应、硝酸银与氯化钠反应
BaCl2 + Na2SO4 == BaSO4 ↓ + 2NaCl
Ba(NO3)2+ Na2SO4 == BaSO4 ↓ + 2NaNO3
AgNO3 + NaCl == AgCl ↓ + NaNO3
盐 + 盐 →
新盐 + 新盐
小结:盐的化学性质:
盐
+
酸
+碱
盐
+
金属+
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
盐 + 盐 → 新盐+ 新盐
盐 +金属 → 新盐+新金属
复分解反应
表达式:
AB + CD→
AD
+ CB
特点:
交换成分,价不变
条件:
生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
NaOH + BaCl2 —
NaCl + Ba(OH)2
不反应
Na+、OH-
Ba2+、Cl-
Ba2+ 、OH-
Na+、Cl-
反应前
反应后
溶液中离子种类没有改变
讨论:请预测以下反应能否发生?
生成物中没有沉淀或气体或水生成
H+、SO42-
Na+、CO3 2 -
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
H2SO4 + Na2CO3
Na2SO4+ + H2O
反应
=
生成物中有气体有水生成
讨论:请预测以下反应能否发生?
D
下列化学反应属复分解反应的是( )
小试牛刀
一次,葛洪之妻鲍姑用铁勺盛曾青(硫酸铜溶液),几天后,葛洪拿那铁勺使用,奇妙的现象出现了:铁勺变成“铜勺”了,红光闪闪的。葛洪的徒弟高兴得跳起来。
“点铁成金啦!”
反应原理:
Fe + CuSO4 == FeSO4 + Cu
《山中探险》
?“探险队员”—硫酸铜,不小心走进了有许多“吃人的野兽”(即能与硫酸铜发生化学反应的物质)的小山,请你帮助它走出小山(请用图中物质前的序号连接起来表示所走的路线):
入口→???????? →????????? →?????????? →?????????? →出口。
学以致用
CuSO4溶液
《山中探险》
CuSO4溶液
《山中探险》
酸
盐
酸
盐
盐
碱
碱
碱
说出生成盐的反应
【思考】写出生成MgCl2的反应(原料任选)
1.下列物质按酸、碱、盐顺序排列的是 ? ?
A. Mg(OH)2、CuSO4、H2CO3 B. HNO3、KOH、NaCl
C. CaCO3、NaOH、H3PO4 D. H2SO4、KNO3、NaOH
过关斩将
B
C
1、NaOH + H2SO4==
2、FeCl3 + NaOH ==
3 3 NaCl + Fe(OH)3↓
3、CaCO3 + HCl ==
2 CaCl2 + CO2 ↑+ H2O
4、NaCl + CuSO4 ==
CuCl2 + Na2SO4
要满足什么条件才可以反应?
过关斩将
写出下列方程式,不能反应的说明原因
Fe+CuSO4===FeSO4+Cu
置换反应
产生蓝色沉淀
复分解反应
过关斩将
(1) “烧碱同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过,如图: 请你用“连续线”画出烧碱应走的路线。
(2)写出刚进迷宫的两个方程式:
作业:
课本247页6、7题
第八章 常见的 酸、碱、盐
8.4 常见的盐
第2课时 盐的化学性质 复分解反应发生的条件
学习目标
1、回顾酸、碱、金属的化学性质的基础上总结出盐的化学性质;
2、根据复分解反应发生的条件,判断一些常见酸、碱、盐之间的反应能否发生。
氢氧化钠(碱)和稀盐酸(酸)发生了反应,生成?
NaOH + HCl === NaCl + H2O
碱
酸
水
?
盐
回顾复习
不同的盐可以由酸与碱发生中和反应得到,指出下列各种盐由什么相关的酸和碱反应得到?
H2SO4
HNO3
HNO3
HCl
HCl
NaOH
KOH
Mg(OH)2
Fe(OH)3
NaOH
Ba(OH)2
Cu(OH)2
H2SO4
H2SO4
完成书244表格2
H2SO4
Ca(OH)2
盐 Na2SO4 KNO3 Mg(NO3)2 FeCl3 NaCl BaSO4 CuSO4 CaSO4
相关的酸
相关的碱
由 和 组成的化合物通称为盐。
根据阳离子的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。(氯化钠为钠盐)
根据阴离子的不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。(氯化钠为盐酸盐)
注:铵根离子和酸根离子组成的化合物也属于盐(铵盐)
NH4Cl NH4NO3 (NH4)2SO4
金属离子
酸根离子
如何才能知道NaOH溶液与CO2是否发生了发生呢?
观察:在装满CO2的软质塑料瓶中倒入NaOH溶液中,振荡、观察现象
2NaOH+CO2== Na2CO3 + H2O
探究是否生成碳酸钠
瓶子变瘪
Na2CO3+2HCl == 2NaCl+H2O+CO2↑
取瓶中液体滴加足量的稀盐酸(或稀硫酸)现象:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
1.盐与酸的反应
练习:写出碳酸钙与盐酸反应、硝酸银与盐酸反应、氯化钡与硫酸反应
有气泡
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
AgNO3 + HCl == AgCl↓ + HNO3
BaCl2 + H2SO4 == BaSO4 ↓ + 2HCl
盐 + 酸 →
新盐 + 新酸
取瓶中液体滴加Ca(OH)2溶液或Ba(OH)2溶液 现象:
有白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
练习:写出硫酸铜与氢氧化钙反应
氯化铁与氢氧化钠反应
CuSO4 + Ca(OH)2 === Cu(OH)2↓ + CaSO4
FeCl3 + 3NaOH === Fe(OH)3↓ + 3NaCl
盐 + 碱 →
2.盐与碱的反应
新盐 + 新碱
取瓶中液体滴加CaCl2溶液或BaCl2溶液 现象:
有白色沉淀
Na2CO3+CaCl2=CaCO3↓+2NaCl
方程式:
Na2CO3+BaCl2=BaCO3↓+2NaCl
3.盐与盐的反应
练习:写出氯化钡与硫酸钠反应、硝酸钡与硫酸钠反应、硝酸银与氯化钠反应
BaCl2 + Na2SO4 == BaSO4 ↓ + 2NaCl
Ba(NO3)+ Na2SO4 == BaSO4 ↓ + 2NaNO3
AgNO3 + NaCl == AgCl ↓ + NaNO3
盐 + 盐 →
新盐 + 新盐
4.盐与某些金属反应
复习:⑴ 将无锈的铁钉放到CuSO4溶液中
实验现象:
铁钉表面有红色固体生成
Fe + CuSO4 = FeSO4 +Cu
⑵ 将铜片放到AgNO3溶液中
铜片表面有银白色固体析出,溶液由无色变蓝色
实验现象:
Cu+2AgNO3 = Cu(NO3)2+2Ag
盐 + 金属 → 新盐 + 新金属
⑴金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来。⑵单质铁在发生置换反应时一般生成亚铁盐。⑶钾、钙、钠化学性质很活泼,在盐溶液中不能置换其它金属。
小结:盐的化学性质:
盐
+
酸
+碱
盐
+
金属+
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
盐 + 盐 → 新盐+ 新盐
盐 +金属 → 新盐+新金属
复分解反应
表达式:
AB + CD→
AD
+ CB
特点:
交换成分,价不变
条件:
flash视频
Na2CO3+2HCl == 2NaCl+H2O+CO2↑
取瓶中液体滴加足量的稀盐酸(或稀硫酸)现象:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
1.盐与酸的反应
练习:写出碳酸钙与盐酸反应、硝酸银与盐酸反应、氯化钡与硫酸反应
有气泡
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
AgNO3 + HCl == AgCl↓ + HNO3
BaCl2 + H2SO4 == BaSO4 ↓ + 2HCl
盐 + 酸 →
新盐 + 新酸
取瓶中液体滴加Ca(OH)2溶液或Ba(OH)2溶液 现象:
有白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
练习:写出硫酸铜与氢氧化钙反应
氯化铁与氢氧化钠反应
CuSO4 + Ca(OH)2 === Cu(OH)2↓ + CaSO4
FeCl3 + 3NaOH === Fe(OH)3↓ + 3NaCl
盐 + 碱 →
2.盐与碱的反应
新盐 + 新碱
取瓶中液体滴加CaCl2溶液或BaCl2溶液 现象:
有白色沉淀
Na2CO3+CaCl2=CaCO3↓+2NaCl
方程式:
Na2CO3+BaCl2=BaCO3↓+2NaCl
3.盐与盐的反应
练习:写出氯化钡与硫酸钠反应、硝酸钡与硫酸钠反应、硝酸银与氯化钠反应
BaCl2 + Na2SO4 == BaSO4 ↓ + 2NaCl
Ba(NO3)2+ Na2SO4 == BaSO4 ↓ + 2NaNO3
AgNO3 + NaCl == AgCl ↓ + NaNO3
盐 + 盐 →
新盐 + 新盐
小结:盐的化学性质:
盐
+
酸
+碱
盐
+
金属+
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
盐 + 盐 → 新盐+ 新盐
盐 +金属 → 新盐+新金属
复分解反应
表达式:
AB + CD→
AD
+ CB
特点:
交换成分,价不变
条件:
生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
NaOH + BaCl2 —
NaCl + Ba(OH)2
不反应
Na+、OH-
Ba2+、Cl-
Ba2+ 、OH-
Na+、Cl-
反应前
反应后
溶液中离子种类没有改变
讨论:请预测以下反应能否发生?
生成物中没有沉淀或气体或水生成
H+、SO42-
Na+、CO3 2 -
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
H2SO4 + Na2CO3
Na2SO4+ + H2O
反应
=
生成物中有气体有水生成
讨论:请预测以下反应能否发生?
D
下列化学反应属复分解反应的是( )
小试牛刀
一次,葛洪之妻鲍姑用铁勺盛曾青(硫酸铜溶液),几天后,葛洪拿那铁勺使用,奇妙的现象出现了:铁勺变成“铜勺”了,红光闪闪的。葛洪的徒弟高兴得跳起来。
“点铁成金啦!”
反应原理:
Fe + CuSO4 == FeSO4 + Cu
《山中探险》
?“探险队员”—硫酸铜,不小心走进了有许多“吃人的野兽”(即能与硫酸铜发生化学反应的物质)的小山,请你帮助它走出小山(请用图中物质前的序号连接起来表示所走的路线):
入口→???????? →????????? →?????????? →?????????? →出口。
学以致用
CuSO4溶液
《山中探险》
CuSO4溶液
《山中探险》
酸
盐
酸
盐
盐
碱
碱
碱
说出生成盐的反应
【思考】写出生成MgCl2的反应(原料任选)
1.下列物质按酸、碱、盐顺序排列的是 ? ?
A. Mg(OH)2、CuSO4、H2CO3 B. HNO3、KOH、NaCl
C. CaCO3、NaOH、H3PO4 D. H2SO4、KNO3、NaOH
过关斩将
B
C
1、NaOH + H2SO4==
2、FeCl3 + NaOH ==
3 3 NaCl + Fe(OH)3↓
3、CaCO3 + HCl ==
2 CaCl2 + CO2 ↑+ H2O
4、NaCl + CuSO4 ==
CuCl2 + Na2SO4
要满足什么条件才可以反应?
过关斩将
写出下列方程式,不能反应的说明原因
Fe+CuSO4===FeSO4+Cu
置换反应
产生蓝色沉淀
复分解反应
过关斩将
(1) “烧碱同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过,如图: 请你用“连续线”画出烧碱应走的路线。
(2)写出刚进迷宫的两个方程式:
作业:
课本247页6、7题
