9.2溶解度 (共33张PPT)
图片预览








文档简介
(共33张PPT)
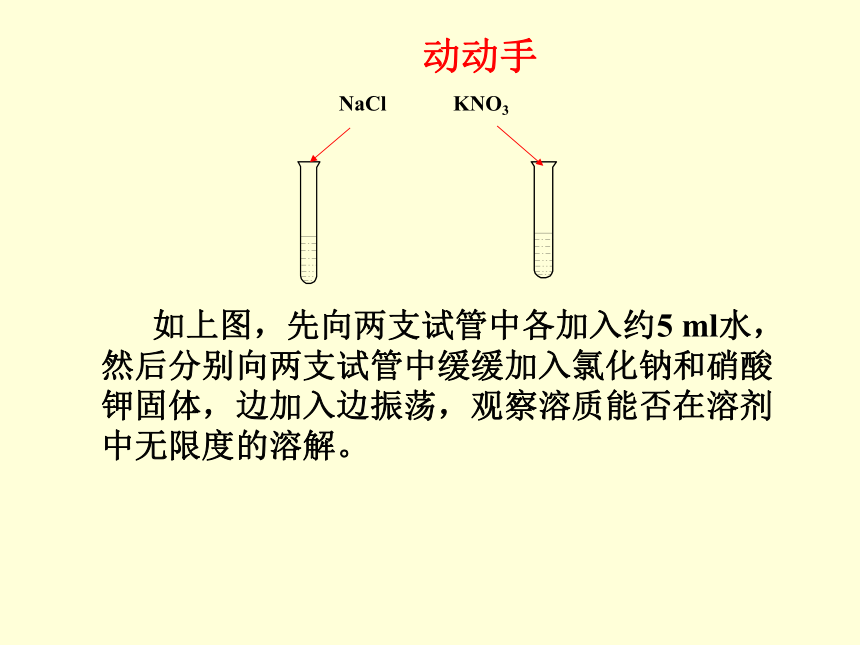
动动手
如上图,先向两支试管中各加入约5 ml水,然后分别向两支试管中缓缓加入氯化钠和硝酸钾固体,边加入边振荡,观察溶质能否在溶剂中无限度的溶解。
一、饱和溶液与不饱和溶液
1、饱和溶液:在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
2、不饱和溶液:在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
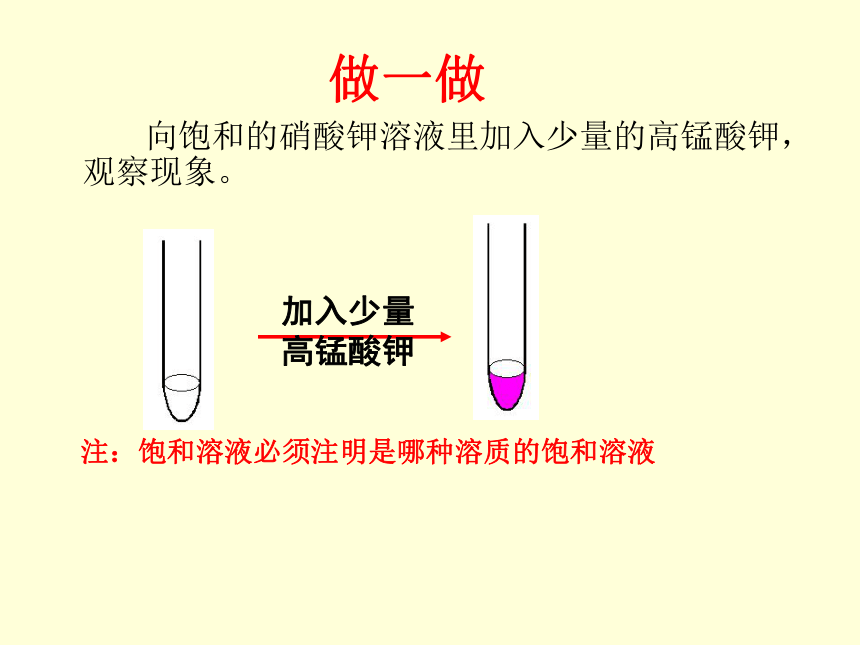
做一做
向饱和的硝酸钾溶液里加入少量的高锰酸钾,观察现象。
注:饱和溶液必须注明是哪种溶质的饱和溶液
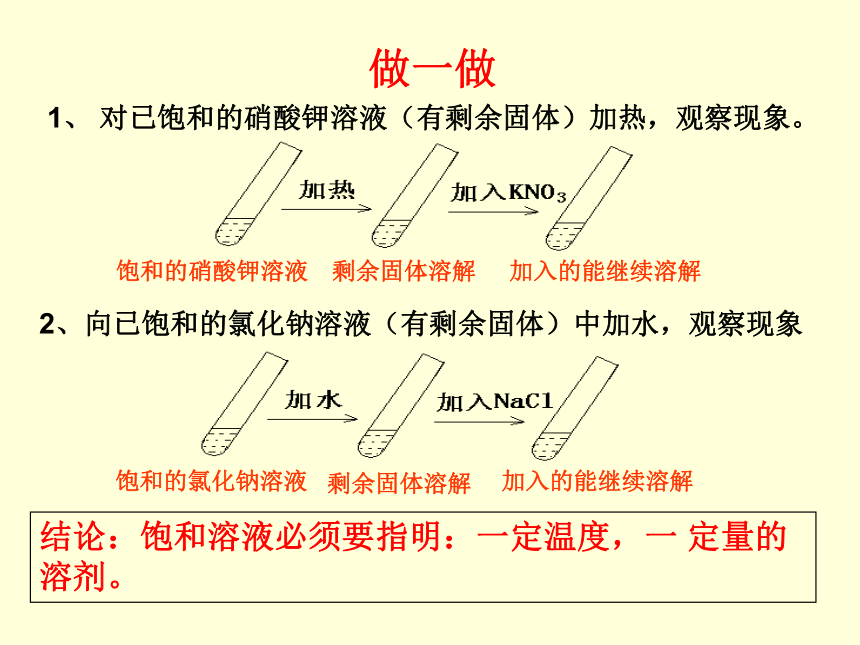
做一做
1、 对已饱和的硝酸钾溶液(有剩余固体)加热,观察现象。
剩余固体溶解
加入的能继续溶解
饱和的硝酸钾溶液
2、向已饱和的氯化钠溶液(有剩余固体)中加水,观察现象
加入的能继续溶解
剩余固体溶解
饱和的氯化钠溶液
结论:饱和溶液必须要指明:一定温度,一 定量的溶剂。
饱和溶液与不饱和溶液的转化
饱和溶液 不饱和溶液
升高温度 、增加溶剂
降低温度、增加溶质、蒸发溶剂
对于大多数固体:
练习:在其他条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到饱和溶液,下列措施达不到目的的是 ( )
(A)降低溶液温度; (B)加入溶质硝酸钾;
(C)升高溶液的温度; (D)蒸发溶液中的溶剂。
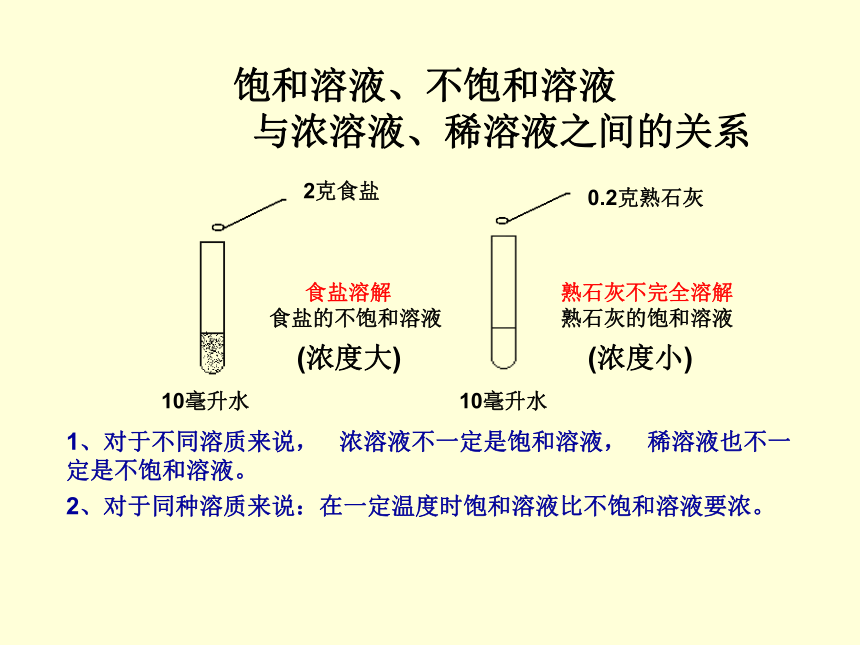
饱和溶液、不饱和溶液
与浓溶液、稀溶液之间的关系
(浓度大)
(浓度小)
食盐溶解
食盐的不饱和溶液
10毫升水
10毫升水
熟石灰不完全溶解
熟石灰的饱和溶液
0.2克熟石灰
2克食盐
1、对于不同溶质来说, 浓溶液不一定是饱和溶液, 稀溶液也不一 定是不饱和溶液。
2、对于同种溶质来说:在一定温度时饱和溶液比不饱和溶液要浓。
二、溶解度
1、固体物质溶解度(通常用S表示)
在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
四要素
条件:在一定温度下
标准:在100克溶剂中
状态:达到饱和状态
单位:克
20℃时,硝酸钾的溶解度是31.6克的意义?
20℃时,硝酸钾的溶解度是31.6克的意义?
20℃时,100克水中最多能溶解硝酸钾的质量为31.6克。
20℃时,100克水中溶了31.6克的硝酸钾就达到饱和状态。
你会判断吗?
(1)20克A物质溶解在100克水中恰好配成饱和溶液,A的溶解度是20克。
(2) 20℃ ,20克A物质溶解在水中配成饱和溶液, 20℃ 时A的溶解度是20克。
(3) 20℃ ,20克A物质溶解在水中配成饱和溶液, 20℃ 时A的溶解度是20克。
(4)20℃ ,20克A物质溶解在水中配成100克饱和溶液,则 20℃ 时A的溶解度是20克。
2、20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
1、在200C时,氯化钾的溶解度是33g,则在200C时,100克水溶解氯化钾_______g可达到饱和。
练一练
20℃
100 g
温度 溶质的质量 溶剂的质量 溶液的质量
2、溶解度与溶解性的关系
易溶
可溶
微溶
难(不)溶
练一练 1、20 ℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。 2、20℃时氯化钠的溶解度是36 g,则氯化钠属于( )
A.易溶 物质 B.可溶物质
C.微溶物质 D.难溶物质
3、溶解度曲线
用纵坐标表示溶解度,用横坐标表示温度。
几种固体物质溶解度曲线
熟石灰的溶解度随温度升高而降低
从溶解度曲线上获取的信息(一)
大多数固体物质的溶解度随着温度的升高而增大。(如硝酸钾)
少数物质的溶解度受温度变化的影响较小。 (如食盐)
极少数物质的溶解度随温度的升高而减小 。 (如熟石灰)
影响固体物质溶解度的主要因素是:温度
从溶解度曲线上获取的信息(二)
点:某物质在某一温度下 的溶解度
线:某物质溶解度受温度的变化情况
交点:曲线的交点表示这两种物质在该温度下的溶解度相同
1、如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是 。
(2)当温度为t1?C,三种物质溶解度由小到大依次为 ,当为t3?C时,溶解度最大的是 。
复习巩固
1、如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是 。
(2)当温度为t1?C,三种物质溶解度由小到大依次为 ,当为t3?C时,溶解度最大的是 。
复习巩固
t2?C时,A和C物质溶解度相等
CAB
A
2、右图是A.B两种物质的溶解度曲线,试回答下列问题
(1)t1?C时,A 的溶解度 B 的溶解度。(填< > 或=)
(2)A、B两物质饱和溶液溶质的质量分数相等的温度是 C。
(3)当A、B两物质的溶液接近饱和时,采用增加溶质、蒸发溶剂、降低温度的方法可以达到饱和的是 物质的溶液。
3、右图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。
现有t2 ℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据右图回答:
(1 )t2 ℃时,将三种饱和溶液分别恒温蒸发相同质量的水,析出晶体最多的是 ;
(2)将三种饱和溶液分别从t2 ℃降温到t1℃时,所得溶液中溶质的质量分数由大到小的顺序 。
(1)定义:在压强为101KPa、一定温度时溶解在1体积
水里达到饱和状态时的气体体积。
2、气体物质的溶解度
讨论:气体的溶解度与什么有关系呢?回答以下问题 找出答案。
(1)打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
(2)喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
(2) 影响气体溶解度的因素:
温度、压强
1、 增大二氧化碳在水中的溶解度的方法( )
A. 升温增压; B. 升温减压; C. 降温增压; D. 降温减压。
2、下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳 溶解度随温度的升高而增大的是( ) A.①② B.③④ C.①③④ D.只有①
想一想:
【例1】右图是甲、乙两种固体物质的溶解度曲线。下列说法中正确的是 ( )
A.乙物质的溶解度受温度变化的影响较小,甲物质的溶解度受温度变化的影响较大
B.30℃时,甲的饱和溶液中溶质的质量分数为30%
C.甲的溶解度大于乙的溶解度
D.甲中含有少量乙时,用蒸发溶剂的方法提纯甲
例题解析
【例2】甲、乙两种固体物质的溶解度曲线如图所示。现有两烧杯分别盛有60 ℃甲的饱和溶液和乙的饱和溶液,且两烧杯中均有未溶解的固体,现将温度从60 ℃降到20 ℃。下列说法正确的是 ( )
A.甲乙溶液中溶质质量分数都减少
B.甲乙溶解度随温度降低而减小
C.烧杯中甲固体质量增加,乙固体质量减少
D.甲溶液质量减少,乙溶液质量变大且一定是饱和溶液
【例3】下图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水) ( )
A.从N→M:先向N中加入适量固体A再降温
B.从N→M:先将N降温再加入适量固体A
C.从M→N:先将M降温再将其升温
D.从M→N:先将M升温再将其蒸发掉部分水
【例4】下图是a、b两种固体物质的溶解度曲线,下列说法正确的是( )
A.10 ℃时,a的溶解度大于b的溶解度
B.t℃时,a、b两种饱和溶液的溶质质量分数相同
C.随着温度的升高,溶解度变化较大的物质是b
D.将b溶液由10 ℃升温至30 ℃时变为饱和溶液
【例5】甲、乙两种固体纯净物的溶解度曲线如图A所示。在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里(图B)。下列说法正确的是( )
A.乙溶液中溶质的质量分数增大
B.装甲溶液的试管中剩余的固体减少
C.试管里甲、乙物质的溶解度都增大
D.两支试管里剩余的固体都增多
【例6】右图是a、b、c、d四种固体物质的溶解度曲线; 下表是这些固体物质在部分温度时的溶解度。
根据图表信息判断下列说法正确的是( )
A.图中a曲线表示KNO3的溶解度曲线
B.b的溶解度小于a的溶解度
C.要从a与d的混合物中得到a,通常采用蒸发溶剂使其结晶的方法
D.KCl的不饱和溶液由60℃降温至10℃时变成饱和溶液
【例7】向200 ℃的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是 ( )
A.溶液温度末冷却到200 ℃时,溶液一定是饱和溶液
B.溶液温度末冷却到200 ℃时,溶质质量分数比甲溶液大
C.溶液温度恢复到200 ℃时,溶液质量比甲溶液小
D.溶液温度恢复到200 ℃时,溶液的溶质质量分数和甲溶液的相等
【例8】右图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为正确的是 ( )
A.t1℃时,M、N两物质溶液溶质质量分数相等
B.由t1℃升温到t2℃时,N物质溶液溶质质量分数不变
C.M物质的溶解度大于N物质的溶解度
D.N物质的溶解度随温度的升高而降低
【例9】图1可表示“M与N的并列关系”,图2可表示“M属于N的从属关系”。下列概念间的关系符合图3所示关系的是 ( )
X Y Z
A. 溶质 溶剂 溶液
B. 悬浊液 乳浊液 溶液
C. 氧化物 酸碱盐 化合物
D. 饱和溶液 不饱和溶液 浓溶液
溶解度
溶解性
物质的溶解度
①一定温度
②100克溶剂
③溶液饱和
④单位是克
易溶 、 可溶 、 微溶 、 难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素 (温度、压强)
表示方法
表示方法
动动手
如上图,先向两支试管中各加入约5 ml水,然后分别向两支试管中缓缓加入氯化钠和硝酸钾固体,边加入边振荡,观察溶质能否在溶剂中无限度的溶解。
一、饱和溶液与不饱和溶液
1、饱和溶液:在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
2、不饱和溶液:在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
做一做
向饱和的硝酸钾溶液里加入少量的高锰酸钾,观察现象。
注:饱和溶液必须注明是哪种溶质的饱和溶液
做一做
1、 对已饱和的硝酸钾溶液(有剩余固体)加热,观察现象。
剩余固体溶解
加入的能继续溶解
饱和的硝酸钾溶液
2、向已饱和的氯化钠溶液(有剩余固体)中加水,观察现象
加入的能继续溶解
剩余固体溶解
饱和的氯化钠溶液
结论:饱和溶液必须要指明:一定温度,一 定量的溶剂。
饱和溶液与不饱和溶液的转化
饱和溶液 不饱和溶液
升高温度 、增加溶剂
降低温度、增加溶质、蒸发溶剂
对于大多数固体:
练习:在其他条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到饱和溶液,下列措施达不到目的的是 ( )
(A)降低溶液温度; (B)加入溶质硝酸钾;
(C)升高溶液的温度; (D)蒸发溶液中的溶剂。
饱和溶液、不饱和溶液
与浓溶液、稀溶液之间的关系
(浓度大)
(浓度小)
食盐溶解
食盐的不饱和溶液
10毫升水
10毫升水
熟石灰不完全溶解
熟石灰的饱和溶液
0.2克熟石灰
2克食盐
1、对于不同溶质来说, 浓溶液不一定是饱和溶液, 稀溶液也不一 定是不饱和溶液。
2、对于同种溶质来说:在一定温度时饱和溶液比不饱和溶液要浓。
二、溶解度
1、固体物质溶解度(通常用S表示)
在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
四要素
条件:在一定温度下
标准:在100克溶剂中
状态:达到饱和状态
单位:克
20℃时,硝酸钾的溶解度是31.6克的意义?
20℃时,硝酸钾的溶解度是31.6克的意义?
20℃时,100克水中最多能溶解硝酸钾的质量为31.6克。
20℃时,100克水中溶了31.6克的硝酸钾就达到饱和状态。
你会判断吗?
(1)20克A物质溶解在100克水中恰好配成饱和溶液,A的溶解度是20克。
(2) 20℃ ,20克A物质溶解在水中配成饱和溶液, 20℃ 时A的溶解度是20克。
(3) 20℃ ,20克A物质溶解在水中配成饱和溶液, 20℃ 时A的溶解度是20克。
(4)20℃ ,20克A物质溶解在水中配成100克饱和溶液,则 20℃ 时A的溶解度是20克。
2、20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
1、在200C时,氯化钾的溶解度是33g,则在200C时,100克水溶解氯化钾_______g可达到饱和。
练一练
20℃
100 g
温度 溶质的质量 溶剂的质量 溶液的质量
2、溶解度与溶解性的关系
易溶
可溶
微溶
难(不)溶
练一练 1、20 ℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。 2、20℃时氯化钠的溶解度是36 g,则氯化钠属于( )
A.易溶 物质 B.可溶物质
C.微溶物质 D.难溶物质
3、溶解度曲线
用纵坐标表示溶解度,用横坐标表示温度。
几种固体物质溶解度曲线
熟石灰的溶解度随温度升高而降低
从溶解度曲线上获取的信息(一)
大多数固体物质的溶解度随着温度的升高而增大。(如硝酸钾)
少数物质的溶解度受温度变化的影响较小。 (如食盐)
极少数物质的溶解度随温度的升高而减小 。 (如熟石灰)
影响固体物质溶解度的主要因素是:温度
从溶解度曲线上获取的信息(二)
点:某物质在某一温度下 的溶解度
线:某物质溶解度受温度的变化情况
交点:曲线的交点表示这两种物质在该温度下的溶解度相同
1、如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是 。
(2)当温度为t1?C,三种物质溶解度由小到大依次为 ,当为t3?C时,溶解度最大的是 。
复习巩固
1、如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是 。
(2)当温度为t1?C,三种物质溶解度由小到大依次为 ,当为t3?C时,溶解度最大的是 。
复习巩固
t2?C时,A和C物质溶解度相等
CAB
A
2、右图是A.B两种物质的溶解度曲线,试回答下列问题
(1)t1?C时,A 的溶解度 B 的溶解度。(填< > 或=)
(2)A、B两物质饱和溶液溶质的质量分数相等的温度是 C。
(3)当A、B两物质的溶液接近饱和时,采用增加溶质、蒸发溶剂、降低温度的方法可以达到饱和的是 物质的溶液。
3、右图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。
现有t2 ℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据右图回答:
(1 )t2 ℃时,将三种饱和溶液分别恒温蒸发相同质量的水,析出晶体最多的是 ;
(2)将三种饱和溶液分别从t2 ℃降温到t1℃时,所得溶液中溶质的质量分数由大到小的顺序 。
(1)定义:在压强为101KPa、一定温度时溶解在1体积
水里达到饱和状态时的气体体积。
2、气体物质的溶解度
讨论:气体的溶解度与什么有关系呢?回答以下问题 找出答案。
(1)打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
(2)喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
(2) 影响气体溶解度的因素:
温度、压强
1、 增大二氧化碳在水中的溶解度的方法( )
A. 升温增压; B. 升温减压; C. 降温增压; D. 降温减压。
2、下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳 溶解度随温度的升高而增大的是( ) A.①② B.③④ C.①③④ D.只有①
想一想:
【例1】右图是甲、乙两种固体物质的溶解度曲线。下列说法中正确的是 ( )
A.乙物质的溶解度受温度变化的影响较小,甲物质的溶解度受温度变化的影响较大
B.30℃时,甲的饱和溶液中溶质的质量分数为30%
C.甲的溶解度大于乙的溶解度
D.甲中含有少量乙时,用蒸发溶剂的方法提纯甲
例题解析
【例2】甲、乙两种固体物质的溶解度曲线如图所示。现有两烧杯分别盛有60 ℃甲的饱和溶液和乙的饱和溶液,且两烧杯中均有未溶解的固体,现将温度从60 ℃降到20 ℃。下列说法正确的是 ( )
A.甲乙溶液中溶质质量分数都减少
B.甲乙溶解度随温度降低而减小
C.烧杯中甲固体质量增加,乙固体质量减少
D.甲溶液质量减少,乙溶液质量变大且一定是饱和溶液
【例3】下图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水) ( )
A.从N→M:先向N中加入适量固体A再降温
B.从N→M:先将N降温再加入适量固体A
C.从M→N:先将M降温再将其升温
D.从M→N:先将M升温再将其蒸发掉部分水
【例4】下图是a、b两种固体物质的溶解度曲线,下列说法正确的是( )
A.10 ℃时,a的溶解度大于b的溶解度
B.t℃时,a、b两种饱和溶液的溶质质量分数相同
C.随着温度的升高,溶解度变化较大的物质是b
D.将b溶液由10 ℃升温至30 ℃时变为饱和溶液
【例5】甲、乙两种固体纯净物的溶解度曲线如图A所示。在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里(图B)。下列说法正确的是( )
A.乙溶液中溶质的质量分数增大
B.装甲溶液的试管中剩余的固体减少
C.试管里甲、乙物质的溶解度都增大
D.两支试管里剩余的固体都增多
【例6】右图是a、b、c、d四种固体物质的溶解度曲线; 下表是这些固体物质在部分温度时的溶解度。
根据图表信息判断下列说法正确的是( )
A.图中a曲线表示KNO3的溶解度曲线
B.b的溶解度小于a的溶解度
C.要从a与d的混合物中得到a,通常采用蒸发溶剂使其结晶的方法
D.KCl的不饱和溶液由60℃降温至10℃时变成饱和溶液
【例7】向200 ℃的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是 ( )
A.溶液温度末冷却到200 ℃时,溶液一定是饱和溶液
B.溶液温度末冷却到200 ℃时,溶质质量分数比甲溶液大
C.溶液温度恢复到200 ℃时,溶液质量比甲溶液小
D.溶液温度恢复到200 ℃时,溶液的溶质质量分数和甲溶液的相等
【例8】右图是M、N两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为正确的是 ( )
A.t1℃时,M、N两物质溶液溶质质量分数相等
B.由t1℃升温到t2℃时,N物质溶液溶质质量分数不变
C.M物质的溶解度大于N物质的溶解度
D.N物质的溶解度随温度的升高而降低
【例9】图1可表示“M与N的并列关系”,图2可表示“M属于N的从属关系”。下列概念间的关系符合图3所示关系的是 ( )
X Y Z
A. 溶质 溶剂 溶液
B. 悬浊液 乳浊液 溶液
C. 氧化物 酸碱盐 化合物
D. 饱和溶液 不饱和溶液 浓溶液
溶解度
溶解性
物质的溶解度
①一定温度
②100克溶剂
③溶液饱和
④单位是克
易溶 、 可溶 、 微溶 、 难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素 (温度、压强)
表示方法
表示方法
同课章节目录
