2019版高中化学高一年级上学期第四章第三节 化学键ppt (共21张)
文档属性
| 名称 | 2019版高中化学高一年级上学期第四章第三节 化学键ppt (共21张) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-09 15:14:37 | ||
图片预览



文档简介
(共21张PPT)
第三节 化学键
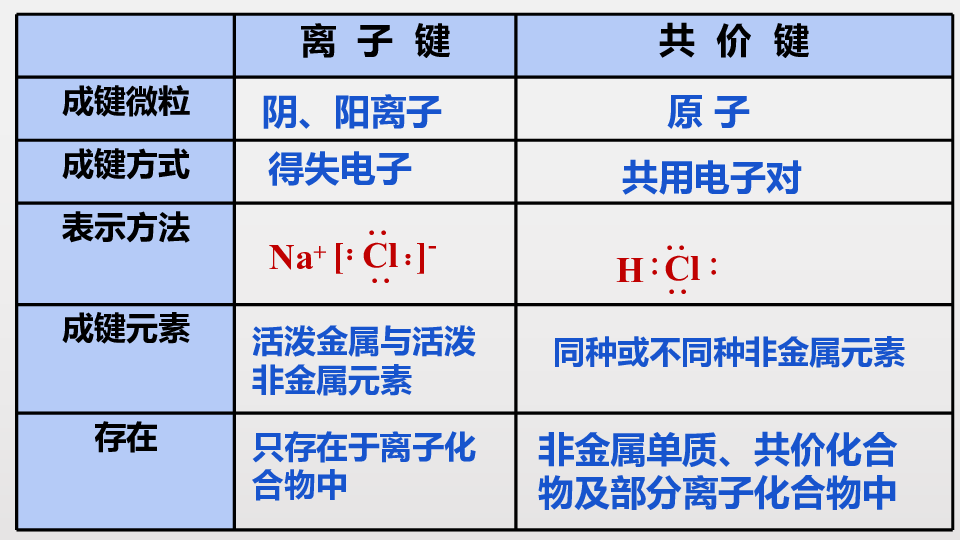
离 子 键 共 价 键
成键微粒
成键方式
表示方法
成键元素
存在
Cl
··
··
H
··
··
[ Cl ]-
··
··
:
:
Na+
阴、阳离子
原 子
得失电子
共用电子对
活泼金属与活泼非金属元素
同种或不同种非金属元素
只存在于离子化合物中
非金属单质、共价化合物及部分离子化合物中
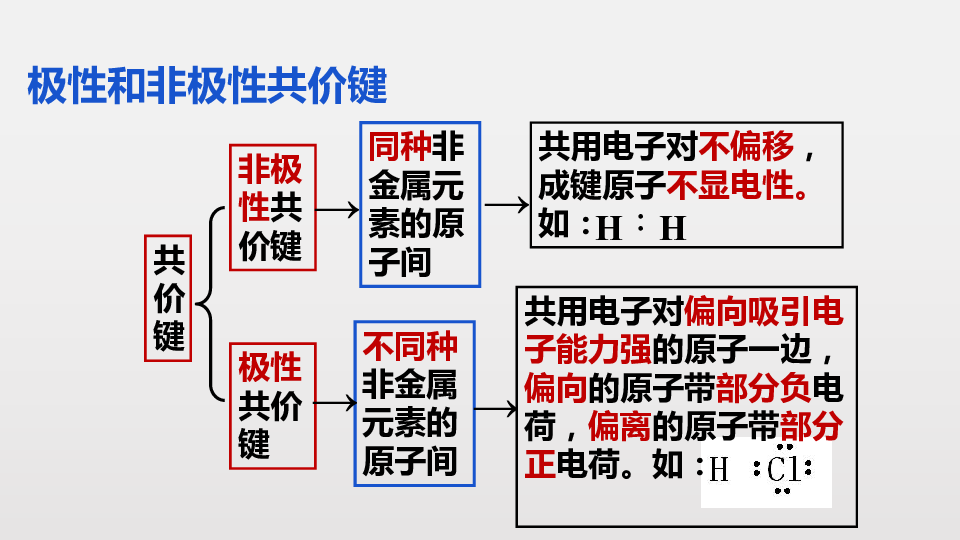
不同种非金属元素的原子间
同种非金属元素的原子间
极性和非极性共价键
共价键
非极性共价键
极性共价键
共用电子对不偏移,成键原子不显电性。如:
共用电子对偏向吸引电子能力强的原子一边,偏向的原子带部分负电荷,偏离的原子带部分正电荷。如:
H H
··
→
→
→
→
下列叙述中,正确的是( )
(A)离子化合物可以含共价键
(B)共价化合物可能含离子键
(C)离子化合物中只含离子键
(D)共价化合物中不含离子键
A D
稀有气体原子(分子)之间没有化学键
共价型分子里的化学键都是共价键
离子化合物里的化学键,
有的全是离子键(如NaCl、CaCl2 ),
有的既有离子键又有共价键( NH4Cl、 NaOH、Na2SO4 等 )
既有离子键又有极性共价键-----NaOH
既有离子键又有非极性共价键-----Na2O2
化学键
离子键
金属键
共价键
非极性键
极性键
一、化学键
相邻原子(或离子)之间强烈的相互作用。
1、定义:
离子键
null
巴东县第三高级中学
null
注意: 化学键的存在
(1)稀有气体单质中不存在化学键
(2)多原子单质分子中存在共价键, 如:H2、O2、O3等
(3)共价化合物分子中只存在共价键,不存在离子键
(4)离子化合物中一定存在离子键,可能存在共价键
如:Na2O2、NaOH、NH4Cl、Na2SO4等含有原子团的离子化合物
(5)离子化合物可由非金属构成, 如:NH4NO3、NH4Cl 等铵盐
(6)非极性共价键可能存在于离子化合物中,如Na2O2
2、化学反应的本质
结论:化学反应的过程,本质上就是旧化学键的断裂和新化学键形成的过程。
[讨论]用化学键的观点分析化学反应过程:
2.H和Cl结合生成HCl,形成了H和Cl之间的化学键H-Cl(新化学键)
用化学键的观点来分析H2与Cl2反应的过程,可以把它想象为2个步骤:
两者缺一不可
1.H2和Cl2中的化学键断裂(旧化学键),生成H和Cl
反应物
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程,所以化学反应中反应物一定有化学键被破坏。
化学反应的过程:
分子原子观点
分解
重新组合
旧键断裂
新键生成
化学键的观点
注意:化学反应中反应物的化学键并非全部被破坏
如:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
只破坏反应物中的离子键,共价键未被破坏。
原子离子
生成物
化合物与化学键的关系 ①含有离子键的化合物一定是离子化合物,但离子化合物中也可能含有共价键,如NH4Cl、Na2SO4、NaOH、Na2O2等。 ②只含共价键的化合物是共价化合物,共价化合物中一定没有离子键。 ③离子化合物中一般既含金属元素又含非金属元素(铵盐除外);共价化合物中一般只含非金属元素(有些共价化合物中也含金属元素,如AlCl3等)。
化学键和化合物关系的“三个一定”和“三个可能”
(1)“三个一定”
①离子化合物中一定含离子键;
②含离子键的一定是离子化合物;
③共价化合物中一定不含离子键。
(2)“三个可能”
①离子化合物中可能含有共价键,如NaOH;
②金属与非金属形成的化合物可能是共价化合物,如AlCl3;
③完全由非金属形成的化合物可能是离子化合物,如NH4Cl。
1.并不是所有的物质内部都有化学键,稀有气体一定无化学键
2.不同种非金属元素形成的化合物,其分子内一定含有极性共价键,但不一定只含极性键,还可能含有非极性共价键、离子键
3.含有金属元素的化合物,不一定含有离子键;活泼金属与活泼非金属元素形成的化合物,一定含有离子键
4.含有离子键的化合物一定是离子化合物
5.含有共价键的化合物不一定是共价化合物
6.金属元素与非金属元素形成的化合物不一定是离子化合物
特别提醒
化学键与物质类别的关系
1、下列说法正确的是( )
A、单质分子中一定存在共价键;
B、气态物质中一定有共价键;
C、在共价化合物中一定有共价键;
D、全部由非金属元素构成的化合物中,一定不含离子键。
C
【练习】
2、下列说法正确的是 ( )
A、化学键只存在于分子之间;
B、化学键只存在于离子之间;
C、化学键是相邻原子(或离子)之间的强烈相互作用;
D、化学键是相邻分子之间的相互作用;
C
3、下列各分子中,所有的原子都满足最外层为8个电子结构的是 。
A、H2O B、BF3
C、CCl4 D、PCl5
E、NH3 F、CO2、
CF
4.下列化合物中只有共价键的是( ) A.NaCl B.NaOH C.(NH4)2SO4 D.H2SO4
D
5.A、B、C三种短周期元素,其原子序数依次增大,三种元素的原子序数之和为35,A、C同主族,B+原子核外有10个电子。请回答下列问题: (1)A、B、C三种元素分别为____________、__________、______________。(填名称) (2)A、B、C两两之间可形成多种化合物,其中属于离子化合物的化学式分别为________、________、________。 (3)用电子式表示B和C形成化合物的过程:________________。
第三节 化学键
离 子 键 共 价 键
成键微粒
成键方式
表示方法
成键元素
存在
Cl
··
··
H
··
··
[ Cl ]-
··
··
:
:
Na+
阴、阳离子
原 子
得失电子
共用电子对
活泼金属与活泼非金属元素
同种或不同种非金属元素
只存在于离子化合物中
非金属单质、共价化合物及部分离子化合物中
不同种非金属元素的原子间
同种非金属元素的原子间
极性和非极性共价键
共价键
非极性共价键
极性共价键
共用电子对不偏移,成键原子不显电性。如:
共用电子对偏向吸引电子能力强的原子一边,偏向的原子带部分负电荷,偏离的原子带部分正电荷。如:
H H
··
→
→
→
→
下列叙述中,正确的是( )
(A)离子化合物可以含共价键
(B)共价化合物可能含离子键
(C)离子化合物中只含离子键
(D)共价化合物中不含离子键
A D
稀有气体原子(分子)之间没有化学键
共价型分子里的化学键都是共价键
离子化合物里的化学键,
有的全是离子键(如NaCl、CaCl2 ),
有的既有离子键又有共价键( NH4Cl、 NaOH、Na2SO4 等 )
既有离子键又有极性共价键-----NaOH
既有离子键又有非极性共价键-----Na2O2
化学键
离子键
金属键
共价键
非极性键
极性键
一、化学键
相邻原子(或离子)之间强烈的相互作用。
1、定义:
离子键
null
巴东县第三高级中学
null
注意: 化学键的存在
(1)稀有气体单质中不存在化学键
(2)多原子单质分子中存在共价键, 如:H2、O2、O3等
(3)共价化合物分子中只存在共价键,不存在离子键
(4)离子化合物中一定存在离子键,可能存在共价键
如:Na2O2、NaOH、NH4Cl、Na2SO4等含有原子团的离子化合物
(5)离子化合物可由非金属构成, 如:NH4NO3、NH4Cl 等铵盐
(6)非极性共价键可能存在于离子化合物中,如Na2O2
2、化学反应的本质
结论:化学反应的过程,本质上就是旧化学键的断裂和新化学键形成的过程。
[讨论]用化学键的观点分析化学反应过程:
2.H和Cl结合生成HCl,形成了H和Cl之间的化学键H-Cl(新化学键)
用化学键的观点来分析H2与Cl2反应的过程,可以把它想象为2个步骤:
两者缺一不可
1.H2和Cl2中的化学键断裂(旧化学键),生成H和Cl
反应物
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程,所以化学反应中反应物一定有化学键被破坏。
化学反应的过程:
分子原子观点
分解
重新组合
旧键断裂
新键生成
化学键的观点
注意:化学反应中反应物的化学键并非全部被破坏
如:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
只破坏反应物中的离子键,共价键未被破坏。
原子离子
生成物
化合物与化学键的关系 ①含有离子键的化合物一定是离子化合物,但离子化合物中也可能含有共价键,如NH4Cl、Na2SO4、NaOH、Na2O2等。 ②只含共价键的化合物是共价化合物,共价化合物中一定没有离子键。 ③离子化合物中一般既含金属元素又含非金属元素(铵盐除外);共价化合物中一般只含非金属元素(有些共价化合物中也含金属元素,如AlCl3等)。
化学键和化合物关系的“三个一定”和“三个可能”
(1)“三个一定”
①离子化合物中一定含离子键;
②含离子键的一定是离子化合物;
③共价化合物中一定不含离子键。
(2)“三个可能”
①离子化合物中可能含有共价键,如NaOH;
②金属与非金属形成的化合物可能是共价化合物,如AlCl3;
③完全由非金属形成的化合物可能是离子化合物,如NH4Cl。
1.并不是所有的物质内部都有化学键,稀有气体一定无化学键
2.不同种非金属元素形成的化合物,其分子内一定含有极性共价键,但不一定只含极性键,还可能含有非极性共价键、离子键
3.含有金属元素的化合物,不一定含有离子键;活泼金属与活泼非金属元素形成的化合物,一定含有离子键
4.含有离子键的化合物一定是离子化合物
5.含有共价键的化合物不一定是共价化合物
6.金属元素与非金属元素形成的化合物不一定是离子化合物
特别提醒
化学键与物质类别的关系
1、下列说法正确的是( )
A、单质分子中一定存在共价键;
B、气态物质中一定有共价键;
C、在共价化合物中一定有共价键;
D、全部由非金属元素构成的化合物中,一定不含离子键。
C
【练习】
2、下列说法正确的是 ( )
A、化学键只存在于分子之间;
B、化学键只存在于离子之间;
C、化学键是相邻原子(或离子)之间的强烈相互作用;
D、化学键是相邻分子之间的相互作用;
C
3、下列各分子中,所有的原子都满足最外层为8个电子结构的是 。
A、H2O B、BF3
C、CCl4 D、PCl5
E、NH3 F、CO2、
CF
4.下列化合物中只有共价键的是( ) A.NaCl B.NaOH C.(NH4)2SO4 D.H2SO4
D
5.A、B、C三种短周期元素,其原子序数依次增大,三种元素的原子序数之和为35,A、C同主族,B+原子核外有10个电子。请回答下列问题: (1)A、B、C三种元素分别为____________、__________、______________。(填名称) (2)A、B、C两两之间可形成多种化合物,其中属于离子化合物的化学式分别为________、________、________。 (3)用电子式表示B和C形成化合物的过程:________________。
