鲁科版高中化学必修一第二章第2节 电解质 课件(共23张PPT)
文档属性
| 名称 | 鲁科版高中化学必修一第二章第2节 电解质 课件(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 927.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-24 20:56:36 | ||
图片预览







文档简介
(共23张PPT)
第2章 元素与物质世界
第2节 电解质
电解质在水溶液中的反应
对电解质的初步了解
①电解质是具有特定性质的化合物
(在水溶液或熔融状态下能导电)
②酸、碱、盐是电解质(其水溶液或熔融物能导电)
③酸、碱、盐能发生电离(在水溶液中或熔融状态下)
④电解质溶液的导电能力与自由离子浓度
大小成正比。
知识回顾
想一想
像Ba(OH)2和H2SO4这些电解质溶液间的反应与离子有何关系?其电解质在水溶液中反应的本质是什么?
二、电解质在水溶液中的反应
1、电解质在水溶液中反应的实质
【演示实验】
先向Ba(OH)2溶液中加入几滴酚酞
溶液,接着按P43图2-2-8所示装置连接,
然后向Ba(OH)2溶液中滴加稀硫酸溶液
将稀硫酸溶液逐滴滴入含有酚酞的
Ba(OH)2溶液中 现象1 现象2 现象3
电流计指针读数由__到__ 溶液颜
色由
__变__ 有__________
指导学生边观察实验边做好下表实验记录
小
大
红色
无色
白色沉
淀产生
问题探究
1.电流计指针读数由大到小说明了什么?
2.溶液颜色为什么会由红变无色?
3.猜测白色沉淀的成分及形成的由来。
4. 稀硫酸与Ba(OH)2溶液反应的实质
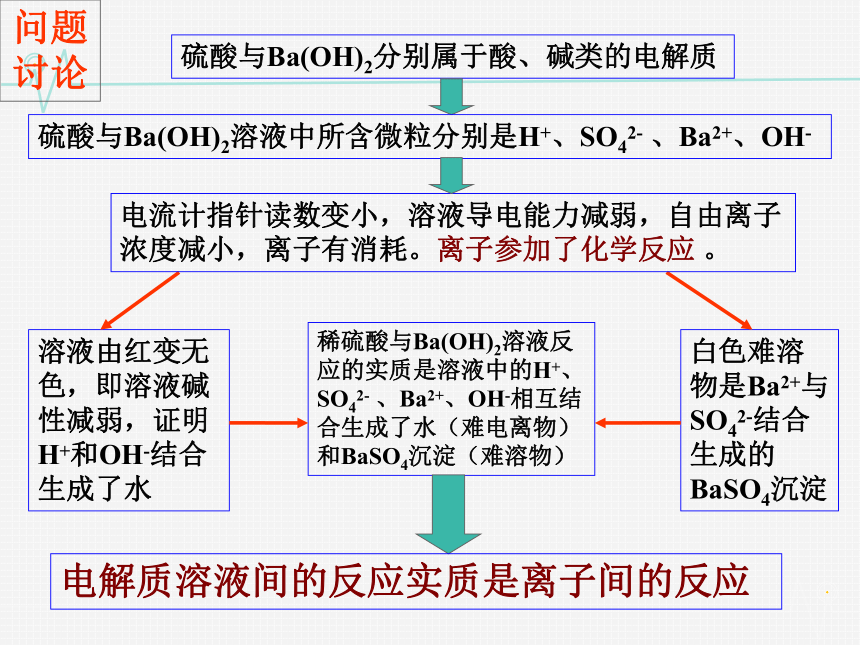
问题讨论
硫酸与Ba(OH)2分别属于酸、碱类的电解质
硫酸与Ba(OH)2溶液中所含微粒分别是H+、SO42- 、Ba2+、OH-
溶液由红变无色,即溶液碱性减弱,证明H+和OH-结合生成了水
白色难溶物是Ba2+与SO42-结合生成的BaSO4沉淀
稀硫酸与Ba(OH)2溶液反应的实质是溶液中的H+、SO42- 、Ba2+、OH-相互结合生成了水(难电离物)和BaSO4沉淀(难溶物)
电解质溶液间的反应实质是离子间的反应
电流计指针读数变小,溶液导电能力减弱,自由离子
浓度减小,离子有消耗。离子参加了化学反应 。
常见酸、碱、盐的溶解性表
OH- NO3- Cl- SO42- CO32-
H+ ? 挥 挥 溶 挥
NH4+ 挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 -
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 -
Cu2+ 不 溶 溶 溶 不
Ag+ - 溶 不 微 不
例: MgCl2与NaOH反应
不能生成水或沉淀
可形成Mg(OH)2沉淀
所以,MgCl2与NaOH能够发生离子反应。
Mg2++2Cl- || Na++OH-
再根据溶解性表判断阴阳离子间能否形成沉淀或水。
溶解性表的应用
先写出电离结果;
问题迁移1
请说明下列反应的实质:
NaOH溶液与CuSO4溶液的反应
NaOH溶液与CuSO4溶液的反应实质是:
本质特点是:
OH-与Cu2+结合生成Cu(OH)2沉淀;
溶液中离子间结合生成了难溶物。
问题迁移2
请说明下列反应实质:
NaOH溶液与盐酸的反应
NaOH溶液与盐酸的反应实质是 :
本质特点是:
H+与OH-结合生成难电离的水
溶液中离子间结合生成了难电离的物质
问题迁移3
请说明下列反应实质:
Na2CO3和盐酸的反应
Na2CO3和盐酸的反应的实质是 :
本质特点是:
CO32-与?H+结合生成碳酸,
碳酸分解为H2O和CO2气体
溶液中离子间结合生成了
难电离的物质和挥发性物质
小结1
溶液中的离子间发生反应后,有难电离
物(水)或难溶物或易挥发物生成——
酸、碱、盐发生复分解反应的条件。
电解质在水溶液中
能发生反应的条件
〖练习〗 1.判断下列电解质溶液间能否发生离子反应。
① CaCl2与K2CO3; ② Ba(NO3)2与NaOH;
③ CuSO4与Ba(OH)2 ;④ H2SO4与NaOH。
答案:
① 能,Ca2+与CO32-形成CaCO3沉淀;
③ 能,Cu2+与OH-、SO42-与Ba2+分别可形成 Cu(OH)2沉淀和BaSO4沉淀;
② 不能;
④ 能,H+与OH-反应生成H2O。
小结2
离子反应
⑴电解质溶液间的反应实质是离子间
的反应,即反应有离子参加;
⑵在化学上我们把有离子参加的反应
叫做离子反应;
⑶离子反应是化学反应中的一种;
⑷它有相应的书写方式,即离子方程式。
离子方程式
问题探究
问题
讨论1
电解质溶液间的反应实质是离子间的
反应。顾名思义,离子方程式就是为
真实地反映电解质溶液反应的实质,
而用实际参加反应的离子符号来表达
的化学反应方程式。
什么是离子方程式?
基本原则:
问题
讨论2
如何书写离子方程式?
①要符合反应事实,没参加反应的
离子及不是难溶物、难电离物(水)
易挥发物(气体)不应当出现在离子
方程式中;
②要符合质量守恒定律;
③要符合电荷守恒原则 。
离子方程式的书写步骤1
① 写出电解质在溶液中的电离产物;
③ 写出离子方程式并配平。
② 判断哪几组阴阳离子间能够发生反应;
⑴ 书写步骤
〖示例〗书写MgCl2溶液和NaOH溶液反应的离子方程式。
第 ① 、② 两步我们在前面已经完成了。现在只需要进行第 ③ 步。
写离子反应式:Mg2++OH- — Mg(OH)2↓
配平: Mg2++2OH- = Mg(OH)2↓
〖练习〗2.写出下列反应的离子方程式。
① NaCl与AgNO3;② Ba(OH)2与H2SO4。
③ KOH与HNO3;④ Ba(OH)2与CuCl2。
〖答案〗
① Cl-+Ag+=AgCl↓;
② Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O;
③ OH-+H+=H2O;
④ Cu2++2OH-=Cu(OH)2↓。
离子方程式的另一种书写步骤:
①写:
正确书写化学方程式;
②改:
将易溶于水且易电离的物质拆成离子;
③删:
删去方程式两边相同的离子。
④查:
检查方程式两边是否遵守质量守恒和电荷守恒。
酸、碱、盐在离子方程式中哪些该拆、哪些不该拆?
⑴易溶于水的强电解质都要拆开成离子形式;
(三强酸、三强碱、可溶盐)
⑵单质、氧化物、气体、沉淀、弱电解质
都写成化学式;
化学物质能否拆开写成离子符号,由其在水溶液中主要存在形态所决定,即是以离子为主还是以分子或沉淀为主。
问题
讨论3
⑴写出化
学方程式
⑵改写化
学方程式
⑶写出离
子方程式
基本步骤方法2
AgNO3+KCl=AgCl↓+KNO3
Ag+ + NO3 - + K++Cl-=
AgCl↓+ K+ + NO3 -
Ag+ +Cl-=AgCl↓
例 AgNO3与KCl反应
作业
1) NaOH + H2SO4 2) CaCO3 + HNO3
3) Fe +CuCl2 4) BaCl2 + Na2SO4
5) KOH + CH3COOH 6) NH3.H2O + HNO3
7) NaHSO4 + NaOH 8) NaHSO4 + Na2CO3
9) NaHCO3 + HCl 10)NaHCO3 + NaOH
11) Cl2+NaOH 12) Cl2+Ca(OH)2
第2章 元素与物质世界
第2节 电解质
电解质在水溶液中的反应
对电解质的初步了解
①电解质是具有特定性质的化合物
(在水溶液或熔融状态下能导电)
②酸、碱、盐是电解质(其水溶液或熔融物能导电)
③酸、碱、盐能发生电离(在水溶液中或熔融状态下)
④电解质溶液的导电能力与自由离子浓度
大小成正比。
知识回顾
想一想
像Ba(OH)2和H2SO4这些电解质溶液间的反应与离子有何关系?其电解质在水溶液中反应的本质是什么?
二、电解质在水溶液中的反应
1、电解质在水溶液中反应的实质
【演示实验】
先向Ba(OH)2溶液中加入几滴酚酞
溶液,接着按P43图2-2-8所示装置连接,
然后向Ba(OH)2溶液中滴加稀硫酸溶液
将稀硫酸溶液逐滴滴入含有酚酞的
Ba(OH)2溶液中 现象1 现象2 现象3
电流计指针读数由__到__ 溶液颜
色由
__变__ 有__________
指导学生边观察实验边做好下表实验记录
小
大
红色
无色
白色沉
淀产生
问题探究
1.电流计指针读数由大到小说明了什么?
2.溶液颜色为什么会由红变无色?
3.猜测白色沉淀的成分及形成的由来。
4. 稀硫酸与Ba(OH)2溶液反应的实质
问题讨论
硫酸与Ba(OH)2分别属于酸、碱类的电解质
硫酸与Ba(OH)2溶液中所含微粒分别是H+、SO42- 、Ba2+、OH-
溶液由红变无色,即溶液碱性减弱,证明H+和OH-结合生成了水
白色难溶物是Ba2+与SO42-结合生成的BaSO4沉淀
稀硫酸与Ba(OH)2溶液反应的实质是溶液中的H+、SO42- 、Ba2+、OH-相互结合生成了水(难电离物)和BaSO4沉淀(难溶物)
电解质溶液间的反应实质是离子间的反应
电流计指针读数变小,溶液导电能力减弱,自由离子
浓度减小,离子有消耗。离子参加了化学反应 。
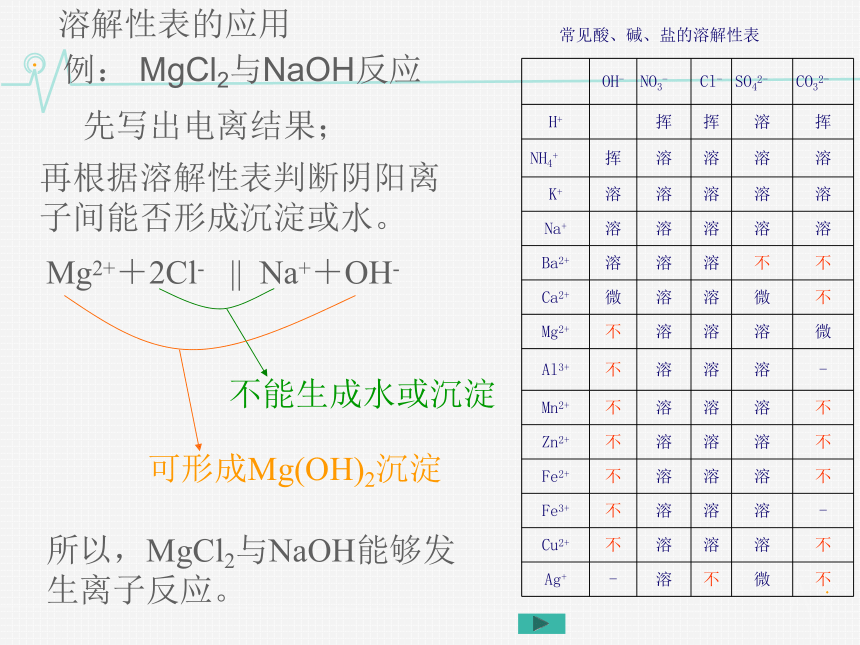
常见酸、碱、盐的溶解性表
OH- NO3- Cl- SO42- CO32-
H+ ? 挥 挥 溶 挥
NH4+ 挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 -
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 -
Cu2+ 不 溶 溶 溶 不
Ag+ - 溶 不 微 不
例: MgCl2与NaOH反应
不能生成水或沉淀
可形成Mg(OH)2沉淀
所以,MgCl2与NaOH能够发生离子反应。
Mg2++2Cl- || Na++OH-
再根据溶解性表判断阴阳离子间能否形成沉淀或水。
溶解性表的应用
先写出电离结果;
问题迁移1
请说明下列反应的实质:
NaOH溶液与CuSO4溶液的反应
NaOH溶液与CuSO4溶液的反应实质是:
本质特点是:
OH-与Cu2+结合生成Cu(OH)2沉淀;
溶液中离子间结合生成了难溶物。
问题迁移2
请说明下列反应实质:
NaOH溶液与盐酸的反应
NaOH溶液与盐酸的反应实质是 :
本质特点是:
H+与OH-结合生成难电离的水
溶液中离子间结合生成了难电离的物质
问题迁移3
请说明下列反应实质:
Na2CO3和盐酸的反应
Na2CO3和盐酸的反应的实质是 :
本质特点是:
CO32-与?H+结合生成碳酸,
碳酸分解为H2O和CO2气体
溶液中离子间结合生成了
难电离的物质和挥发性物质
小结1
溶液中的离子间发生反应后,有难电离
物(水)或难溶物或易挥发物生成——
酸、碱、盐发生复分解反应的条件。
电解质在水溶液中
能发生反应的条件
〖练习〗 1.判断下列电解质溶液间能否发生离子反应。
① CaCl2与K2CO3; ② Ba(NO3)2与NaOH;
③ CuSO4与Ba(OH)2 ;④ H2SO4与NaOH。
答案:
① 能,Ca2+与CO32-形成CaCO3沉淀;
③ 能,Cu2+与OH-、SO42-与Ba2+分别可形成 Cu(OH)2沉淀和BaSO4沉淀;
② 不能;
④ 能,H+与OH-反应生成H2O。
小结2
离子反应
⑴电解质溶液间的反应实质是离子间
的反应,即反应有离子参加;
⑵在化学上我们把有离子参加的反应
叫做离子反应;
⑶离子反应是化学反应中的一种;
⑷它有相应的书写方式,即离子方程式。
离子方程式
问题探究
问题
讨论1
电解质溶液间的反应实质是离子间的
反应。顾名思义,离子方程式就是为
真实地反映电解质溶液反应的实质,
而用实际参加反应的离子符号来表达
的化学反应方程式。
什么是离子方程式?
基本原则:
问题
讨论2
如何书写离子方程式?
①要符合反应事实,没参加反应的
离子及不是难溶物、难电离物(水)
易挥发物(气体)不应当出现在离子
方程式中;
②要符合质量守恒定律;
③要符合电荷守恒原则 。
离子方程式的书写步骤1
① 写出电解质在溶液中的电离产物;
③ 写出离子方程式并配平。
② 判断哪几组阴阳离子间能够发生反应;
⑴ 书写步骤
〖示例〗书写MgCl2溶液和NaOH溶液反应的离子方程式。
第 ① 、② 两步我们在前面已经完成了。现在只需要进行第 ③ 步。
写离子反应式:Mg2++OH- — Mg(OH)2↓
配平: Mg2++2OH- = Mg(OH)2↓
〖练习〗2.写出下列反应的离子方程式。
① NaCl与AgNO3;② Ba(OH)2与H2SO4。
③ KOH与HNO3;④ Ba(OH)2与CuCl2。
〖答案〗
① Cl-+Ag+=AgCl↓;
② Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O;
③ OH-+H+=H2O;
④ Cu2++2OH-=Cu(OH)2↓。
离子方程式的另一种书写步骤:
①写:
正确书写化学方程式;
②改:
将易溶于水且易电离的物质拆成离子;
③删:
删去方程式两边相同的离子。
④查:
检查方程式两边是否遵守质量守恒和电荷守恒。
酸、碱、盐在离子方程式中哪些该拆、哪些不该拆?
⑴易溶于水的强电解质都要拆开成离子形式;
(三强酸、三强碱、可溶盐)
⑵单质、氧化物、气体、沉淀、弱电解质
都写成化学式;
化学物质能否拆开写成离子符号,由其在水溶液中主要存在形态所决定,即是以离子为主还是以分子或沉淀为主。
问题
讨论3
⑴写出化
学方程式
⑵改写化
学方程式
⑶写出离
子方程式
基本步骤方法2
AgNO3+KCl=AgCl↓+KNO3
Ag+ + NO3 - + K++Cl-=
AgCl↓+ K+ + NO3 -
Ag+ +Cl-=AgCl↓
例 AgNO3与KCl反应
作业
1) NaOH + H2SO4 2) CaCO3 + HNO3
3) Fe +CuCl2 4) BaCl2 + Na2SO4
5) KOH + CH3COOH 6) NH3.H2O + HNO3
7) NaHSO4 + NaOH 8) NaHSO4 + Na2CO3
9) NaHCO3 + HCl 10)NaHCO3 + NaOH
11) Cl2+NaOH 12) Cl2+Ca(OH)2
