鲁科版高中化学必修一第三章第2节 《氮的循环》课件(共24张PPT)
文档属性
| 名称 | 鲁科版高中化学必修一第三章第2节 《氮的循环》课件(共24张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-24 20:58:18 | ||
图片预览





文档简介
(共24张PPT)
第2节 氮的循环
--氨
材料一
一、氨的物理性质:
氨易液化→“液氨”,常作致冷剂
颜色:
状态:
气味:
密度:
溶解性:
无色
气体
有刺激性气味
小于空气
极易溶于水
侯氏制碱法中关键的一个步骤:向精制的饱和食盐水中先通氨气之饱和,再在加压的条件下通入CO2之饱和,得到NaHCO3晶体
反应如下:
NH3+CO2+H2O=NH4HCO3 NaCl+NH4HCO3= NaHCO3晶体+NH4Cl
材料二
中国制碱专家 侯德榜
凡是黄头发蓝眼睛的人能办到的,我们黑头发黑眼睛的人也一定能办到。
交流研讨:
1、两种气体的通入顺序能否颠倒?
2、侯氏制碱法在制备NaHCO3的步骤中利用了NH3的什么性质?
NH3极易溶于水且溶于水后生成碱性物质
实验探究
实验现象:
水由玻璃管进入烧瓶,形成美丽的喷泉,液体呈红色
如何设计实验来证明氨易溶于水且溶于水后显碱性?
你看到了什么?想到了什么?
(1)氨为什么会形成喷泉?
氨气极易溶于水,使烧瓶内压强减小,瓶内外形成较大的压强差;大气压将水压入烧瓶。
(2)还有哪些气体和溶液也可以形成喷泉?
(3)生活中的喷泉形成原理与氨喷泉原理是否完全相同?
下列组合能形成喷泉的有 ( )
A、HCl和水 B、 HCl 和AgNO3 溶液
C、O2和水 D、CO2和NaOH溶液
ABD
轻松一刻
二、氨的化学性质:
1、氨气与水的反应:
NH3+H2O
NH3·H2O
NH4++OH-
为什么蘸有浓氨水的玻璃棒
和蘸有浓盐酸的玻璃棒不接触就
能放出白烟?
浓氨水遇浓硝酸、浓硫酸也会产生白烟吗?
思考:
小魔术:
练习:
写出氨气与氯化氢、硝酸、硫酸反应的化学方程式。
氨遇氯化氢产生白烟:______________________。
氨遇 HNO3 产生白烟:______________________。
氨遇硫酸不产生白烟:
_______________________
NH3+HNO3
NH4NO3
NH4Cl
NH3+HCl
2、氨与酸反应生成铵盐
2NH3+H2SO4 === (NH4)2SO4
【注意】反应的本质:
NH3 + H+ = NH4+
NH3 +H2SO4 =NH4 H SO4
日本宣布成功利用氨为原料进行发电
氨燃烧的主要产物是水和氮气,因此只要将石油等传统燃料的一部分置换为氨,就能大幅削减二氧化碳排放量。
日本已正式启动以NH3为燃料的新型燃料电池的开发,可以使NH3与O2直接发生反应来发电。
【材料三】
3、氨的还原性:
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
氨能否被Cl2、CuO、NO2等其它氧化剂氧化呢?
拓展延伸
2NH3+3Cl2=N2+6HCl
NH3+HCl=NH4Cl(白烟)
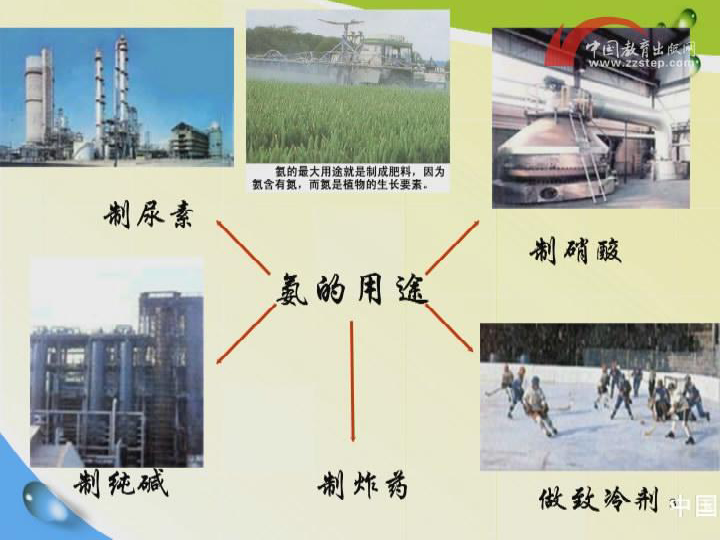
三、氨的用途:
氨的用途
致冷剂
制取氨水
制氮肥
铵盐
制硝酸
3、氨气有还原性
2、氨气与酸反应生成铵盐
1、氨气与水反应
概括整合
一、氨的物理性质
二、氨的化学性质
这节课你收获了什么?
无色、气体有刺激性气味、密度小于空气、极易溶于水
下列关于氨性质的叙述中正确的是( )
A、氨气可用排水法收集
B、氨水呈碱性
C、氨气和酸相遇都能产生白烟
D、在反应NH3+H+=NH4+中,氨失去
电子被氧化
B
【小试牛刀】
操作步骤 实验现象 解释原因
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管 ①Y管中___________ ②反应的化学方程式
________________
将注射器活塞退回原处并固定,待装置恢复到室温 Y管有少量水珠 生成的气态水凝聚
打开K2 ③_______________ ④___________
某同学在实验室中对NH3与NO2反应进行了探究。将收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
红棕色气体逐渐变浅
8NH3+6NO2=7N2+6H2O
Z中NaOH溶液产生倒吸现象
反应后气体分子数减小,Y管压强小于外压
巩固提升
氨的用途如此广泛,请同学们课下查阅资料围绕“氨在生产生活中的应用”写一篇小论文
谢谢大家!
第2节 氮的循环
--氨
材料一
一、氨的物理性质:
氨易液化→“液氨”,常作致冷剂
颜色:
状态:
气味:
密度:
溶解性:
无色
气体
有刺激性气味
小于空气
极易溶于水
侯氏制碱法中关键的一个步骤:向精制的饱和食盐水中先通氨气之饱和,再在加压的条件下通入CO2之饱和,得到NaHCO3晶体
反应如下:
NH3+CO2+H2O=NH4HCO3 NaCl+NH4HCO3= NaHCO3晶体+NH4Cl
材料二
中国制碱专家 侯德榜
凡是黄头发蓝眼睛的人能办到的,我们黑头发黑眼睛的人也一定能办到。
交流研讨:
1、两种气体的通入顺序能否颠倒?
2、侯氏制碱法在制备NaHCO3的步骤中利用了NH3的什么性质?
NH3极易溶于水且溶于水后生成碱性物质
实验探究
实验现象:
水由玻璃管进入烧瓶,形成美丽的喷泉,液体呈红色
如何设计实验来证明氨易溶于水且溶于水后显碱性?
你看到了什么?想到了什么?
(1)氨为什么会形成喷泉?
氨气极易溶于水,使烧瓶内压强减小,瓶内外形成较大的压强差;大气压将水压入烧瓶。
(2)还有哪些气体和溶液也可以形成喷泉?
(3)生活中的喷泉形成原理与氨喷泉原理是否完全相同?
下列组合能形成喷泉的有 ( )
A、HCl和水 B、 HCl 和AgNO3 溶液
C、O2和水 D、CO2和NaOH溶液
ABD
轻松一刻
二、氨的化学性质:
1、氨气与水的反应:
NH3+H2O
NH3·H2O
NH4++OH-
为什么蘸有浓氨水的玻璃棒
和蘸有浓盐酸的玻璃棒不接触就
能放出白烟?
浓氨水遇浓硝酸、浓硫酸也会产生白烟吗?
思考:
小魔术:
练习:
写出氨气与氯化氢、硝酸、硫酸反应的化学方程式。
氨遇氯化氢产生白烟:______________________。
氨遇 HNO3 产生白烟:______________________。
氨遇硫酸不产生白烟:
_______________________
NH3+HNO3
NH4NO3
NH4Cl
NH3+HCl
2、氨与酸反应生成铵盐
2NH3+H2SO4 === (NH4)2SO4
【注意】反应的本质:
NH3 + H+ = NH4+
NH3 +H2SO4 =NH4 H SO4
日本宣布成功利用氨为原料进行发电
氨燃烧的主要产物是水和氮气,因此只要将石油等传统燃料的一部分置换为氨,就能大幅削减二氧化碳排放量。
日本已正式启动以NH3为燃料的新型燃料电池的开发,可以使NH3与O2直接发生反应来发电。
【材料三】
3、氨的还原性:
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
氨能否被Cl2、CuO、NO2等其它氧化剂氧化呢?
拓展延伸
2NH3+3Cl2=N2+6HCl
NH3+HCl=NH4Cl(白烟)
三、氨的用途:
氨的用途
致冷剂
制取氨水
制氮肥
铵盐
制硝酸
3、氨气有还原性
2、氨气与酸反应生成铵盐
1、氨气与水反应
概括整合
一、氨的物理性质
二、氨的化学性质
这节课你收获了什么?
无色、气体有刺激性气味、密度小于空气、极易溶于水
下列关于氨性质的叙述中正确的是( )
A、氨气可用排水法收集
B、氨水呈碱性
C、氨气和酸相遇都能产生白烟
D、在反应NH3+H+=NH4+中,氨失去
电子被氧化
B
【小试牛刀】
操作步骤 实验现象 解释原因
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管 ①Y管中___________ ②反应的化学方程式
________________
将注射器活塞退回原处并固定,待装置恢复到室温 Y管有少量水珠 生成的气态水凝聚
打开K2 ③_______________ ④___________
某同学在实验室中对NH3与NO2反应进行了探究。将收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
红棕色气体逐渐变浅
8NH3+6NO2=7N2+6H2O
Z中NaOH溶液产生倒吸现象
反应后气体分子数减小,Y管压强小于外压
巩固提升
氨的用途如此广泛,请同学们课下查阅资料围绕“氨在生产生活中的应用”写一篇小论文
谢谢大家!
