鲁科版高中化学必修一第四章第2节 铝 金属材料 课件(共19张PPT)
文档属性
| 名称 | 鲁科版高中化学必修一第四章第2节 铝 金属材料 课件(共19张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-24 00:00:00 | ||
图片预览




文档简介
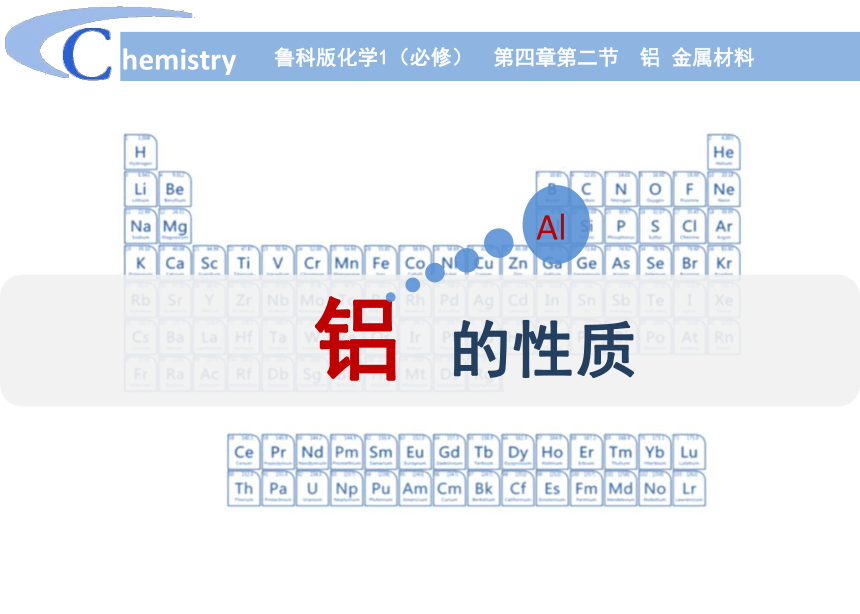
(共19张PPT)
铝 的性质
Al
鲁科版化学1(必修) 第四章第二节 铝 金属材料
hemistry
知识与技能
1.掌握铝的性质及在生活中的应用。
?
2.学会书写铝与酸、碱、氧化物等反应的化学方程式。
过程与方法
通过实验探究铝性质的过程,培养学生动手操作能力、观察现象能力。
情感态度与价值观
1.通过对铝的性质的学习使学生树立辩证的观点。?
2.通过分组实验,分组自学等一些活动,培养学生敢于质疑、勇于创新、团结合作的学习精神。
?
学
目
标
教
目录
导入
新知学习
合作探究
巩固总结
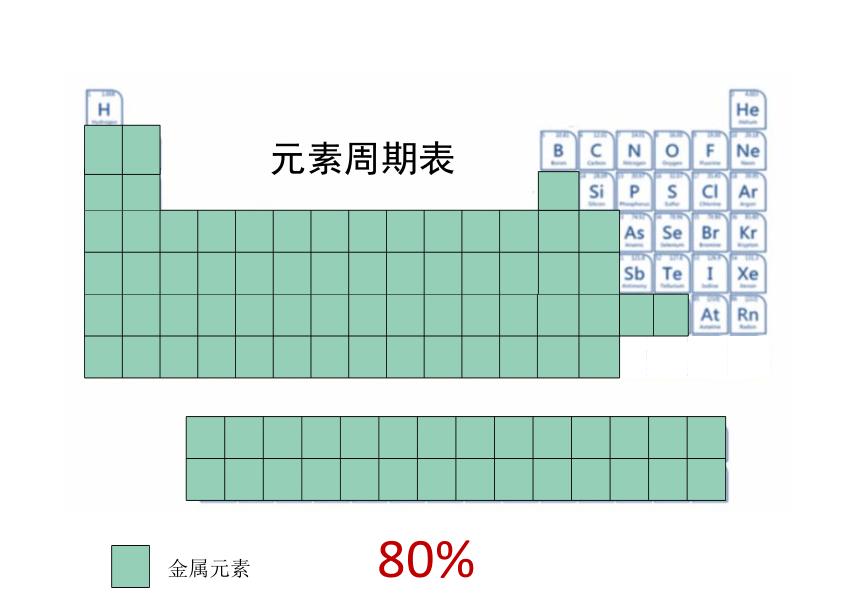
金属元素
80%
元素周期表
飞船舱体的成分有什么?
铝
身边的铝制品
铝锅
铝箔
铝制零件
铝勺
目录
导入
新知学习
合作探究
巩固总结
一、铝的物理性质
认真观察铝块
银白色、有金属光泽
较小
良好
良好
良好(仅次于银金铜)
颜色:
密度:
延展性:
导电性:
导热性:
K Ca Na Mg Zn Fe Sn Pb Cu Hg Ag Pt Au
大胆预测
还原性
Al
Al
4.与盐溶液反应
反应现象:
反应方程式:
2.与金属氧化物反应
反应现象:
反应方程式:
1.与非金属单质反应
反应现象:
反应方程式:
3.与酸溶液反应
反应现象:
反应方程式:
二、铝的化学性质
1.铝与非金属单质反应
铝在氧气中燃烧
反应现象:
反应方程式:
剧烈燃烧,放出大量的热和耀眼的白光。
4Al+3O2 2Al2O3
点燃
二、铝的化学性质
4Al+3O2 2Al2O3
点燃
用途
火箭助推剂
燃烧弹
信号弹
1.铝与非金属单质反应
铝与Fe2O3反应
反应现象:
反应方程式:
2Al + Fe2O3 2Fe + Al2O3
高温
发出耀眼的光芒,有红色熔融物生成
二、铝的化学性质
2.铝与金属氧化物反应
观察思考:
镁条、氯酸钾在这个反应中起什么作用?
2.该反应的条件是什么?
3.此反应是放热反应还是吸热反应?
Al+ Fe2O3
铝热剂
2Al + Fe2O3 2Fe + Al2O3
高温
二、铝的化学性质
2.铝与金属氧化物反应
铝热反应用途
冶炼难熔金属
焊接钢轨
目录
导入
新知学习
合作探究
巩固总结
二、铝的化学性质
3.铝与酸溶液反应
铝与盐酸反应
反应现象:
反应方程式:
【合作探究】
按照实验步骤,小组合作完成铝与盐酸( HCl )反应实验,记录反应现象,书写化学方程式。
2Al+6HCl 2AlCl3 + 3H2
二、铝的化学性质
4.铝与强碱溶液反应
铝与NaOH反应
反应现象:
反应方程式:
【合作探究】
按照实验步骤,小组合作完成铝与氢氧化钠( NaOH )溶液反应实验,验证反应方程式,记录反应现象。
2Al + 2NaOH + 6H2O == 2Na[Al(OH)4]+3H2↑
目录
导入
新知学习
合作探究
巩固总结
课堂练习
某课外活动小组做如下实验:
往一铝制易拉罐内充满CO2,然后往罐内注入足量的NaOH溶液,立即用胶布严封罐口,过一段时间后,发现罐内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起。试解释:
1、罐壁内凹而瘪的原因是 ,
化学方程式为 .
2、罐壁再鼓起的原因是 ,
化学方程式为 .
CO2溶于与NaOH溶液,压强减小
CO2+2NaOH Na2CO3+H2O
铝与与NaOH溶液反应生成H2,压强增大
2Al+6H2O+2NaOH 2 Na[Al(OH)4 ] +3H2↑
小结
铝
一.铝的物理性质
二.铝的化学性质(还原性)
1.铝与非金属单质反应
2.铝与金属氧化物反应
铝热反应
3.铝与酸溶液反应
4.铝与强碱溶液反应
4Al+3O2 2Al2O3
点燃
2Al + Fe2O3 2Fe + Al2O3
高温
2Al+6HCl 2AlCl3 + 3H2
2Al + 2NaOH + 6H2O == 2Na[Al(OH)4]+3H2↑
通性
特性
铝 的性质
Al
鲁科版化学1(必修) 第四章第二节 铝 金属材料
hemistry
知识与技能
1.掌握铝的性质及在生活中的应用。
?
2.学会书写铝与酸、碱、氧化物等反应的化学方程式。
过程与方法
通过实验探究铝性质的过程,培养学生动手操作能力、观察现象能力。
情感态度与价值观
1.通过对铝的性质的学习使学生树立辩证的观点。?
2.通过分组实验,分组自学等一些活动,培养学生敢于质疑、勇于创新、团结合作的学习精神。
?
学
目
标
教
目录
导入
新知学习
合作探究
巩固总结
金属元素
80%
元素周期表
飞船舱体的成分有什么?
铝
身边的铝制品
铝锅
铝箔
铝制零件
铝勺
目录
导入
新知学习
合作探究
巩固总结
一、铝的物理性质
认真观察铝块
银白色、有金属光泽
较小
良好
良好
良好(仅次于银金铜)
颜色:
密度:
延展性:
导电性:
导热性:
K Ca Na Mg Zn Fe Sn Pb Cu Hg Ag Pt Au
大胆预测
还原性
Al
Al
4.与盐溶液反应
反应现象:
反应方程式:
2.与金属氧化物反应
反应现象:
反应方程式:
1.与非金属单质反应
反应现象:
反应方程式:
3.与酸溶液反应
反应现象:
反应方程式:
二、铝的化学性质
1.铝与非金属单质反应
铝在氧气中燃烧
反应现象:
反应方程式:
剧烈燃烧,放出大量的热和耀眼的白光。
4Al+3O2 2Al2O3
点燃
二、铝的化学性质
4Al+3O2 2Al2O3
点燃
用途
火箭助推剂
燃烧弹
信号弹
1.铝与非金属单质反应
铝与Fe2O3反应
反应现象:
反应方程式:
2Al + Fe2O3 2Fe + Al2O3
高温
发出耀眼的光芒,有红色熔融物生成
二、铝的化学性质
2.铝与金属氧化物反应
观察思考:
镁条、氯酸钾在这个反应中起什么作用?
2.该反应的条件是什么?
3.此反应是放热反应还是吸热反应?
Al+ Fe2O3
铝热剂
2Al + Fe2O3 2Fe + Al2O3
高温
二、铝的化学性质
2.铝与金属氧化物反应
铝热反应用途
冶炼难熔金属
焊接钢轨
目录
导入
新知学习
合作探究
巩固总结
二、铝的化学性质
3.铝与酸溶液反应
铝与盐酸反应
反应现象:
反应方程式:
【合作探究】
按照实验步骤,小组合作完成铝与盐酸( HCl )反应实验,记录反应现象,书写化学方程式。
2Al+6HCl 2AlCl3 + 3H2
二、铝的化学性质
4.铝与强碱溶液反应
铝与NaOH反应
反应现象:
反应方程式:
【合作探究】
按照实验步骤,小组合作完成铝与氢氧化钠( NaOH )溶液反应实验,验证反应方程式,记录反应现象。
2Al + 2NaOH + 6H2O == 2Na[Al(OH)4]+3H2↑
目录
导入
新知学习
合作探究
巩固总结
课堂练习
某课外活动小组做如下实验:
往一铝制易拉罐内充满CO2,然后往罐内注入足量的NaOH溶液,立即用胶布严封罐口,过一段时间后,发现罐内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起。试解释:
1、罐壁内凹而瘪的原因是 ,
化学方程式为 .
2、罐壁再鼓起的原因是 ,
化学方程式为 .
CO2溶于与NaOH溶液,压强减小
CO2+2NaOH Na2CO3+H2O
铝与与NaOH溶液反应生成H2,压强增大
2Al+6H2O+2NaOH 2 Na[Al(OH)4 ] +3H2↑
小结
铝
一.铝的物理性质
二.铝的化学性质(还原性)
1.铝与非金属单质反应
2.铝与金属氧化物反应
铝热反应
3.铝与酸溶液反应
4.铝与强碱溶液反应
4Al+3O2 2Al2O3
点燃
2Al + Fe2O3 2Fe + Al2O3
高温
2Al+6HCl 2AlCl3 + 3H2
2Al + 2NaOH + 6H2O == 2Na[Al(OH)4]+3H2↑
通性
特性
