鲁科版高中化学必修一第四章第2节 铝 金属材料 课件(共25张PPT)
文档属性
| 名称 | 鲁科版高中化学必修一第四章第2节 铝 金属材料 课件(共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-24 21:23:58 | ||
图片预览






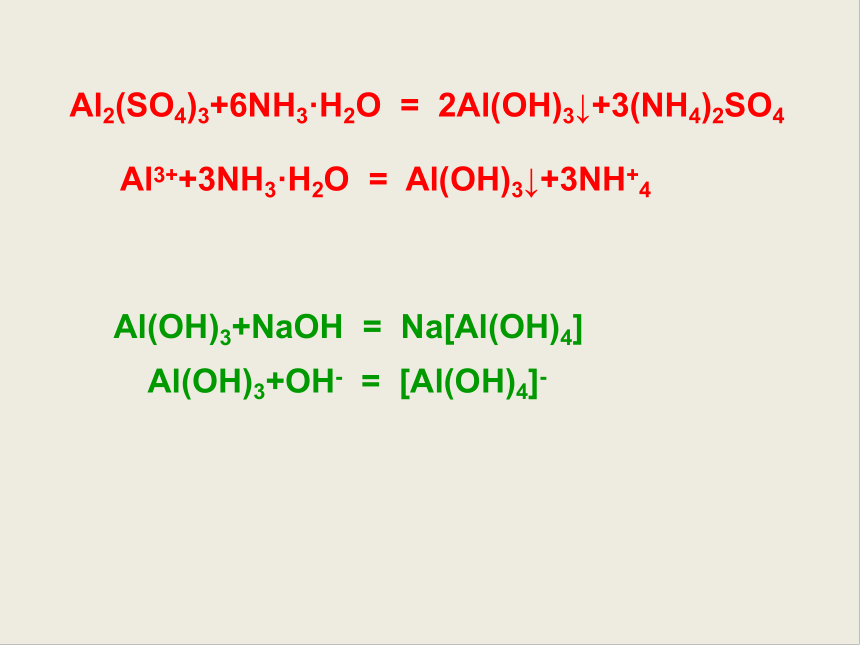


文档简介
(共25张PPT)
铝的重要化合物
鲁科版必修一化学第四章
第2节 铝 金属材料
【别名】 复方氢氧化铝 ,胃舒平
【性状】白色片状
【主要成分】氢氧化铝
【用法及用量】成人口服:2~4片/次,一日3~4次。
【作用与用途】本品有中和胃酸、减少胃液分泌和解痉止疼作用,用于胃溃疡用胃酸过多症
【注意事项】本品应饭前服用或胃疼发作时嚼碎服用。
请说出氢氧化铝的类别,并推断氢氧化铝的相关性质 。
治胃酸过多的药物胃舒平的说明书:
(1)物理性质:
氢氧化铝是白色胶状物质,不溶于水,有强的吸附性,可以吸附水中的悬浮物和各种色素。
氢氧化铝
现在有下列试剂,请设计实验方案制备氢氧化铝。
试剂:硫酸铝溶液、氨水、氢氧化钠溶液、稀盐酸。
实验方案:
(1)用硫酸铝溶液与氢氧化钠溶液反应。
(2)用硫酸铝溶液与氨水反应
想一想
两套实验方案似乎都可行,请问:如果药品的滴加顺序不一样,会不会对实验结果有影响?
实验探究:记录实验并分析现象
白色胶状
沉淀出现
白色胶状
沉淀出现
先出现沉淀后
沉淀又溶解
刚开始没有
现象后又出
现沉淀
实验
小组 实验内容 实验现象
1 硫酸铝
溶液与
氨水反应 向硫酸铝溶液
中滴加氨水
2 向氨水中滴加
硫酸铝溶液
3 硫酸铝
溶液与
氢氧化钠
溶液反应 向硫酸铝溶液
中滴加氢氧化钠
溶液
4 向氢氧化钠溶
液中滴加硫酸铝
溶液
Al2(SO4)3+6NH3·H2O = 2Al(OH)3↓+3(NH4)2SO4
Al3++3NH3·H2O = Al(OH)3↓+3NH+4
Al(OH)3+NaOH = Na[Al(OH)4]
Al(OH)3+OH- = [Al(OH)4]-
大家已经知道氢氧化铝属于碱,
那么它应该可以与酸反应。
Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,这种既能与强酸反应生成盐和水,又能与强碱反应生成盐和水的氢氧化物——两性氢氧化物。
Al(OH)3+3HCl = AlCl3 +3H2O
Al(OH)3+3H+ = Al3+ +3H2O
实验方案 实验现象 结论
向实验所得沉淀中滴加盐酸溶液
实验探究:
[Al(OH)4]- +H+ = Al(OH)3↓ +H2O
与HCl溶液反应的化学方程式、离子方程式,
Na[Al(OH)4]+HCl = Al(OH)3 ↓+NaCl +H2O
有白色胶状沉淀生成,后又溶解
Na[Al(OH)4]可以与盐酸反应。
Al(OH)3+3HCl = AlCl3 +3H2O
Al(OH)3+3H+ = Al3+ +3H2O
实验方案 实验现象 结论
向第三组的溶液中滴加HCl
Al3+
Al(OH)3
[Al(OH)4]-
+ OH-
H+ +
+ OH-
H+ +
【讨论】
现有两瓶失去标签的无色溶液,
只知道一瓶是NaOH溶液,一
瓶是AlCl3溶液,你有多少种办
法能将它们鉴别出来,选出一
种最佳方法。
互滴
明矾:KAl(SO4)2·12H2O
KAl(SO4)2=K++Al3++2SO42-
Al3++3H2O=Al(OH)3(胶体 )+3H+
● 净水剂
原理是:铝离子在溶液中可以与水发生微弱的反应,生成有很大表面积的氢氧化铝,可以吸附水中的悬浮杂质而形成沉淀。
生活中的化学
吃油条的利弊
油条的制作过程:首先是发面,即用鲜酵母或老面(酵面)与面粉一起加水揉和,使面团发酵到一定程度后,再加入适量纯碱、食盐和明矾进行揉和,然后切成厚1厘米,长10厘米左右的条状物,把每两条上下叠好,用窄木条在中间压一下,旋转后拉长放入热油锅里去炸,使膨胀成一根又松、又脆、又黄、又香的油条。
当面团里出现游离的氢氧化钠时,原料中的明矾就立即跟它发生了反应,使游离的氢氧化钠经成了氢氧化铝。氢氧化铝的凝胶液或干燥凝胶,在医疗上用作抗酸药,能中和胃酸、保护溃疡面,用于治疗胃酸过多症、胃溃疡和十二指肠溃疡等。常见的治胃病药“胃舒平”的主要成分就是氢氧化铝,因此,有的中医处方中谈到:油条对胃酸有抑制作用,并且对某些胃病的一定的疗效。但是摄入过多的铝元素对身体有一定的危害。
生活中的化学
闪耀着六射星光的天然蓝宝石“亚洲之星”重330克拉,缅甸产,世界著名珍宝,现藏于美国华盛顿斯密森博物馆。
闪耀着六射星光的天然红宝石“罗斯利夫斯”,重138.7克拉,斯里兰卡产,世界著名珍宝。现藏于美国华盛顿斯密森博物馆。
铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成
刚 玉
氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)
自然界中氧化铝的天然存在形式
(二)氧化铝Al2O3
1、 Al2O3物理性质
氧化铝是白色、不溶于水的固体,熔点高,是一种较好的耐火材料。天然产的无色氧化铝晶体叫刚玉,其硬度仅次于金刚石。
完成化学反应方程式和离子方程式
与HCl溶液反应的化学方程式、离子方程式,
Al2O3+6HCl = 2AlCl3 +3H2O
Al2O3+6H+ = 2Al3+ + 3H2O
与NaOH溶液反应的化学方程式、离子方程式,
Al2O3+2NaOH + 3H2O = 2Na[Al(OH)4]
Al2O3+2OH- + 3H2O = 2[Al(OH)4]-
结论:Al2O3既能与NaOH溶液反应,生成盐和水;又能与盐酸溶液反应,生成盐和水,这样的氧化物为两性氧化物。
【问题探究】
桌面上有两堆白色粉末,已知它们分别是Al2O3和MgO,你能用什么方法加以鉴别?-请设计方案
你能写出相关的化学反应方程式吗?
Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
3.用途:
①冶炼铝:
液态Al2O3被电解生成铝和氧气,氧化铝是冶炼铝的主要原料。
氧化铝坩埚
化学与产品
耐磨件
氧化铝陶瓷异形体
②耐火材料
③人造宝石
(熔点2050℃)
[Al(OH)4]- Al(OH)3 Al3+
Al
Al2O3
O2
OH_
加热
H+
OH_
H+
H+
OH_
OH_
H+
小结:
AD
实战演练
2.向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量) ( )
D
C
铝的重要化合物
鲁科版必修一化学第四章
第2节 铝 金属材料
【别名】 复方氢氧化铝 ,胃舒平
【性状】白色片状
【主要成分】氢氧化铝
【用法及用量】成人口服:2~4片/次,一日3~4次。
【作用与用途】本品有中和胃酸、减少胃液分泌和解痉止疼作用,用于胃溃疡用胃酸过多症
【注意事项】本品应饭前服用或胃疼发作时嚼碎服用。
请说出氢氧化铝的类别,并推断氢氧化铝的相关性质 。
治胃酸过多的药物胃舒平的说明书:
(1)物理性质:
氢氧化铝是白色胶状物质,不溶于水,有强的吸附性,可以吸附水中的悬浮物和各种色素。
氢氧化铝
现在有下列试剂,请设计实验方案制备氢氧化铝。
试剂:硫酸铝溶液、氨水、氢氧化钠溶液、稀盐酸。
实验方案:
(1)用硫酸铝溶液与氢氧化钠溶液反应。
(2)用硫酸铝溶液与氨水反应
想一想
两套实验方案似乎都可行,请问:如果药品的滴加顺序不一样,会不会对实验结果有影响?
实验探究:记录实验并分析现象
白色胶状
沉淀出现
白色胶状
沉淀出现
先出现沉淀后
沉淀又溶解
刚开始没有
现象后又出
现沉淀
实验
小组 实验内容 实验现象
1 硫酸铝
溶液与
氨水反应 向硫酸铝溶液
中滴加氨水
2 向氨水中滴加
硫酸铝溶液
3 硫酸铝
溶液与
氢氧化钠
溶液反应 向硫酸铝溶液
中滴加氢氧化钠
溶液
4 向氢氧化钠溶
液中滴加硫酸铝
溶液
Al2(SO4)3+6NH3·H2O = 2Al(OH)3↓+3(NH4)2SO4
Al3++3NH3·H2O = Al(OH)3↓+3NH+4
Al(OH)3+NaOH = Na[Al(OH)4]
Al(OH)3+OH- = [Al(OH)4]-
大家已经知道氢氧化铝属于碱,
那么它应该可以与酸反应。
Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,这种既能与强酸反应生成盐和水,又能与强碱反应生成盐和水的氢氧化物——两性氢氧化物。
Al(OH)3+3HCl = AlCl3 +3H2O
Al(OH)3+3H+ = Al3+ +3H2O
实验方案 实验现象 结论
向实验所得沉淀中滴加盐酸溶液
实验探究:
[Al(OH)4]- +H+ = Al(OH)3↓ +H2O
与HCl溶液反应的化学方程式、离子方程式,
Na[Al(OH)4]+HCl = Al(OH)3 ↓+NaCl +H2O
有白色胶状沉淀生成,后又溶解
Na[Al(OH)4]可以与盐酸反应。
Al(OH)3+3HCl = AlCl3 +3H2O
Al(OH)3+3H+ = Al3+ +3H2O
实验方案 实验现象 结论
向第三组的溶液中滴加HCl
Al3+
Al(OH)3
[Al(OH)4]-
+ OH-
H+ +
+ OH-
H+ +
【讨论】
现有两瓶失去标签的无色溶液,
只知道一瓶是NaOH溶液,一
瓶是AlCl3溶液,你有多少种办
法能将它们鉴别出来,选出一
种最佳方法。
互滴
明矾:KAl(SO4)2·12H2O
KAl(SO4)2=K++Al3++2SO42-
Al3++3H2O=Al(OH)3(胶体 )+3H+
● 净水剂
原理是:铝离子在溶液中可以与水发生微弱的反应,生成有很大表面积的氢氧化铝,可以吸附水中的悬浮杂质而形成沉淀。
生活中的化学
吃油条的利弊
油条的制作过程:首先是发面,即用鲜酵母或老面(酵面)与面粉一起加水揉和,使面团发酵到一定程度后,再加入适量纯碱、食盐和明矾进行揉和,然后切成厚1厘米,长10厘米左右的条状物,把每两条上下叠好,用窄木条在中间压一下,旋转后拉长放入热油锅里去炸,使膨胀成一根又松、又脆、又黄、又香的油条。
当面团里出现游离的氢氧化钠时,原料中的明矾就立即跟它发生了反应,使游离的氢氧化钠经成了氢氧化铝。氢氧化铝的凝胶液或干燥凝胶,在医疗上用作抗酸药,能中和胃酸、保护溃疡面,用于治疗胃酸过多症、胃溃疡和十二指肠溃疡等。常见的治胃病药“胃舒平”的主要成分就是氢氧化铝,因此,有的中医处方中谈到:油条对胃酸有抑制作用,并且对某些胃病的一定的疗效。但是摄入过多的铝元素对身体有一定的危害。
生活中的化学
闪耀着六射星光的天然蓝宝石“亚洲之星”重330克拉,缅甸产,世界著名珍宝,现藏于美国华盛顿斯密森博物馆。
闪耀着六射星光的天然红宝石“罗斯利夫斯”,重138.7克拉,斯里兰卡产,世界著名珍宝。现藏于美国华盛顿斯密森博物馆。
铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成
刚 玉
氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)
自然界中氧化铝的天然存在形式
(二)氧化铝Al2O3
1、 Al2O3物理性质
氧化铝是白色、不溶于水的固体,熔点高,是一种较好的耐火材料。天然产的无色氧化铝晶体叫刚玉,其硬度仅次于金刚石。
完成化学反应方程式和离子方程式
与HCl溶液反应的化学方程式、离子方程式,
Al2O3+6HCl = 2AlCl3 +3H2O
Al2O3+6H+ = 2Al3+ + 3H2O
与NaOH溶液反应的化学方程式、离子方程式,
Al2O3+2NaOH + 3H2O = 2Na[Al(OH)4]
Al2O3+2OH- + 3H2O = 2[Al(OH)4]-
结论:Al2O3既能与NaOH溶液反应,生成盐和水;又能与盐酸溶液反应,生成盐和水,这样的氧化物为两性氧化物。
【问题探究】
桌面上有两堆白色粉末,已知它们分别是Al2O3和MgO,你能用什么方法加以鉴别?-请设计方案
你能写出相关的化学反应方程式吗?
Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
3.用途:
①冶炼铝:
液态Al2O3被电解生成铝和氧气,氧化铝是冶炼铝的主要原料。
氧化铝坩埚
化学与产品
耐磨件
氧化铝陶瓷异形体
②耐火材料
③人造宝石
(熔点2050℃)
[Al(OH)4]- Al(OH)3 Al3+
Al
Al2O3
O2
OH_
加热
H+
OH_
H+
H+
OH_
OH_
H+
小结:
AD
实战演练
2.向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量) ( )
D
C
