科粤版九年级下册7.3溶液浓稀的表示(20张PPT)
文档属性
| 名称 | 科粤版九年级下册7.3溶液浓稀的表示(20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 351.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-25 17:08:52 | ||
图片预览





文档简介
(共20张PPT)
7.3 溶液浓稀的表示
学习目标
1、通过听讲和分析,知道溶质质量分数的含义和计算公式;
2、通过练习计算硫酸铜溶液的溶质质量分数,学会溶质质量分数的简单计算;
3、通过例题解析,了解配制一定溶质质量分数的溶液在实际生产生活中的应用。
null
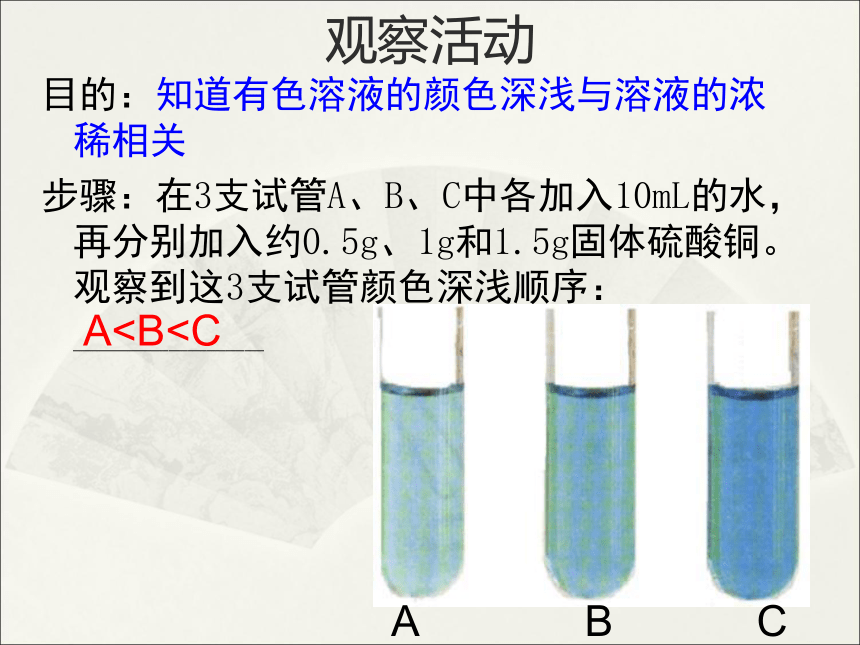
观察活动
目的:知道有色溶液的颜色深浅与溶液的浓稀相关
步骤:在3支试管A、B、C中各加入10mL的水,再分别加入约0.5g、1g和1.5g固体硫酸铜。观察到这3支试管颜色深浅顺序:__________
AA B C
即时检测1
有色溶液颜色的深浅,可粗略地反映溶液的浓稀,颜色深的溶液 ;颜色浅的溶液 (填“浓”或“稀”)
浓
稀
一、溶质的质量分数
1、概念:溶质质量与溶液质量之比,叫做溶质的质量分数
2、表示方法
溶质的质量分数=
溶质质量
溶液质量
×100%
×100%
溶质质量
溶质质量+溶剂质量
=
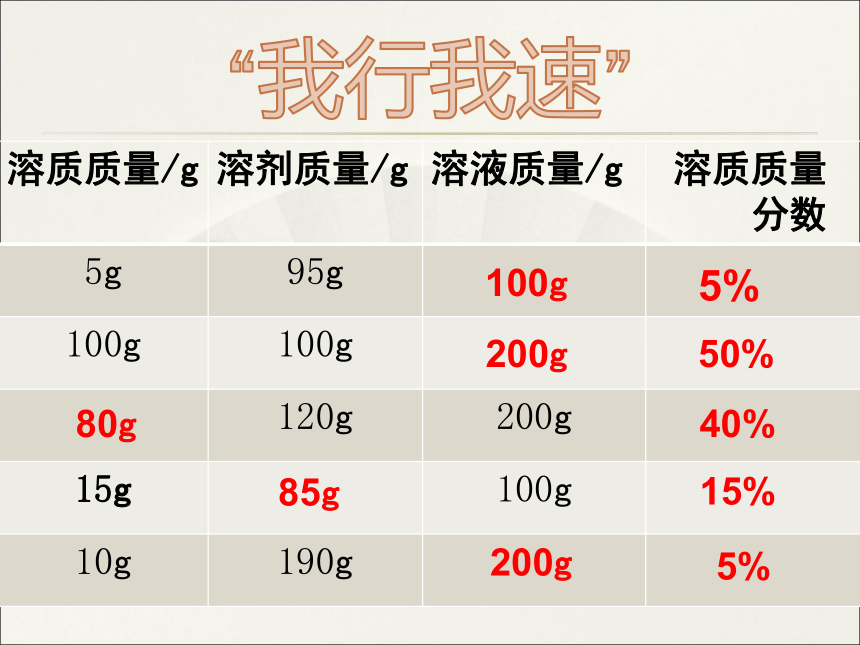
溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量
分数
5g 95g
100g 100g
120g 200g
15g 100g
10g 190g
“我行我速”
100g
5%
200g
50%
80g
85g
40%
15%
5%
200g
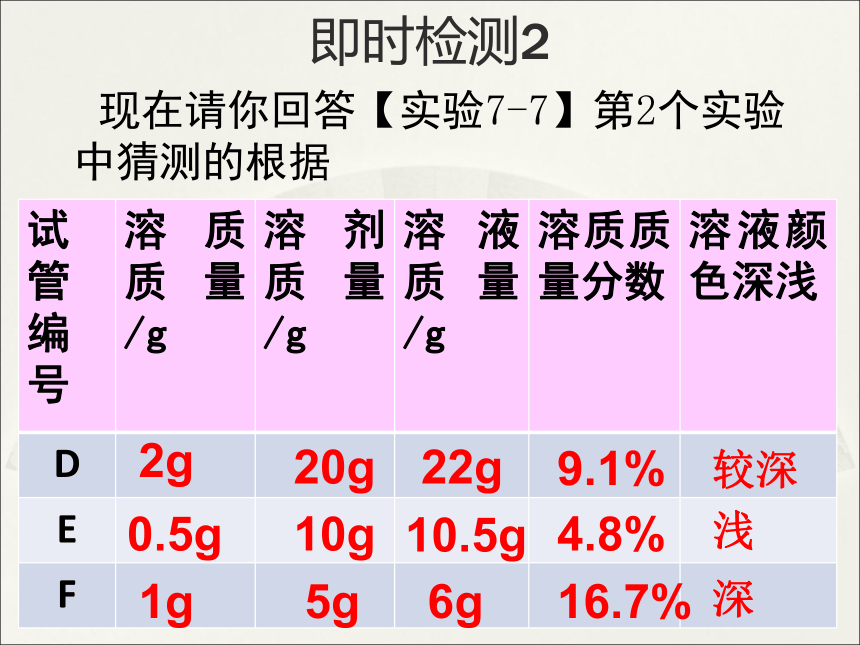
即时检测2
现在请你回答【实验7-7】第2个实验中猜测的根据
试管编号 溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量分数 溶液颜色深浅
D
E
F
2g
20g
22g
9.1%
0.5g
10g
10.5g
4.8%
1g
5g
6g
16.7%
较深
浅
深
E D F
结论:溶质的质量分数越大,有色溶液的颜色越深,说明它的浓度越大。
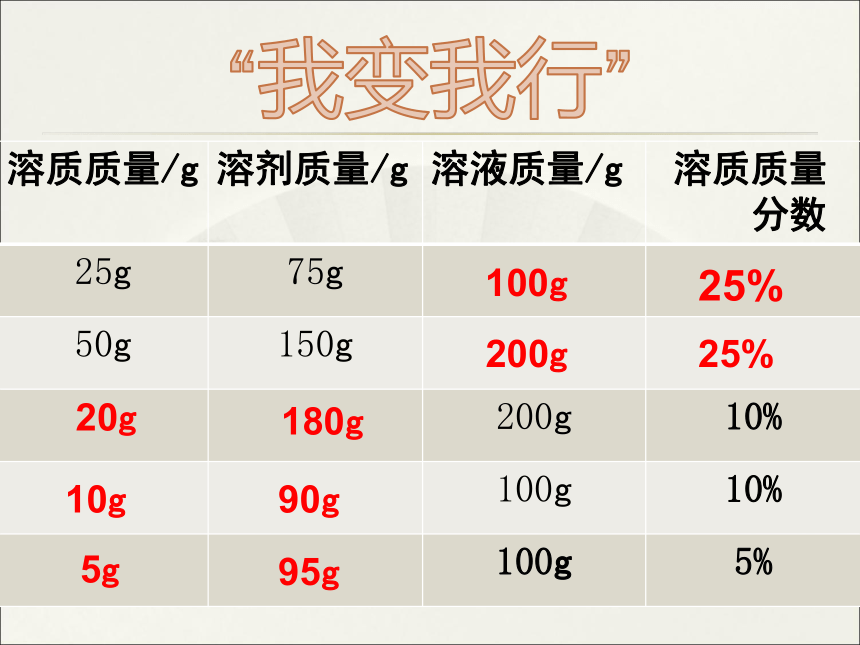
溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量
分数
25g 75g
50g 150g
200g 10%
100g 10%
100g 5%
“我变我行”
100g
25%
200g
25%
20g
90g
10g
95g
180g
5g
活学活用:
配制一定量的某一组成的溶液,求所需溶质和溶剂的量。
例1:在农业生产中,常用食盐溶液选种。现要配制80kg溶质质量分数为15%的盐水,需要氯化钠固体和水的质量各多少?
解:由
得溶质质量=溶液质量×溶质的质量分数
故,需要NaCl固体的质量=80kg×15%=12kg
水的质量=80kg-12kg=68kg
答:配制80kg溶质质量分数为15%的盐水,需要
NaCl固体12kg,水68kg
溶质的质量分数=
溶质质量
溶液质量
×100%
解:
溶剂质量
溶液质量
溶质质量
150Kg
15Kg
135Kg
溶质质量
溶液质量
溶质的质量分数
100%
150Kg
10%
15Kg
溶质质量
溶液质量
溶质的质量分数
在农业生产中,常需要用溶质质量分数为10%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠固体和水的质量各是多少?
【即时检测3】
答:现要配制150Kg质量分数为10%的氯化钠溶液,需要氯化钠固体15Kg和水135Kg 。
【即时检测4】
解:
配制100mL溶质质量分数为50%的氢氧化钠溶液,需要氢氧化钠固体和水的质量各多少?(已知氢氧化钠溶液密度为1.5g/mL)
氢氧化钠的质量=150g×50%
=75g
水的质量=150g-75g=
75g
答:需要氢氧化钠固体75g和水75g
氢氧化钠溶液的质量=100mL×1.5g/mL
根据:溶液的质量(g)
﹦溶液的体积(mL)×溶液的密度(g/mL)
=150g
已知:20℃时食盐的溶解度为36g
36g
100g
136g
饱和溶液 溶质质量(g) 溶剂质量(g) 溶液质量(g)
溶解度含义
溶解度符号
S
100g
S+100g
讨论与交流1
已知一定温度下某溶质的溶解度(S),此温度下该溶质饱和溶液溶质质量分数A%的计算公式
溶解度
100g+溶解度
X100%
A%=
讨论与交流1
【即时检测5】
20℃时,食盐的溶解度是36克。 20℃
时,该饱和食盐溶液溶质质量分数为 。
溶质的质量分数=
=
≈ 26.5%
36g
136g
×100%
溶解度
100g+溶解度
X100%
26.5%
讨论与交流2
一定温度
溶质质量(g) 溶剂质量(g) 溶液质量(g) 溶液状态
溶解度含义 饱和溶液
判断过程 10 g 饱和溶液
注意:当物质未全部溶解时,此时只有溶
解了的物质的质量才是溶质的质量。
36 g
100 g
136 g
3.6 g
13.6 g
已知:20℃时食盐的溶解度为36g
20℃时,NaCl的溶解度是36克。现有50克水放入20克NaCl,固体能否全部溶解 (填“能”或“否”),溶解了 克,所得溶液是 (填“饱和溶液”或“不饱和溶液”),溶液的溶质质量分数 为 .
18g
50g+18g
×100%
≈ 26.5%
解:
【即时检测6】
否
饱和溶液
18
26.5%
课堂总结
1、溶质的质量分数的定义、公式。
2、当物质全部溶解时,投人溶剂中的物质的质量就是溶质的质量,此时直接用有关公式计算。
3、当物质未全部溶解时,此时只有溶解了的物质的质量才是溶质的质量。
谢谢各位同学!
谢谢各位评委老师!
7.3 溶液浓稀的表示
学习目标
1、通过听讲和分析,知道溶质质量分数的含义和计算公式;
2、通过练习计算硫酸铜溶液的溶质质量分数,学会溶质质量分数的简单计算;
3、通过例题解析,了解配制一定溶质质量分数的溶液在实际生产生活中的应用。
null
观察活动
目的:知道有色溶液的颜色深浅与溶液的浓稀相关
步骤:在3支试管A、B、C中各加入10mL的水,再分别加入约0.5g、1g和1.5g固体硫酸铜。观察到这3支试管颜色深浅顺序:__________
A
即时检测1
有色溶液颜色的深浅,可粗略地反映溶液的浓稀,颜色深的溶液 ;颜色浅的溶液 (填“浓”或“稀”)
浓
稀
一、溶质的质量分数
1、概念:溶质质量与溶液质量之比,叫做溶质的质量分数
2、表示方法
溶质的质量分数=
溶质质量
溶液质量
×100%
×100%
溶质质量
溶质质量+溶剂质量
=
溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量
分数
5g 95g
100g 100g
120g 200g
15g 100g
10g 190g
“我行我速”
100g
5%
200g
50%
80g
85g
40%
15%
5%
200g
即时检测2
现在请你回答【实验7-7】第2个实验中猜测的根据
试管编号 溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量分数 溶液颜色深浅
D
E
F
2g
20g
22g
9.1%
0.5g
10g
10.5g
4.8%
1g
5g
6g
16.7%
较深
浅
深
E D F
结论:溶质的质量分数越大,有色溶液的颜色越深,说明它的浓度越大。
溶质质量/g 溶剂质量/g 溶液质量/g 溶质质量
分数
25g 75g
50g 150g
200g 10%
100g 10%
100g 5%
“我变我行”
100g
25%
200g
25%
20g
90g
10g
95g
180g
5g
活学活用:
配制一定量的某一组成的溶液,求所需溶质和溶剂的量。
例1:在农业生产中,常用食盐溶液选种。现要配制80kg溶质质量分数为15%的盐水,需要氯化钠固体和水的质量各多少?
解:由
得溶质质量=溶液质量×溶质的质量分数
故,需要NaCl固体的质量=80kg×15%=12kg
水的质量=80kg-12kg=68kg
答:配制80kg溶质质量分数为15%的盐水,需要
NaCl固体12kg,水68kg
溶质的质量分数=
溶质质量
溶液质量
×100%
解:
溶剂质量
溶液质量
溶质质量
150Kg
15Kg
135Kg
溶质质量
溶液质量
溶质的质量分数
100%
150Kg
10%
15Kg
溶质质量
溶液质量
溶质的质量分数
在农业生产中,常需要用溶质质量分数为10%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠固体和水的质量各是多少?
【即时检测3】
答:现要配制150Kg质量分数为10%的氯化钠溶液,需要氯化钠固体15Kg和水135Kg 。
【即时检测4】
解:
配制100mL溶质质量分数为50%的氢氧化钠溶液,需要氢氧化钠固体和水的质量各多少?(已知氢氧化钠溶液密度为1.5g/mL)
氢氧化钠的质量=150g×50%
=75g
水的质量=150g-75g=
75g
答:需要氢氧化钠固体75g和水75g
氢氧化钠溶液的质量=100mL×1.5g/mL
根据:溶液的质量(g)
﹦溶液的体积(mL)×溶液的密度(g/mL)
=150g
已知:20℃时食盐的溶解度为36g
36g
100g
136g
饱和溶液 溶质质量(g) 溶剂质量(g) 溶液质量(g)
溶解度含义
溶解度符号
S
100g
S+100g
讨论与交流1
已知一定温度下某溶质的溶解度(S),此温度下该溶质饱和溶液溶质质量分数A%的计算公式
溶解度
100g+溶解度
X100%
A%=
讨论与交流1
【即时检测5】
20℃时,食盐的溶解度是36克。 20℃
时,该饱和食盐溶液溶质质量分数为 。
溶质的质量分数=
=
≈ 26.5%
36g
136g
×100%
溶解度
100g+溶解度
X100%
26.5%
讨论与交流2
一定温度
溶质质量(g) 溶剂质量(g) 溶液质量(g) 溶液状态
溶解度含义 饱和溶液
判断过程 10 g 饱和溶液
注意:当物质未全部溶解时,此时只有溶
解了的物质的质量才是溶质的质量。
36 g
100 g
136 g
3.6 g
13.6 g
已知:20℃时食盐的溶解度为36g
20℃时,NaCl的溶解度是36克。现有50克水放入20克NaCl,固体能否全部溶解 (填“能”或“否”),溶解了 克,所得溶液是 (填“饱和溶液”或“不饱和溶液”),溶液的溶质质量分数 为 .
18g
50g+18g
×100%
≈ 26.5%
解:
【即时检测6】
否
饱和溶液
18
26.5%
课堂总结
1、溶质的质量分数的定义、公式。
2、当物质全部溶解时,投人溶剂中的物质的质量就是溶质的质量,此时直接用有关公式计算。
3、当物质未全部溶解时,此时只有溶解了的物质的质量才是溶质的质量。
谢谢各位同学!
谢谢各位评委老师!
