鲁教版九年级化学下册第七单元第一节 酸及其性质 (第2课时) 课件(共25张PPT)
文档属性
| 名称 | 鲁教版九年级化学下册第七单元第一节 酸及其性质 (第2课时) 课件(共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-26 09:04:22 | ||
图片预览







文档简介
(共25张PPT)
第七单元 常见的酸和碱
第一节 酸及其性质 (第2课时)
观察浓硫酸的颜色、状态、浓度、密度等信息。
1.浓硫酸是一种 、 粘稠油状的液体,98%浓硫酸密度为1.84g/ml.
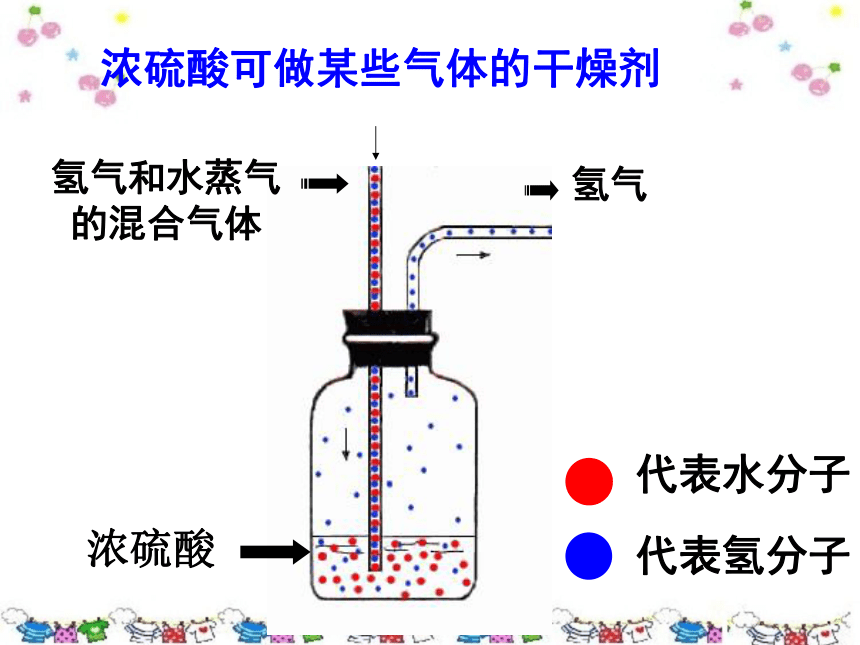
2.浓硫酸极易溶于水,溶于水 热量.能吸收空气中的水蒸气,具有吸水性,可作 。(可干燥氢气、二氧化碳等,不能干燥 .)
无色
无味
干燥剂
放出
氨气
代表水分子
代表氢分子
浓硫酸
氢气和水蒸气
的混合气体
氢气
浓硫酸可做某些气体的干燥剂
浓硫酸敞口放在空气中会有什么变化?
吸收空气中的水分。溶质 ,
溶剂 溶液 溶质质量分数 。
不变
增加
增加
减少
3.浓硫酸具有强烈的 。
脱水性
浓硫酸能夺取含碳、氢、氧等元素组成的化合物里氢、氧元素 , 生成黑色的炭和水。
腐蚀性
能解释蔗糖变黑的原因吗?
友情提示:蔗糖是由碳氢氧三种元素组成的化合物.
浓硫酸溅到皮肤上的处理方法:
立即用大量水冲洗
涂上3%~5%的
碳酸氢钠溶液
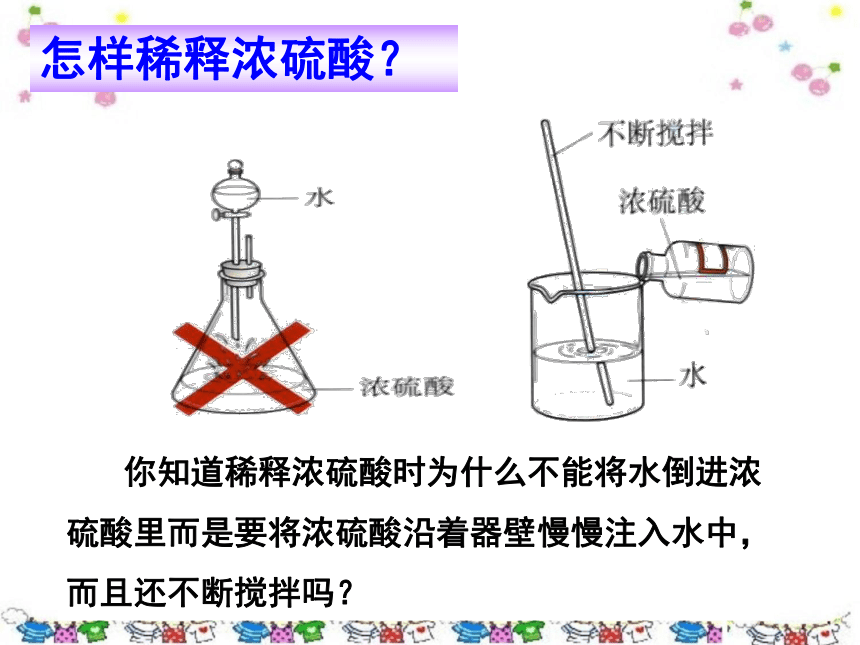
你知道稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着器壁慢慢注入水中,而且还不断搅拌吗?
怎样稀释浓硫酸?
镁带
生锈铁钉
碳酸钠
Mg
Fe2O3
Na2CO3
稀硫酸能与哪些物质发生化学反应?
产生无色气体,镁条消失
铁锈消失,溶液由无色变为黄色
有大量气泡产生
实验探究
Mg + H2SO4 =
Fe2O3 + 3H2SO4 =
Na2CO3 + H2SO4 =
MgSO4 + H2↑
Fe2(SO4)3 + 3H2O
Na2SO4 + H2O + CO2↑
加入稀硫酸后的现象
镁 条
生锈
铁钉
碳酸钠
稀硫酸能否与硝酸钡反应?
Ba(NO3)2 + H2SO4 =BaSO4↓+2HNO3
溶液是否含有SO42- ( SO42-的检验)
取少量样品,加硝酸钡溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
检验硫酸根离子时,能否把硝酸钡溶液换成氯化钡溶液?
不能,因为不能排除Ag+的干扰。
为什么稀硫酸可以与硝酸钡发生化学反应,而稀盐酸却不可以?
原因:
因为酸溶液中都含 有 ,所以酸具有相似的化学性质,称为酸的通性。
H+
又由于不同的酸电离的 不同,因此不同的酸化学性质也有不同之处。
酸根离子
酸的通性
①酸与酸碱指示剂反应
②酸与金属单质反应生成盐和H2
③酸与金属氧化物反应生成盐和H2O
④酸与某些盐反应生成新酸和新盐
2.酸+活泼金属 → + ( 反应)
★金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
从前往后,金属的活动性逐渐减弱
注意:
(1)只有 的金属才可以和酸反应。
(2) 和 与活泼金属反应不生成H2.
(3)铁和稀盐酸或稀硫酸反应后,生成
价铁的化合物,即 和 。
H以前
浓H2SO4
HNO3
+2
FeCl2
FeSO4
盐
H2
置换
判断下列能否发生置换反应?写出有关化学方程式。
1. Mg+HCl 2. Cu+HCl
3. Al+H2SO4 4. Zn+HNO3
5. Na+HCl 6. Fe+H2SO4
Mg+2HCl=MgCl2+H2↑
铜在氢后不反应
2Al+3H2SO4=
Al2(SO4)3+H2↑
硝酸有强氧化性,不是置换反应
Fe+H2SO4=FeSO4+H2↑
2Na+2HCl=
2NaCl+H2↑
3.酸与金属氧化物反应生成
和 。
实验:把黑色的氧化铜粉末放入盛有稀盐酸的试管
实验现象:________________ ___
化学方程式:____________________
盐
水
黑色粉末消失,溶液变成蓝色
4.酸与某些盐反应生成 和 。
新酸
新盐
稀盐酸和稀硫酸都能跟碳酸盐反应,为什么?
铁制品电镀前放在盐酸池中
实验室制取氢气
用醋酸浸泡除去水壶中的水垢
稀硫酸
锌粒
水垢的主要成分:CaCO3
除去铁锈 (主要成分Fe2O3)
酸的用途
1、稀释浓硫酸时,一定要把 沿器壁
慢慢注入 里,并不断搅拌。
2、下列物质 暴露在空气中,质量会增加的
是
A、 浓硫酸 B、 酒精 C、 浓盐酸
浓硫酸
水
A
3、下列物质能和硫酸反应生成黄色溶液
的是
A、 Fe B、Fe2O3 C、Mg D、CaCO3
B
4、酸的溶液具有相似的化学性质,是
因为酸溶液里都含有
A、氢原子 B、氢离子
C、氢分子 D、酸根离子
B
5、下列物质,能由金属跟硫酸直接作用而制得的是 ( )
A.MgSO4 B.Fe2(SO4)3
C.CuSO4 D.Ag2SO4
A
在实验室中制取二氧化碳的剩余液体中一定有 ,可能有 。怎样证明可能含有物质是否存在?
氯化钙
氯化氢
第七单元 常见的酸和碱
第一节 酸及其性质 (第2课时)
观察浓硫酸的颜色、状态、浓度、密度等信息。
1.浓硫酸是一种 、 粘稠油状的液体,98%浓硫酸密度为1.84g/ml.
2.浓硫酸极易溶于水,溶于水 热量.能吸收空气中的水蒸气,具有吸水性,可作 。(可干燥氢气、二氧化碳等,不能干燥 .)
无色
无味
干燥剂
放出
氨气
代表水分子
代表氢分子
浓硫酸
氢气和水蒸气
的混合气体
氢气
浓硫酸可做某些气体的干燥剂
浓硫酸敞口放在空气中会有什么变化?
吸收空气中的水分。溶质 ,
溶剂 溶液 溶质质量分数 。
不变
增加
增加
减少
3.浓硫酸具有强烈的 。
脱水性
浓硫酸能夺取含碳、氢、氧等元素组成的化合物里氢、氧元素 , 生成黑色的炭和水。
腐蚀性
能解释蔗糖变黑的原因吗?
友情提示:蔗糖是由碳氢氧三种元素组成的化合物.
浓硫酸溅到皮肤上的处理方法:
立即用大量水冲洗
涂上3%~5%的
碳酸氢钠溶液
你知道稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着器壁慢慢注入水中,而且还不断搅拌吗?
怎样稀释浓硫酸?
镁带
生锈铁钉
碳酸钠
Mg
Fe2O3
Na2CO3
稀硫酸能与哪些物质发生化学反应?
产生无色气体,镁条消失
铁锈消失,溶液由无色变为黄色
有大量气泡产生
实验探究
Mg + H2SO4 =
Fe2O3 + 3H2SO4 =
Na2CO3 + H2SO4 =
MgSO4 + H2↑
Fe2(SO4)3 + 3H2O
Na2SO4 + H2O + CO2↑
加入稀硫酸后的现象
镁 条
生锈
铁钉
碳酸钠
稀硫酸能否与硝酸钡反应?
Ba(NO3)2 + H2SO4 =BaSO4↓+2HNO3
溶液是否含有SO42- ( SO42-的检验)
取少量样品,加硝酸钡溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
检验硫酸根离子时,能否把硝酸钡溶液换成氯化钡溶液?
不能,因为不能排除Ag+的干扰。
为什么稀硫酸可以与硝酸钡发生化学反应,而稀盐酸却不可以?
原因:
因为酸溶液中都含 有 ,所以酸具有相似的化学性质,称为酸的通性。
H+
又由于不同的酸电离的 不同,因此不同的酸化学性质也有不同之处。
酸根离子
酸的通性
①酸与酸碱指示剂反应
②酸与金属单质反应生成盐和H2
③酸与金属氧化物反应生成盐和H2O
④酸与某些盐反应生成新酸和新盐
2.酸+活泼金属 → + ( 反应)
★金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
从前往后,金属的活动性逐渐减弱
注意:
(1)只有 的金属才可以和酸反应。
(2) 和 与活泼金属反应不生成H2.
(3)铁和稀盐酸或稀硫酸反应后,生成
价铁的化合物,即 和 。
H以前
浓H2SO4
HNO3
+2
FeCl2
FeSO4
盐
H2
置换
判断下列能否发生置换反应?写出有关化学方程式。
1. Mg+HCl 2. Cu+HCl
3. Al+H2SO4 4. Zn+HNO3
5. Na+HCl 6. Fe+H2SO4
Mg+2HCl=MgCl2+H2↑
铜在氢后不反应
2Al+3H2SO4=
Al2(SO4)3+H2↑
硝酸有强氧化性,不是置换反应
Fe+H2SO4=FeSO4+H2↑
2Na+2HCl=
2NaCl+H2↑
3.酸与金属氧化物反应生成
和 。
实验:把黑色的氧化铜粉末放入盛有稀盐酸的试管
实验现象:________________ ___
化学方程式:____________________
盐
水
黑色粉末消失,溶液变成蓝色
4.酸与某些盐反应生成 和 。
新酸
新盐
稀盐酸和稀硫酸都能跟碳酸盐反应,为什么?
铁制品电镀前放在盐酸池中
实验室制取氢气
用醋酸浸泡除去水壶中的水垢
稀硫酸
锌粒
水垢的主要成分:CaCO3
除去铁锈 (主要成分Fe2O3)
酸的用途
1、稀释浓硫酸时,一定要把 沿器壁
慢慢注入 里,并不断搅拌。
2、下列物质 暴露在空气中,质量会增加的
是
A、 浓硫酸 B、 酒精 C、 浓盐酸
浓硫酸
水
A
3、下列物质能和硫酸反应生成黄色溶液
的是
A、 Fe B、Fe2O3 C、Mg D、CaCO3
B
4、酸的溶液具有相似的化学性质,是
因为酸溶液里都含有
A、氢原子 B、氢离子
C、氢分子 D、酸根离子
B
5、下列物质,能由金属跟硫酸直接作用而制得的是 ( )
A.MgSO4 B.Fe2(SO4)3
C.CuSO4 D.Ag2SO4
A
在实验室中制取二氧化碳的剩余液体中一定有 ,可能有 。怎样证明可能含有物质是否存在?
氯化钙
氯化氢
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
