人教版 高中化学 选修四 化学反应原理 全册检测(含解析)
文档属性
| 名称 | 人教版 高中化学 选修四 化学反应原理 全册检测(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 281.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-26 22:44:13 | ||
图片预览




文档简介
绝密★启用前
人教版 化学 选修四 化学反应原理 全册检测
本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷
一、单选题(共10小题,每小题4.0分,共40分)
1.肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O===O为500、N—N 为154,则断裂1 mol N—H键所需的能量(kJ)是( )
A. 194
B. 391
C. 516
D. 658
2.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O==O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A. 436 kJ
B. 557 kJ
C. 920 kJ
D. 618 kJ
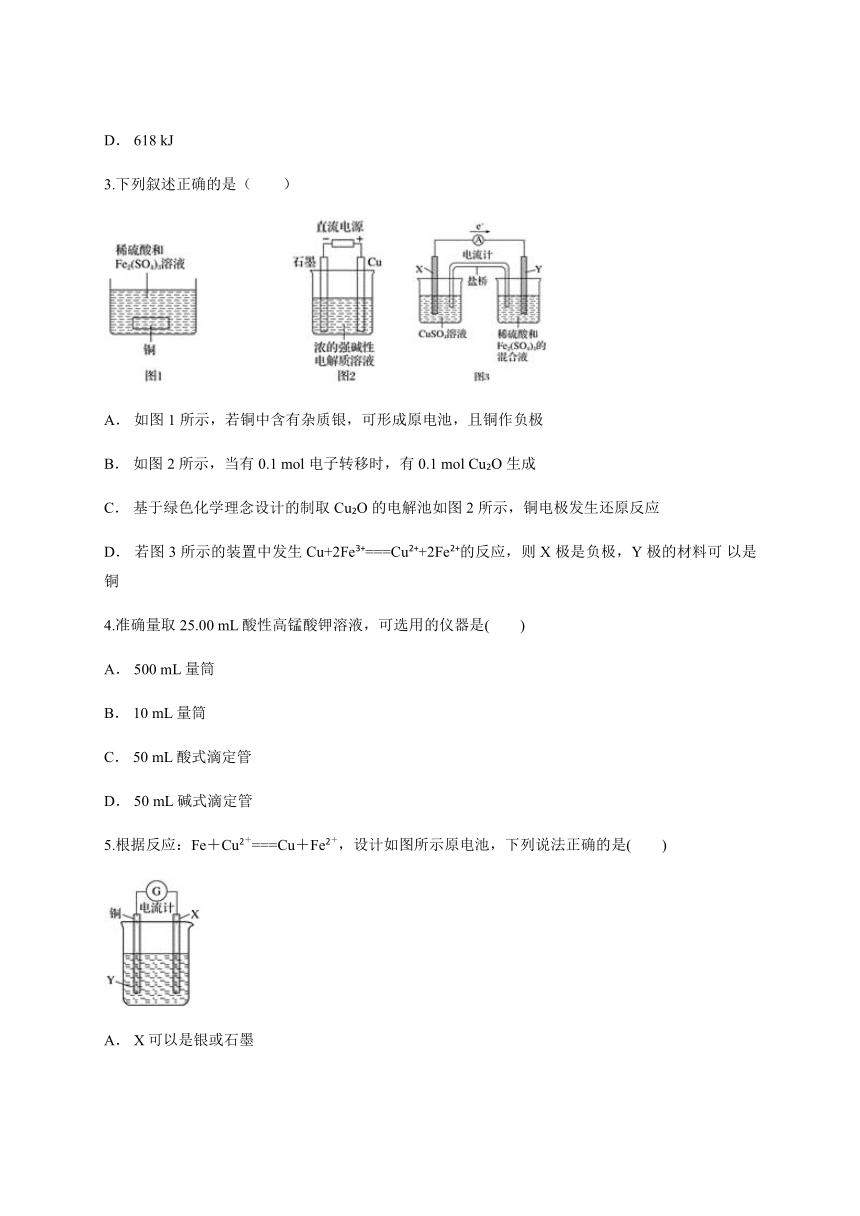
3.下列叙述正确的是( )
A. 如图 1 所示,若铜中含有杂质银,可形成原电池,且铜作负极
B. 如图 2 所示,当有 0.1 mol 电子转移时,有 0.1 mol Cu2O 生成
C. 基于绿色化学理念设计的制取 Cu2O 的电解池如图 2 所示,铜电极发生还原反应
D. 若图 3 所示的装置中发生 Cu+2Fe3+===Cu2++2Fe2+的反应,则 X 极是负极,Y 极的材料可 以是铜
4.准确量取25.00 mL酸性高锰酸钾溶液,可选用的仪器是( )
A. 500 mL量筒
B. 10 mL量筒
C. 50 mL酸式滴定管
D. 50 mL碱式滴定管
5.根据反应:Fe+Cu2+===Cu+Fe2+,设计如图所示原电池,下列说法正确的是( )
A. X可以是银或石墨
B. Y是硫酸铜溶液
C. 电子从铜电极经外电路流向X电极
D. X极上的电极反应式为Cu2++2e-===Cu
6.在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗至熄灭,后又逐渐变亮的是( )
A. 盐酸中逐滴加入食盐溶液
B. 硫酸中逐滴加入NaOH溶液
C. 硫酸中逐滴加入Ba(OH)2溶液
D. 硫酸铜溶液中逐滴加入NaOH溶液
7.工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A. 单位时间内消耗2 mol的CO同时生成2 mol的CO2
B. 两个H—O键断裂的同时有一个H—H键断裂
C. 反应容器内的压强不再发生变化
D. 混合气体的相对分子质量不发生变化
8.如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流表中有电流通过。则下列说法正确的是( )
A. 锌片是负极
B. 两个铜片上都发生氧化反应
C. 石墨是阴极
D. 两个番茄都形成原电池
9.下列关于化学反应的自发性叙述正确的是( )
A. 焓变小于0而熵变大于0的反应肯定是自发的
B. 焓变和熵变都小于0的反应肯定是自发的
C. 焓变和熵变都大于0的反应肯定是自发的
D. 熵变小于0而焓变大于0的反应肯定是自发的
10.用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体。下列说法不正确的是( )
A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式:Cl-+2OH--2e-===ClO-+H2O
C. 阴极的电极反应式:2H2O+2e-===H2↑+2OH-
D. 除去CN-的反应:2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O
二、双选题(共5小题,每小题6.0分,共30分)
11.(双选)下列关于影响化学反应速率的条件说法正确的是( )
A. 增大压强一定能加快化学反应速率
B. 使用催化剂,使反应的活化能降低,反应速率加快
C. 减小反应物浓度,降低了活化分子百分数,从而减小化学反应速率
D. 升高温度,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
12.(双选)对于可逆反应:N2(g)+3H2(g)2NH3(g) ΔH<0。下列说法正确的是( )
A. 达平衡时反应物和生成物的浓度都相等
B. 达平衡后加入N2,当重新达到平衡时,NH3的平衡浓度比原平衡时增大,H2的浓度比原平衡时减少(反应前后体积不变)
C. 达到平衡时,升高温度,加快了吸热反应速率,降低了放热反应速率,所以平衡向逆反应方向移动
D. 达平衡后分离NH3,利于氨气的合成
13.(双选)在500 ℃时,发生可逆反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。向甲容器中充入1 mol SO2和0.5 mol O2,向相同容积的乙容器中充入1 mol SO3。若甲容器保持容积不变,乙容器保持压强不变,分别达平衡,下列说法不正确的是( )
A. 平衡时,容器内的压强:甲>乙
B. 反应达平衡时所需时间:甲<乙
C. 平衡时,氧气的浓度:甲<乙
D. 平衡时,容器内SO3体积分数:甲>乙
14.(双选)下列叙述正确的是( )
A. 碳酸钙难溶于水,放入水中水溶液不导电,且碳酸钙960 ℃时分解不存在熔融状态导电的性质,故CaCO3是非电解质
B. SO2溶于水后得到水溶液导电,所以SO2是电解质
C. BaSO4在水中溶解度很小,但被溶解部分全部电离了,所以BaSO4是强电解质
D. H3PO4晶体在熔融状态下不导电,但溶于水后其水溶液导电,故H3PO4是电解质
15.(双选)浓度均为0.1 mol·L-1的氨水与氯化铵溶液等体积混合后,下列说法正确的是( )
A. 若溶液的pH约为9.7:c()>c(Cl-)>c(OH-)>c(H+)
B.c(H+)+c()=c(OH-)+c(NH3·H2O)
C. 混后溶液中c()+c(NH3·H2O)=c(Cl-)
D. 混合后溶液中c()+c(H+)=c(Cl-)+c(OH-)
第Ⅱ卷
三、非选择题(共3小题,每小题10.0分,共30分)
16.某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol?盐酸、0.55 mol?NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
已知:Q=cm(t2﹣t1),反应后溶液的比热容c为4.18 J?℃﹣1?g﹣1,
各物质的密度均为1 g?cm﹣3。
① 计算完成上表ΔH= (保留2位小数)。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
17.用中和滴定法测定烧碱的纯度,试根据实验回答:
(1)准确称取4.1 g烧碱样品,所用主要仪器是 。
(2)将样品配成250 mL待测液,需要的仪器有 。
(3)取10.00 mL待测液,用 量取。
(4)用0.201 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时手旋转酸式滴定管的玻璃活塞,手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度为,样品烧碱的质量分数为________________。(假设烧碱中不含有与酸反应的杂质)
(6)滴定过程(酚酞作指示剂),下列情况会使测定结果偏高的是 。
①酸式滴定管用水洗后便装液体进行滴定;②碱式滴定管水洗后,就用来量取待测液;
③锥形瓶用蒸馏水洗涤后,又用待测液润洗;④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;⑤盐酸在滴定时溅出锥形瓶外;⑥滴加盐酸,溶液颜色褪去但不足半分钟又恢复红色;⑦滴定前,酸式滴定管有气泡,滴定后消失;⑧记录起始体积时,仰视读数,终点时俯视。
18.A、B、C为三种强电解质,它们在水中电离出的离子如下表所示:
图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。据此回答下列问题:
(1)M为电源的________(填“正”或“负”)极,电极b上发生的电极反应为______________________。
(2)写出乙烧杯中的电池反应方程式:________________________。
(3)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?________________________________________________________________________
________________________________________________________________________。
(4)若经过这一段时间后,要使丙恢复到原来的状态,需要进行的操作是__________________________。
答案解析
1.【答案】B
【解析】1 mol N2H4和1 mol O2变成原子时断键需要的能量为2 752 kJ-534 kJ=2 218 kJ,肼和氧气断键变为原子时要断裂1 mol N—N、4 mol N—H、1 mol O==O键,所以1 mol×154 kJ·mol-1+4 mol×E(N—H)+1 mol×500 kJ·mol-1=2 218 kJ,解得断裂1 mol N—H键所需能量为391 kJ。
2.【答案】A
【解析】1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,可知H2(g)+O2(g)===H2O(g)ΔH=﹣242 kJ·,
设1 mol H—H键断裂时吸收热量为x,
焓变等于反应物中键能之和减去生成物中键能之和,
则x+×496﹣2×463 =-242,
解得x=436 kJ,
故选A。
3.【答案】A
【解析】如图 1 所示,若铜中含有杂质银,则铜能还原三价铁离子,所以能构成原电池,并且活泼铜作负极,A正确;电极方程式为2Cu﹣2e﹣+2OH﹣===Cu2O+H2O,当有0.1 mol电子转移时,有0.05 mol Cu2O生成,B错误;Cu被氧化生成Cu2O,应为电解池的阳极反应,发生氧化反应,故C错误;若图3 所示的装置中发生 Cu+2Fe3+===Cu2++2Fe2+的反应,则Cu为负极即X极是负极,Y极为正极,正极应为不如铜活泼的金属或者非金属,所以Y极的材料不可以是铜,D错误。
4.【答案】C
【解析】中学阶段读数记录到0.1 mL的用量筒,记录读数到0.01 mL用滴定管,由此淘汰A、B;酸式滴定管用玻璃活塞控制滴液,碱式滴定管用橡胶管与玻璃珠控制滴液。酸性高锰酸钾溶液具有强氧化性,会氧化橡胶,只能选用酸式滴定管,C正确。
5.【答案】B
【解析】由反应Fe+Cu2+===Cu+Fe2+知,铁为负极,X为铁极,A错;电解质溶液应含Cu2+,B对;在原电池中,电子从负极经外电路流向正极,C错;Cu2+在正极铜上得电子,Cu2++2e-===Cu,D错。
6.【答案】C
【解析】溶液的导电能力与电解质电离程度、溶质浓度和离子所带的电荷数有关。盐酸中加入食盐溶液,溶液中增加了NaCl,导电性增强,A错误;硫酸与NaOH反应生成硫酸钠,溶液电荷浓度不可能为0,B错误;Ba(OH)2+H2SO4===BaSO4↓+2H2O,溶液电荷浓度接近0,灯泡熄灭, 继续加入Ba(OH)2溶液时离子浓度增加,灯泡逐渐变亮,C正确;CuSO4+2NaOH===Cu(OH)2+Na2SO4,溶液电荷浓度不可能为0,灯泡不可能熄灭,D错误。
7.【答案】B
【解析】A项描述的反应速率都是v正,无法判断是否达到平衡;B项说明H2O的分解速率(v正)与H2的消耗速率(v逆)相等,即v正(H2O)=v逆(H2O),能判断反应达到平衡;C项,由于该反应前后气体的物质的量不变,故压强始终不变,不能说明可逆反应达到平衡;D项,混合气体的质量不变,物质的量不变,反应前后混合气体的相对分子质量不变,故不能说明反应达到平衡状态。
8.【答案】A
【解析】根据图示推知左侧为原电池,其中Zn作负极,Cu作正极,Cu片上发生还原反应;右侧为电解池,其中Cu为阴极,发生还原反应,C为阳极,发生氧化反应。
9.【答案】A
【解析】ΔG=ΔH-TΔS,ΔG<0时,反应能自发进行,当ΔH>0,ΔS>0时,ΔG=ΔH-TΔS的正负与T有关,C错误;当ΔH>0,ΔS<0时,ΔG=ΔH-TΔS>0,非自发反应,D错误;当ΔH<0,ΔS>0时,ΔG=ΔH-TΔS<0,一定是自发反应,A正确;当ΔH<0,ΔS<0时,ΔG=ΔH-TΔS的正负与T有关,B错误。
10.【答案】D
【解析】阳极要产生ClO-,铁只能作阴极,不能作阳极,否则就是铁失电子,A正确;Cl-失电子产生ClO-,电极反应式:Cl-+2OH--2e-===ClO-+H2O,B正确;阴极是H+产生H2,溶液呈碱性,电极反应式:2H2O+2e-===H2↑+2OH-,C正确;pH为9~10的碱性溶液不可能有H+参加反应,除CN-的反应为2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-,D错误。
11.【答案】BD
【解析】压强只影响有气体参加的化学反应,A项错误;减小反应物浓度,减小了单位体积中分子总数,活化分子百分数不变,单位体积中有效碰撞次数减小,反应速率减小,C项错误。
12.【答案】BD
【解析】可逆反应达到平衡后,各物质的浓度不再发生改变,但不一定相等,A项错误;加入N2,反应物的浓度增大,平衡正移,产物的浓度增大,另一反应物H2的转化率提高,浓度减小,B项正确;升温,正、逆反应速率均增大,C项错误;分离NH3后,产物浓度减小,平衡正向移动,利于氨气的合成,D项正确。
13.【答案】CD
【解析】被比较对象只有放在一个前后变化的过程中才能比较。相同温度相同起始量恒压与恒容建立平衡的比较,一般先分析恒压容器体积如何变化,后以恒容容器的平衡状态为起始状态(常称“先同”),改变体积到恒压时的要求,在改变中实现比较(常称“后变”)。乙容器中充入1 mol SO3,它与乙容器中充入1 mol SO2和0.5 mol O2,形成完全等效平衡状态,达到平衡时压强、氧气浓度,SO3体积分数相同,可以和甲进行比较。对于恒压乙容器,因反应造成气体分子数减小,建立平衡时容器体积需同步减小;此平衡状态可看成恒容甲容器平衡状态增加压强而成,此过程平衡正向移动,气体总量减小,压强减小,A项正确;O2的浓度减小,C项错误;SO3体积分数增多,D项错误。乙为恒压容器,加入1 mol SO3反应向逆向进行,混合气体分子数增多,为保证压强不变,只能同步增大体积,SO3的浓度减小,速率变慢,达平衡所需时间乙容器长:甲<乙,B项正确。
14.【答案】CD
【解析】碳酸钙、BaSO4难溶于水,但溶解的部分完全电离,是强电解质,A项错误、C项正确;SO2+H2OH2SO3,H2SO3H++,使溶液导电,H2SO3是弱电解质,SO2是非电解质,B项错误;H3PO4是弱酸,溶于水后可部分电离,为弱电解质,D项正确。
15.【答案】AD
【解析】一水合氨和氯化铵等物质的量浓度的混合溶液中,NH3·H2O+OH-,+H2ONH3·H2O +H+,若溶液的pH约为9.7,溶液显示碱性,c(OH-)>c(H+),说明NH3·H2O的电离程度大于的水解程度,水解可以忽略,则c()>c(Cl-)>c(NH3·H2O);则溶液中离子浓度大小关系为c()>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+),A正确;NH4Cl和NH3·H2O溶液中存在电荷守恒:c(H+)+c()=c(OH-)+c(Cl-),前者为强电解质,后者为弱电解质,则c(Cl-)>c(NH3·H2O),综合得c(H+)+c()>c(OH-)+c(NH3·H2O),B错误,D正确;铵根原子团溶液中主要以一水合氨和铵根二种形式存在,其浓度是氯离子的二倍,物料守恒可表达为c()+c(NH3·H2O)=2c(Cl-),C错误。
16.【答案】(1)量筒 温度计 (2)否 金属易导热,热量散失导致误差大
(3)①-56.85 ②HCl(aq)+NaOH(aq)====NaCl(aq)+H2O(l)ΔH=-56.8 kJ?
(4)无 有
【解析】(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少温度计和量筒。
(2)不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大。
(3)①第1次实验反应前后温度差为3.3 ℃,第2次实验反应前后温度差为3.5 ℃,平均温度差为3.4 ℃,50 mL 0.55 mol?NaOH溶液与50 mL 0.5 mol?HCl溶液的质量和为m=100 mL×1g·=100 g,c=4.18 J·?,代入公式Q=cmΔT得生成0.05 mol的水放出热量Q=4.18 J·?×100 g×3.4 ℃=1 421.2 J=1.421 2 kJ,即生成0.025 mol的水放出热量为1.421 2 kJ,所以生成1 mol的水放出热量为=56.85 kJ,即该实验测得的中和热ΔH=﹣56.85 kJ·。
②稀盐酸和NaOH稀溶液反应生成1 mol水放热56.8 kJ,该反应的热化学方程式为HCl(aq)+NaOH(aq)====NaCl(aq)+H2O(l)ΔH=﹣56.8 kJ?。
(4)KOH代替NaOH都是强碱,符合中和热的概念,所以用KOH代替NaOH,对测定结果无影响;醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量小于56.8 kJ,ΔH偏大。
17.【答案】(1)天平、小烧杯、药匙
(2)烧杯、玻璃棒、250 mL容量瓶、胶头滴管
(3)碱式滴定管或移液管
(4)左 右 锥形瓶中溶液颜色的变化
(5)0.402 0 mol·L-198.05%
(6)①③⑤⑦
【解析】(1)氢氧化钠容易潮解,具有很强的腐蚀性,称量时应该放在小烧杯中称量,所以称量使用的仪器有:托盘天平、药匙、烧杯。(2)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250 mL容量瓶中,并用玻璃棒引流,当加入至液面距离刻度线1~2 cm时,改用胶头滴管滴加,所以需要的仪器是:托盘天平、药匙、烧杯、玻璃棒、250 mL容量瓶、胶头滴管。(3)待测液是碱性溶液,用碱式滴定管量取,也可用移液管量取。(4)滴定时,滴定时左手旋转滴定管的玻璃活塞,右手摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达。(5)两次消耗的标准液的体积分别为19.90 mL、20.10 mL,两次滴定数据都是有效的,所以消耗标准液平均体积为20.00 mL,根据c(待测)==[0.201 0 mol·L-1×0.02 L] ÷0.01 L=0.402 0 mol·L-1,则样品中烧碱的物质的量为0.402 0 mol·L-1×0.25 L=0.100 5 mol,故烧碱样品的纯度为:0.100 5 mol×40 g·mol-1÷4.1 g×100%=98.05%。(6)①酸式滴定管用水洗后便装液体进行滴定,溶液被稀释,所用盐酸体积偏大,所测NaOH溶液浓度偏大,正确;②碱式滴定管用水洗后,就用来量取待测液,待测液的物质的量偏小,所用盐酸体积偏小,所测NaOH溶液浓度偏小,错误;③锥形瓶用蒸馏水洗涤后,又用待测液润洗,待测液的物质的量偏大,所用盐酸体积偏大,所测NaOH溶液浓度偏大,正确;④滴定过快成细流,将碱液溅到锥形瓶壁而又未摇匀洗下,所用盐酸体积偏小,所测NaOH溶液浓度偏小,错误;⑤盐酸在滴定时溅出锥形瓶外,所用盐酸体积偏大,所测NaOH溶液浓度偏大,正确;⑥滴加盐酸,颜色不足半分钟又恢复红色,未完全反应,所用盐酸体积偏小,所测NaOH溶液浓度偏小,错误;⑦滴定前,酸式滴定管有气泡,滴定后消失,所用盐酸体积偏大,所测NaOH溶液浓度偏大,正确;⑧记录起始体积时,仰视读数,终点时俯视,所用盐酸体积偏小,所测NaOH溶液浓度偏小,错误;故答案为①③⑤⑦。
18.【答案】(1)负 4OH--4e-===2H2O+O2↑
(2)2CuSO4+2H2O2Cu+O2↑+2H2SO4
(3)能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应
(4)向丙烧杯中加入一定量水
【解析】(1)乙中c电极质量增加,则c处发生的反应为Cu2++2e-===Cu,即c电极为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。测得乙中c电极质量增加,说明有金属析出,则乙溶液中含Cu2+,而Cu2+只能和SO结合,可以确定B为硫酸铜;由常温下各烧杯中溶液的pH与电解时间t的关系图,可以确定A为KOH或NaOH溶液,C为Na2SO4或K2SO4。甲中为KOH或NaOH溶液,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-===2H2O+O2↑。(2)乙烧杯中是电解CuSO4溶液,反应方程式为2CuSO4+2H2O2Cu+O2↑+2H2SO4。(3)乙中铜全部析出后,电解质变为H2SO4,所以电解反应仍能继续进行。
