鲁科版高中化学必修一 1.3 化学中常用的物理量——物质的量(共19张ppt)
文档属性
| 名称 | 鲁科版高中化学必修一 1.3 化学中常用的物理量——物质的量(共19张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-30 09:47:21 | ||
图片预览

文档简介
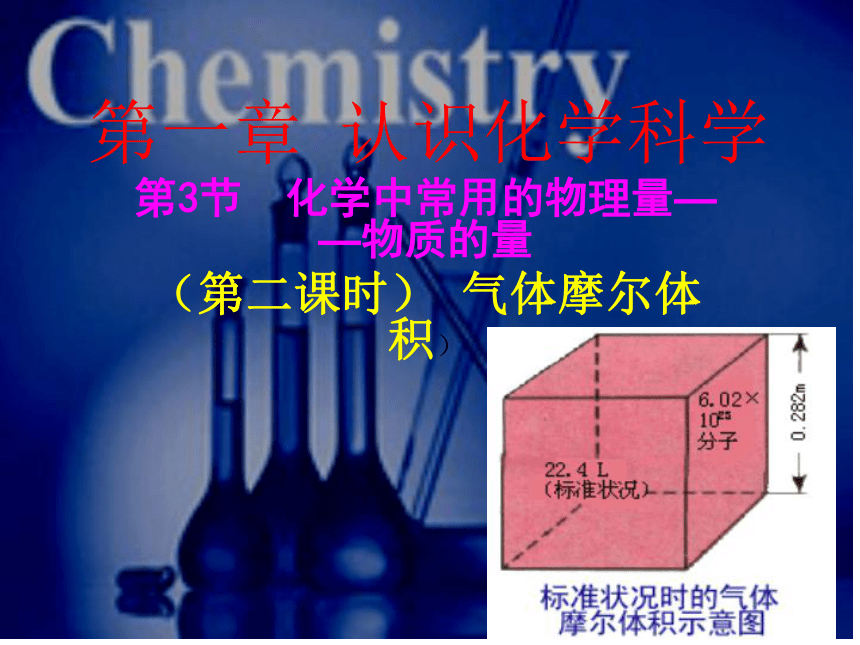
课件19张PPT。第一章 认识化学科学第3节 化学中常用的物理量——物质的量
(第二课时) 气体摩尔体积)微粒数
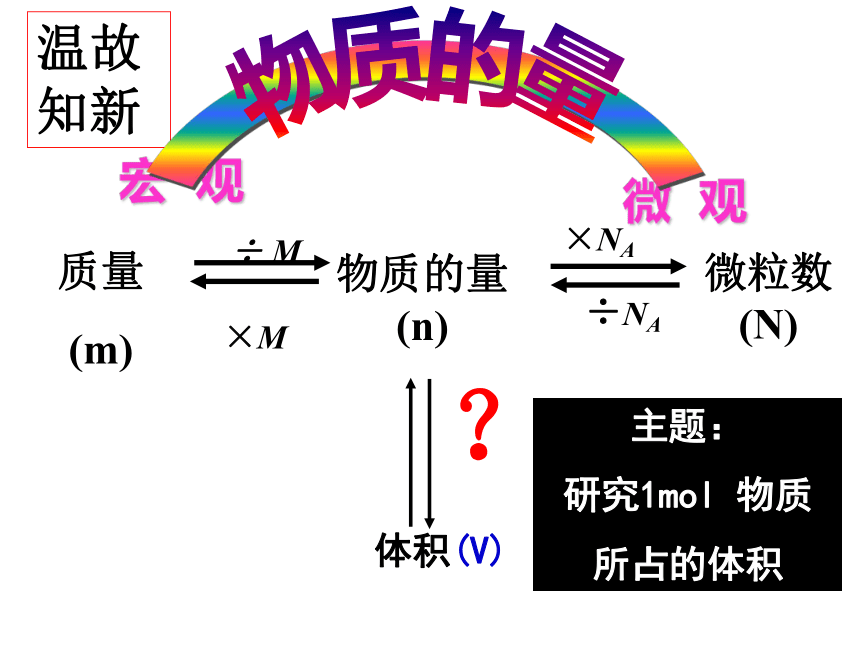
(N) ×NA ÷ M物质的量(n) 质量
(m) ×M ÷NA温故知新体积(V)?主题:
研究1mol 物质
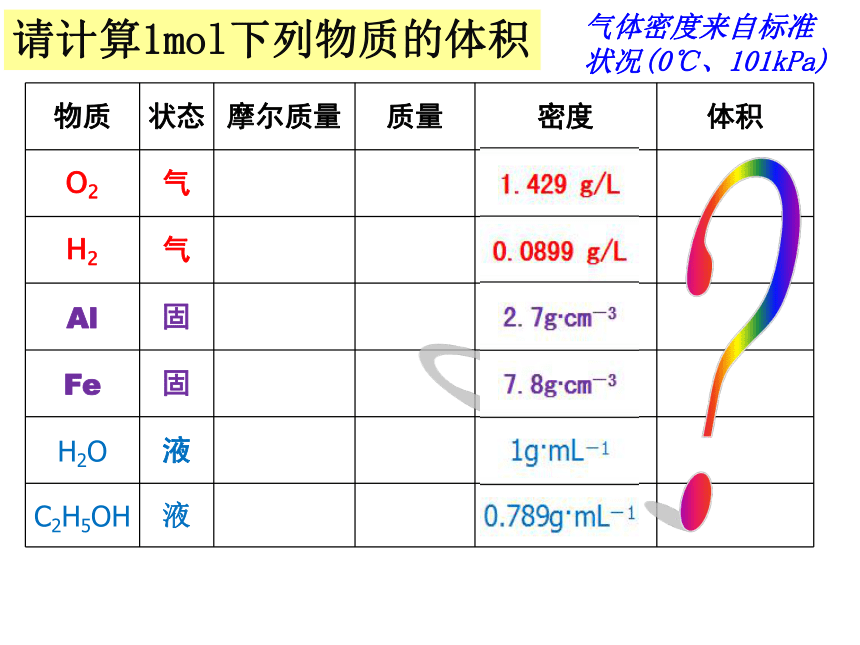
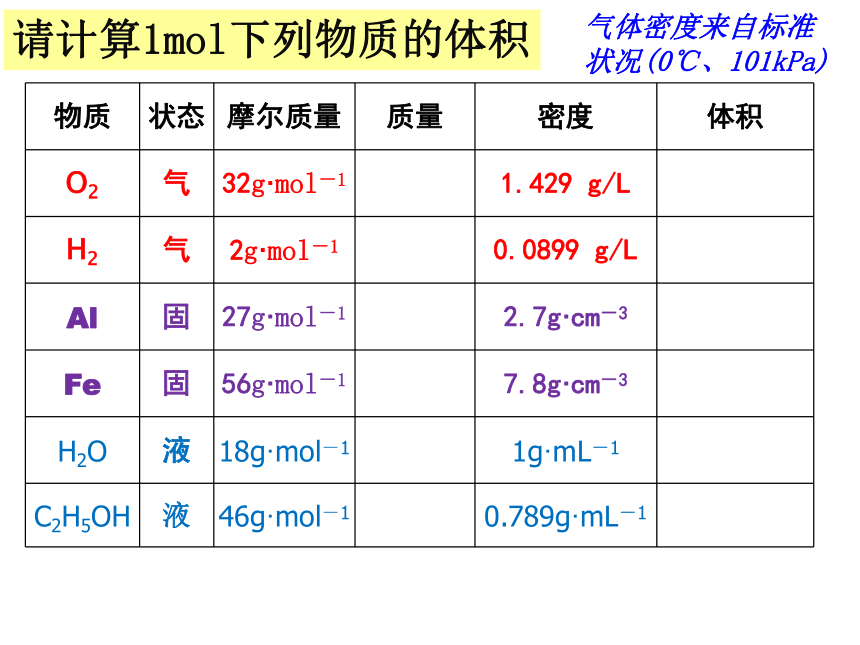
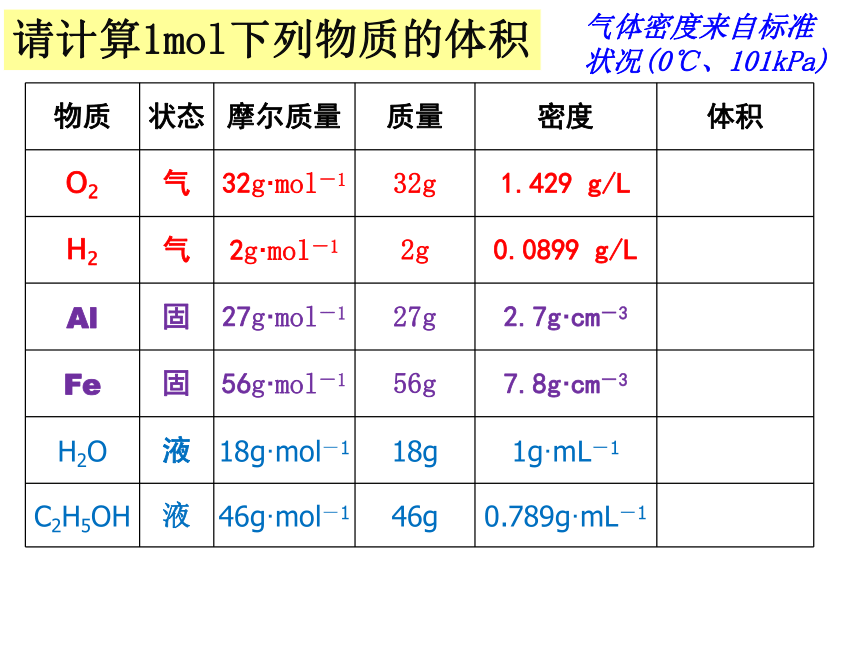
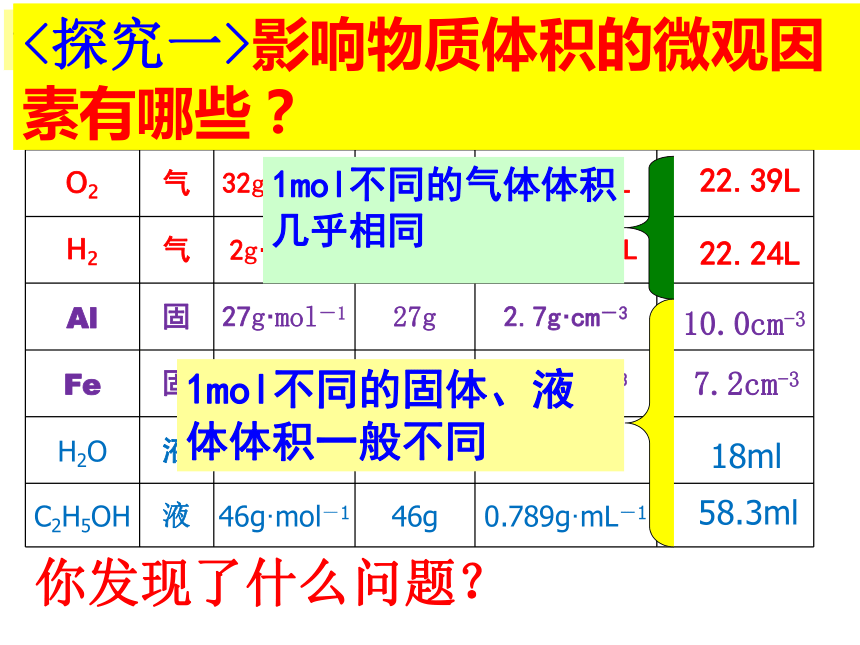
所占的体积宏 观微 观物质的量请计算1mol下列物质的体积气体密度来自标准状况(0℃、101kPa)?请计算1mol下列物质的体积气体密度来自标准状况(0℃、101kPa)请计算1mol下列物质的体积气体密度来自标准状况(0℃、101kPa)气体密度来自标准状况(0℃、101kPa)请计算1mol下列物质的体积22.39L
22.24L10.0cm-3
7.2cm-3
18ml
58.3ml
你发现了什么问题?1mol不同的固体、液体体积一般不同1mol不同的气体体积
几乎相同
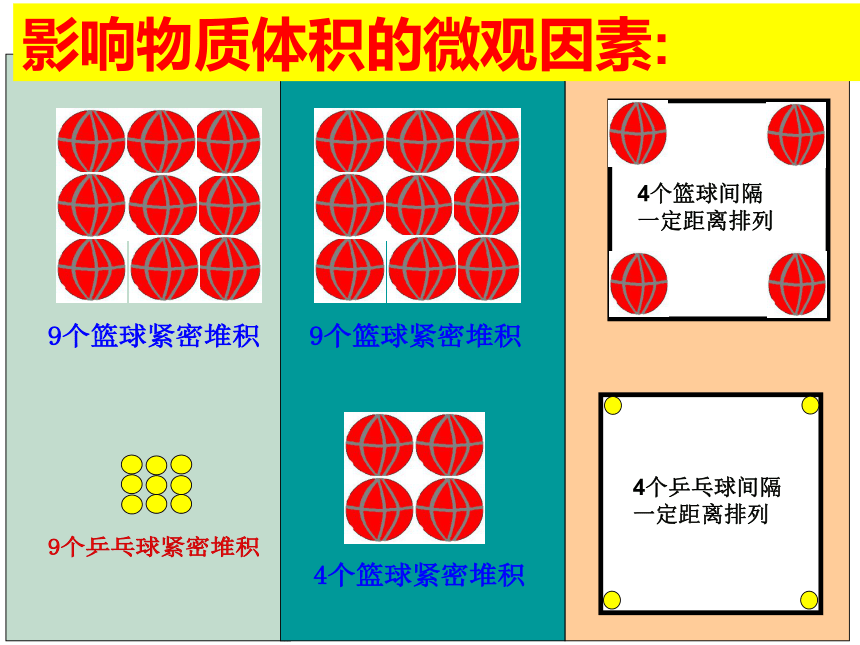
<探究一>影响物质体积的微观因素有哪些?影响物质体积的微观因素:<探究二>1 mol固体、液体、气体的体积主要由哪种因素决定呢?粒子大小粒子间距<探究三>从宏观上看来,温度和压强是影响气体的主要因素,从微观角度怎样解释这种影响呢??类比:单位物质的量的物质
所具有的质量Mg/mol或kg/molM=m/n一定温度和压强下,单位物质的量的气体所占的体积VmL/mol或m3/mol气体摩尔体积类比:单位物质的量的物质
所具有的质量Mg/mol或kg/molM=m/n一定温度和压强下,单位物质的量的气体所占的体积VmL/mol或m3/mol气体摩尔体积Vm=V/n
(1)标准状况下,0.5mol H2占有的体积是____ L。
(2)标准状况下,2mol O2占有的体积是____L。
(3)标准状况下,4.48L CO2的物质的量是____mol
(4)标准状况下,33.6L H2的物质的量是____mol
11.244.80.21.5想一想Vm=V/n下列说法是否正确,为什么?
1.1molCl2的体积约是22.4L
2.在标准状况下,1molH2O的体积约是22.4L
3 .标准状况下, 任何气体的体积约为22.4L
4. 200C、1.01×105Pa时,1molO2的体积必定大于22.4L
5. 200C时,1mol任何气体的体积总比22.4L大
6.1mol任何气体只有在标准状况下才是 22.4L
7.标准状况下,CO2气体摩尔体积是22.4L
8.标准状况下, 1molN2和O2混合气体的体积约为22.4L√×××××√×练一练<探究五>在理解和运用标准状况下气体摩尔体积时,应该注意什么问题?<探究五>在理解和运用标准状况下气体摩尔体积时,应该注意什么问题?
①条件:标准状况
②物质的量:1mol
③对象:只适用于气体
(单一或混合气体)
④体积:22.4 L注意微粒数
(N) ×NA ÷ M物质的量(n) 质量
(m) ×M ÷NA体积(V)知识总结: ÷ Vm ×Vm例题:1.标准状况下,33.6L O2的质量是多少?含有的微粒数是多少?
2.一定温度和压强下,a L Cl2 和 a L N2的分子数各是多少?两者的分子数之比呢? 学以致用在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。这是阿伏加德罗定律(称“四同定律”或“三同定一同”)微粒数
(N) ×NA ÷ M物质的量(n) 1.质量
(m) ×M ÷NA体积(V) ÷ Vm ×Vm知识总结: 2.阿伏加德罗定律
(第二课时) 气体摩尔体积)微粒数
(N) ×NA ÷ M物质的量(n) 质量
(m) ×M ÷NA温故知新体积(V)?主题:
研究1mol 物质
所占的体积宏 观微 观物质的量请计算1mol下列物质的体积气体密度来自标准状况(0℃、101kPa)?请计算1mol下列物质的体积气体密度来自标准状况(0℃、101kPa)请计算1mol下列物质的体积气体密度来自标准状况(0℃、101kPa)气体密度来自标准状况(0℃、101kPa)请计算1mol下列物质的体积22.39L
22.24L10.0cm-3
7.2cm-3
18ml
58.3ml
你发现了什么问题?1mol不同的固体、液体体积一般不同1mol不同的气体体积
几乎相同
<探究一>影响物质体积的微观因素有哪些?影响物质体积的微观因素:<探究二>1 mol固体、液体、气体的体积主要由哪种因素决定呢?粒子大小粒子间距<探究三>从宏观上看来,温度和压强是影响气体的主要因素,从微观角度怎样解释这种影响呢??类比:单位物质的量的物质
所具有的质量Mg/mol或kg/molM=m/n一定温度和压强下,单位物质的量的气体所占的体积VmL/mol或m3/mol气体摩尔体积类比:单位物质的量的物质
所具有的质量Mg/mol或kg/molM=m/n一定温度和压强下,单位物质的量的气体所占的体积VmL/mol或m3/mol气体摩尔体积Vm=V/n
(1)标准状况下,0.5mol H2占有的体积是____ L。
(2)标准状况下,2mol O2占有的体积是____L。
(3)标准状况下,4.48L CO2的物质的量是____mol
(4)标准状况下,33.6L H2的物质的量是____mol
11.244.80.21.5想一想Vm=V/n下列说法是否正确,为什么?
1.1molCl2的体积约是22.4L
2.在标准状况下,1molH2O的体积约是22.4L
3 .标准状况下, 任何气体的体积约为22.4L
4. 200C、1.01×105Pa时,1molO2的体积必定大于22.4L
5. 200C时,1mol任何气体的体积总比22.4L大
6.1mol任何气体只有在标准状况下才是 22.4L
7.标准状况下,CO2气体摩尔体积是22.4L
8.标准状况下, 1molN2和O2混合气体的体积约为22.4L√×××××√×练一练<探究五>在理解和运用标准状况下气体摩尔体积时,应该注意什么问题?<探究五>在理解和运用标准状况下气体摩尔体积时,应该注意什么问题?
①条件:标准状况
②物质的量:1mol
③对象:只适用于气体
(单一或混合气体)
④体积:22.4 L注意微粒数
(N) ×NA ÷ M物质的量(n) 质量
(m) ×M ÷NA体积(V)知识总结: ÷ Vm ×Vm例题:1.标准状况下,33.6L O2的质量是多少?含有的微粒数是多少?
2.一定温度和压强下,a L Cl2 和 a L N2的分子数各是多少?两者的分子数之比呢? 学以致用在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。这是阿伏加德罗定律(称“四同定律”或“三同定一同”)微粒数
(N) ×NA ÷ M物质的量(n) 1.质量
(m) ×M ÷NA体积(V) ÷ Vm ×Vm知识总结: 2.阿伏加德罗定律
