山东省鱼台一中2019-2020学年高二上学期期中考试化学试题
文档属性
| 名称 | 山东省鱼台一中2019-2020学年高二上学期期中考试化学试题 |

|
|
| 格式 | zip | ||
| 文件大小 | 370.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-01 00:00:00 | ||
图片预览



文档简介
2019~2020学年度第一学期期中考试
高二化学试题
2019.11
说明:
1.本试卷分第Ⅰ卷和第Ⅱ卷,全卷满分100分,考试时间90分钟。
2.答卷前请将答题纸上有关项目填、涂清楚,将第Ⅰ卷题目的答案用2B铅笔涂在答题纸上,第II卷题目的答案用0.5mm黑色中性笔写在答题纸的相应位置上,写在试卷上的答案无效。
3.可能用到的相对原子质量:
H 1 C 12 N 14 0 16 Na 23 S 32 C1 35.5 Fe 56
第Ⅰ卷(选择题 共48分)
一、选择题(包括24小题,每小题2分,共计48分。每小题只有一个选项符合题意。)
1.下列化学变化中,生成物的总能量高于反应物的总能量的是( )
A.硝酸铵溶于水 B.生石灰溶于水
C.铝热反应 D.灼热的C与C02反应
2.能源与我们的日常生活密切相关,下列有关叙述中错误的是( )
A.我国目前使用的主要能源是化石燃料,属于不可再生能源
B.提高燃料的燃烧效率对于节约能源十分重要
C.氢能是一种理想的绿色能源,现在的科技水平已经能够全面推广使用氢能
D.科学家正在研究开发太阳能、风能、潮汐能等新能源,并取得了一定进展
3.下列反应中熵显著增加的是( )
A.2N205(g) = 4N02(g) +02(g) B.Cu(s)+Cl2(g) = CuCl2(s)
C.C(s) + 02(g) = C02(g) D.2H2(g) + 02(g) = 2H2O(1)
4.下列做法与盐的水解无关的是( )
A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B.配制FeCl2溶液时常常要在溶液中加入少量铁粉
C.厨房中常用碳酸钠溶液洗涤餐具上的油污
D.施肥时,草木灰(有效成分为K2CO3)不能与碳铵混合使用
5.一定条件下,在水溶液中1molCl-,ClOx- (x=1,2,3,4)的能量(kJ)相对大小如下图所示.下列有关说法正确的是( )
A.e是ClO3-
B.a,b,c,d,e中c最稳定
C.b→a+d反应的热化学方程式为
3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=-116kJ?mol-1
D.一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为10:1:2
6.已知T℃时,CaCO3(s) = CaO(s) + C02(g) ΔH=+177. 70 kJ·mol-l,则每生成28gCa0(s)时,吸收的热量为( )
A. 44.43 kJ B. 88.85 kJ
C. 133.28 kJ D. 177.70 kJ
7.有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
⑦增加X ⑧增加Y
A.①③⑤⑦ B.②③⑤⑦
C.②③⑥⑧ D.②④⑥⑧
8.-定温度下,在密闭容器中进行反应:N2(g)+02(g) 2NO(g),下列措施不能改变化学反应速率的是( )
A.恒容,充人氦气 B.恒容,充入氮气
C.恒压,充人氦气 D.加入催化剂
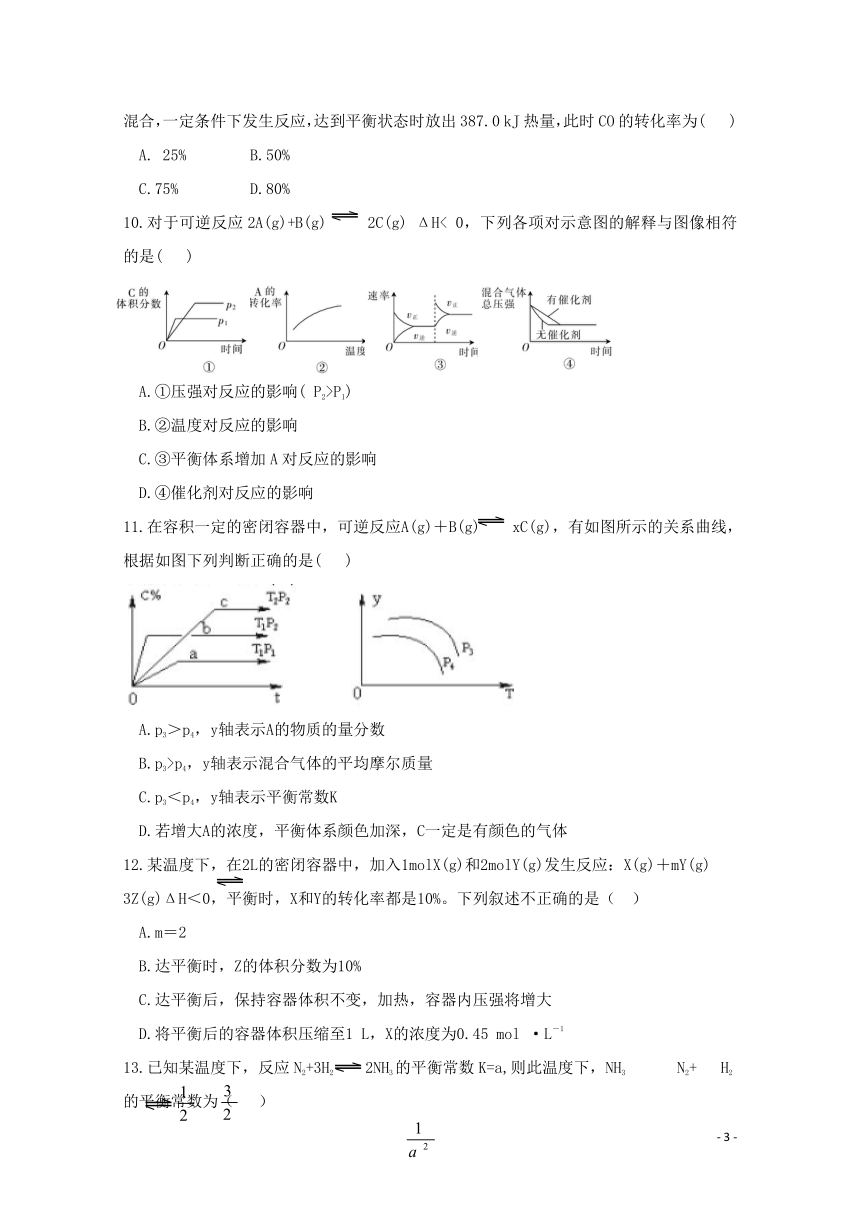
9.已知反应:CO(g)+2H2(g) CH3OH(g) ΔH=-129.O kJ·mol-l。 现将4molCO与8molH2混合,一定条件下发生反应,达到平衡状态时放出387.0 kJ热量,此时CO的转化率为( )
A. 25% B.50%
C.75% D.80%
10.对于可逆反应2A(g)+B(g) 2C(g) ΔH< 0,下列各项对示意图的解释与图像相符的是( )
A.①压强对反应的影响( P2>P1)
B.②温度对反应的影响
C.③平衡体系增加A对反应的影响
D.④催化剂对反应的影响
11.在容积一定的密闭容器中,可逆反应A(g)+B(g) xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
A.p3>p4,y轴表示A的物质的量分数
B.p3>p4,y轴表示混合气体的平均摩尔质量
C.p3<p4,y轴表示平衡常数K
D.若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体
12.某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g) 3Z(g)ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是( )
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1 L,X的浓度为0.45 mol ·L-1
13.已知某温度下,反应N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3 N2+ H2的平衡常数为( )
A. B. C. D.
14.下列说法不正确的是( )
A.水的离子积常数为10-14
B.向纯水中加入少量NaHSO4,c(H+)增大
C.100℃时,pH=7的水溶液呈碱性
D.纯水呈中性是因为c(H+)=c(OH-)
15.将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体,都会引起 ( )
A.溶液中c(CH3COO—)减小 B.溶液的pH增加
C.溶液的导电能力减弱 D.溶液中c(OH—)减小
16.下列关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
17.室温下,某溶液中由水电离出来的H+和OH-浓度的乘积为10-24,则此溶液中可能大量共存的离子组是( )
A.HCO3- 、Al3+ 、Na+ 、SO42- B.I- 、 NO3-、 K+ 、NH4+
C.MnO4- 、Cl- 、Fe3-、 K+ D.SiO32- 、SO32- 、Na+ 、Cl-
18.下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液的pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1 mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥0.1 mol/L HNO2溶液稀释至溶液稀释至100倍,pH约为3.1
A.①④⑥ B.①④⑤⑥ C.①②③④ D.全部
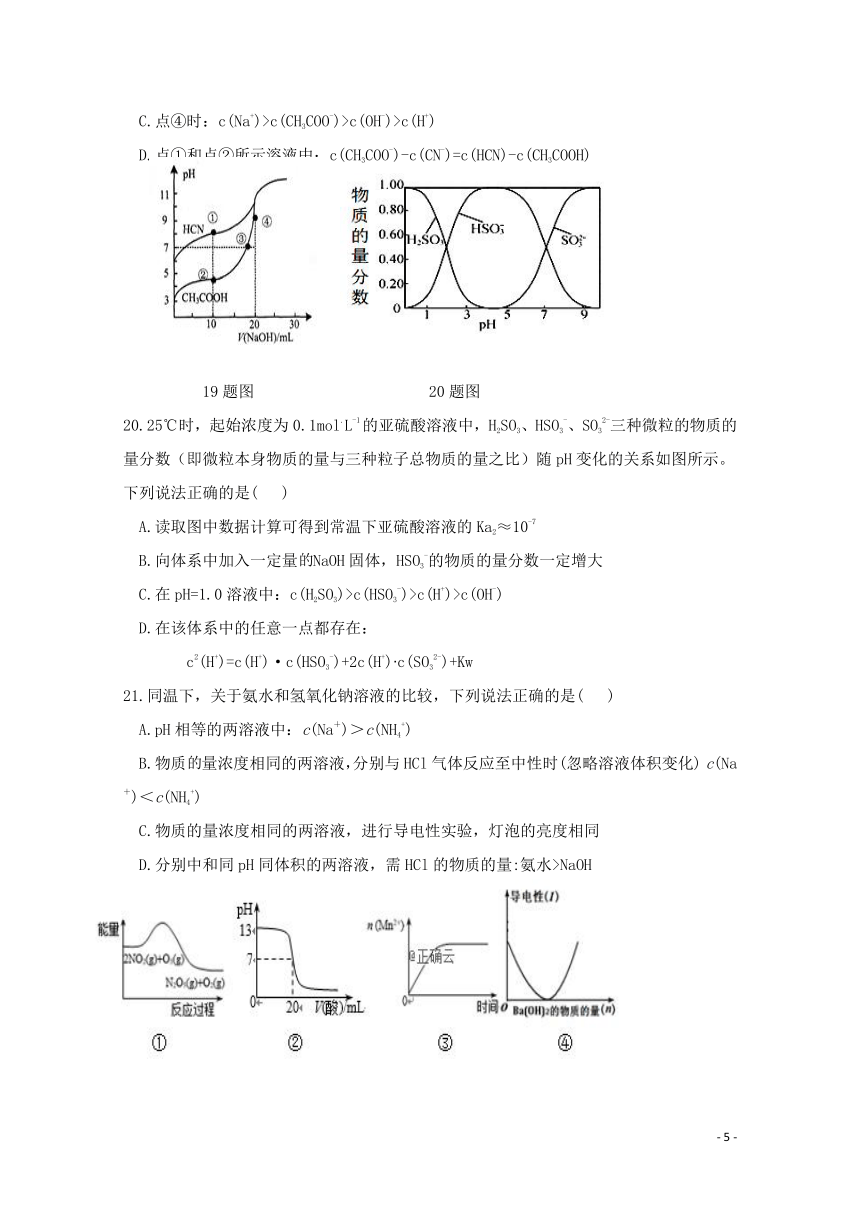
19.常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.1000 mol·L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如下图。下列说法不正确的是( )
A.点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-)
B.点③时:c(Na+)=c(CH3COO-)>c(H+)
C.点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
19题图 20题图
20.25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是( )
A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向体系中加入一定量NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:
c2(H+)=c(H+)·c(HSO3-)+2c(H+)?c(SO32-)+Kw
21.同温下,关于氨水和氢氧化钠溶液的比较,下列说法正确的是( )
A.pH相等的两溶液中:c(Na+)>c(NH4+)
B.物质量浓度相同的两溶液,分别与HCl气体反应至中性时(忽略溶液体积变化) c(Na+)<c(NH4+)
C.物质的量浓度相同的两溶液,进行导电性实验,灯泡的亮度相同
D.分别中和同pH同体积的两溶液,需HCl的物质的量:氨水>NaOH
22.关于下列图象说法正确的是( )
A.①表示化学反应2NO2(g) + O3(g) = N2O5(g) + O2(g) ΔH > 0
B.②表示25℃时,用0.1 mol/L CH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
C.③表示10 mL 0.01 mol/L酸性KMnO4溶液与过量的0.1 mol/L H2C2O4溶液混合时, n(Mn2+)随时间的变化
D.④可表示向稀硫酸溶液中滴加氢氧化钡溶液,溶液导电性随氢氧化钡物质的量的变化
23.室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B.b点时c(NH)+c(NH3·H2O)=c(Cl-)
C.c点时消耗的盐酸体积:V(HCl)<20.00 mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
24.今有室温下四种溶液,有关叙述不正确的是( )
①
②
③
④
浓度c/mol·L-1
0.1
0.1
0.1
0.1
溶液
氨水
CH3COONa溶液
醋酸
盐酸
A.向盛有20mL①溶液中逐渐加入③溶液,溶液导电能力变化如图1
B.②、③两溶液等体积混合,离子浓度关系:
2c(Na+)=c(CH3COO-)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:
c(Cl-)>c(NH)>c(H+)>c(OH-)
D.用④溶液滴定①溶液,滴定曲线如图2所示,可用酚酞作指示剂
第Ⅱ卷(非选择题 共52分)
25.(13分)(Ⅰ)研究大气中含硫化合物(主要是 SO2 和 H2S)的转化具有重要意义。
(1) 工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离H2,发生的反应为:
2H2S(g) 2H2(g)+S2(g) ΔH 已知:①H2S(g) H2(g)+S(g) ΔH1; ②2S(g) S2(g) ΔH2。
则 ΔH=________________(用含 ΔH1、ΔH2的式子表示)。
(2)土壤中的微生物可将大气中 H2S 经两步反应氧化成 SO42-,两步反应的能量变化示意图如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(Ⅱ)100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g) 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
(3)在0~60s内,以N2O4表示的平均反应速率为 mol·L-1·s-1。
(4)根据图中有关数据,计算100℃时该反应的平衡常数K1= 。若其他条件不变,升高温度至120℃,达到新平衡时的平衡常数是K2,则K1 K2(填“>”、“<”或“=”)。
(Ⅲ)向容积为2L的密闭容器中通入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) H2(g)+CO2(g)。
(5)下列说法能作为判断该反应达到化学平衡状态的依据的是 (填字母序号)。
A.容器内CO、H2O、CO2、H2的浓度之比为1:1:1:1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K= 。(精确到小数点后两位)
26.(10分)中和滴定是高中化学重要的定量实验。请回答下列问题:
(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是 (填选项字母)。
A.滴定终点读数时,俯视滴定管刻度
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.02 mol·L-1的高锰酸钾溶液滴定,发生反应的离子方程式为:
(3)滴定数据如下:
①滴定时,该反应速率开始十分缓慢,一段时间后突然加快,这是因为
(填离子)对该反应具有催化作用,KMnO4溶液应装在 (填
“酸”或“碱”)式滴定管中;滴定终点的现象是 。
②该草酸溶液的物质的量浓度为 。
27.(10分)金属钛性能优越,被称为继铁、铝之后的“第三金属”。钛铁矿(主要成分为FeTiO3,含少量Fe2O3、SiO2等杂质)可用来制备TiO2,同时得到副产品绿矾(FeSO4·7H2O),工艺流程如图所示:
己知:①FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中
(1)酸浸I中Fe2O3与稀硫酸反应的离子方程式: 。
(2)过程II中加入适量铁屑的目的是 。
(3)分离III中步骤②得到绿矾的操作是 。
(4)由滤液IV提取TiO2的过程如下:
①请用化学平衡移动原理解释滤液加热煮沸的目的: 。
②由2Mg+TiCl4→Ti+2MgCl2反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据如表信息,需加热的温度略高于______℃即可。
28.(9分)已知水的电离平衡曲线如图所示,试回答下列问题:
(1)图中ABCDE五点的KW间的大小关系是 .(用ABCDE表示)
(2)若从A点到D点,可采用的措施是 .
a.升温
b.加入少量的盐酸
c.加入少量NaOH固体
(3)点B对应温度条件下,某溶液pH=7,此时,溶液呈 (酸性、碱性、中性),点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2= .
29.(10分)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)
(提示:CH3COONH4溶液为中性)
阳离子
Na+、Ba2+、NH
阴离子
CH3COO-、Cl-、OH-、SO
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是 ,B是 。
(2)25 ℃时,0.1 mol/L B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= (用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
(4)在一定体积0.005 mol/L的C溶液中,加入一定体积的0.00125 mol/L的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 。
2019~2020学年度第一学期期中考试
高二化学试题
2019.11
一、选择题(包括24小题,每小题2分,共计48分。每小题只有一个选项符合题意。)
1
2
3
4
5
6
7
8
9
10
11
12
D
C
A
B
C
B
C
A
C
C
B
D
13
14
15
16
17
18
19
20
21
22
23
24
A
A
B
C
D
B
A
A
D
D
C
D
25.(13分)(Ⅰ)(1)2ΔH1+ ΔH2(2分)
(2)H2S(g)+2O2(g) =SO42-(aq)+2H+(aq) ΔH =-806.39 kJ·mol-1 (2分)
(Ⅱ)(3)1x10-3?(2分) (4)0.36(2分);? <(1分)?
(Ⅲ)(5) B (2分) (6)0.44 (2分)
(10分)(1)CD(2分)
(2)2MnO4-+5H2C2O4+6H+10CO2↑+2Mn2++8H2O (2分)
①Mn2+(1分) ; 酸(1分) ; 当加入最后一滴KMnO4后,锥形瓶中溶液由无色变为红色,且半分钟内不褪色 (2分)
② 0.04mol·L-1
27.(10分)(1)Fe2O3+6H+= 2Fe3++3H2O (2分)
(2)将Fe3+还原为Fe2+(2分)
(3)加热浓缩,冷却结晶,过滤(2分)
(4)①该反应为吸热反应,温度升高平衡正向移动,有利于生成Ti(OH)4(2分)
②1412(2分)
28.(9分)(1). B>C>A=D=E (2分)
(2) b (2分)
(3). 碱性(1分)
(4). 10:1(2分) (5). 14(2分)
29.(10分)(1)CH3COONa NH4Cl
(2)1×10(a-14) mol/L
(3)c(OH-)>c(Ba2+)=c(Cl-)>c(NH)>c(H+)
(4)1∶4(每空2分)
高二化学试题
2019.11
说明:
1.本试卷分第Ⅰ卷和第Ⅱ卷,全卷满分100分,考试时间90分钟。
2.答卷前请将答题纸上有关项目填、涂清楚,将第Ⅰ卷题目的答案用2B铅笔涂在答题纸上,第II卷题目的答案用0.5mm黑色中性笔写在答题纸的相应位置上,写在试卷上的答案无效。
3.可能用到的相对原子质量:
H 1 C 12 N 14 0 16 Na 23 S 32 C1 35.5 Fe 56
第Ⅰ卷(选择题 共48分)
一、选择题(包括24小题,每小题2分,共计48分。每小题只有一个选项符合题意。)
1.下列化学变化中,生成物的总能量高于反应物的总能量的是( )
A.硝酸铵溶于水 B.生石灰溶于水
C.铝热反应 D.灼热的C与C02反应
2.能源与我们的日常生活密切相关,下列有关叙述中错误的是( )
A.我国目前使用的主要能源是化石燃料,属于不可再生能源
B.提高燃料的燃烧效率对于节约能源十分重要
C.氢能是一种理想的绿色能源,现在的科技水平已经能够全面推广使用氢能
D.科学家正在研究开发太阳能、风能、潮汐能等新能源,并取得了一定进展
3.下列反应中熵显著增加的是( )
A.2N205(g) = 4N02(g) +02(g) B.Cu(s)+Cl2(g) = CuCl2(s)
C.C(s) + 02(g) = C02(g) D.2H2(g) + 02(g) = 2H2O(1)
4.下列做法与盐的水解无关的是( )
A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B.配制FeCl2溶液时常常要在溶液中加入少量铁粉
C.厨房中常用碳酸钠溶液洗涤餐具上的油污
D.施肥时,草木灰(有效成分为K2CO3)不能与碳铵混合使用
5.一定条件下,在水溶液中1molCl-,ClOx- (x=1,2,3,4)的能量(kJ)相对大小如下图所示.下列有关说法正确的是( )
A.e是ClO3-
B.a,b,c,d,e中c最稳定
C.b→a+d反应的热化学方程式为
3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=-116kJ?mol-1
D.一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为10:1:2
6.已知T℃时,CaCO3(s) = CaO(s) + C02(g) ΔH=+177. 70 kJ·mol-l,则每生成28gCa0(s)时,吸收的热量为( )
A. 44.43 kJ B. 88.85 kJ
C. 133.28 kJ D. 177.70 kJ
7.有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
⑦增加X ⑧增加Y
A.①③⑤⑦ B.②③⑤⑦
C.②③⑥⑧ D.②④⑥⑧
8.-定温度下,在密闭容器中进行反应:N2(g)+02(g) 2NO(g),下列措施不能改变化学反应速率的是( )
A.恒容,充人氦气 B.恒容,充入氮气
C.恒压,充人氦气 D.加入催化剂
9.已知反应:CO(g)+2H2(g) CH3OH(g) ΔH=-129.O kJ·mol-l。 现将4molCO与8molH2混合,一定条件下发生反应,达到平衡状态时放出387.0 kJ热量,此时CO的转化率为( )
A. 25% B.50%
C.75% D.80%
10.对于可逆反应2A(g)+B(g) 2C(g) ΔH< 0,下列各项对示意图的解释与图像相符的是( )
A.①压强对反应的影响( P2>P1)
B.②温度对反应的影响
C.③平衡体系增加A对反应的影响
D.④催化剂对反应的影响
11.在容积一定的密闭容器中,可逆反应A(g)+B(g) xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
A.p3>p4,y轴表示A的物质的量分数
B.p3>p4,y轴表示混合气体的平均摩尔质量
C.p3<p4,y轴表示平衡常数K
D.若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体
12.某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g) 3Z(g)ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是( )
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1 L,X的浓度为0.45 mol ·L-1
13.已知某温度下,反应N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3 N2+ H2的平衡常数为( )
A. B. C. D.
14.下列说法不正确的是( )
A.水的离子积常数为10-14
B.向纯水中加入少量NaHSO4,c(H+)增大
C.100℃时,pH=7的水溶液呈碱性
D.纯水呈中性是因为c(H+)=c(OH-)
15.将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体,都会引起 ( )
A.溶液中c(CH3COO—)减小 B.溶液的pH增加
C.溶液的导电能力减弱 D.溶液中c(OH—)减小
16.下列关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
17.室温下,某溶液中由水电离出来的H+和OH-浓度的乘积为10-24,则此溶液中可能大量共存的离子组是( )
A.HCO3- 、Al3+ 、Na+ 、SO42- B.I- 、 NO3-、 K+ 、NH4+
C.MnO4- 、Cl- 、Fe3-、 K+ D.SiO32- 、SO32- 、Na+ 、Cl-
18.下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液的pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1 mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥0.1 mol/L HNO2溶液稀释至溶液稀释至100倍,pH约为3.1
A.①④⑥ B.①④⑤⑥ C.①②③④ D.全部
19.常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.1000 mol·L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如下图。下列说法不正确的是( )
A.点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-)
B.点③时:c(Na+)=c(CH3COO-)>c(H+)
C.点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
19题图 20题图
20.25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是( )
A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向体系中加入一定量NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:
c2(H+)=c(H+)·c(HSO3-)+2c(H+)?c(SO32-)+Kw
21.同温下,关于氨水和氢氧化钠溶液的比较,下列说法正确的是( )
A.pH相等的两溶液中:c(Na+)>c(NH4+)
B.物质量浓度相同的两溶液,分别与HCl气体反应至中性时(忽略溶液体积变化) c(Na+)<c(NH4+)
C.物质的量浓度相同的两溶液,进行导电性实验,灯泡的亮度相同
D.分别中和同pH同体积的两溶液,需HCl的物质的量:氨水>NaOH
22.关于下列图象说法正确的是( )
A.①表示化学反应2NO2(g) + O3(g) = N2O5(g) + O2(g) ΔH > 0
B.②表示25℃时,用0.1 mol/L CH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
C.③表示10 mL 0.01 mol/L酸性KMnO4溶液与过量的0.1 mol/L H2C2O4溶液混合时, n(Mn2+)随时间的变化
D.④可表示向稀硫酸溶液中滴加氢氧化钡溶液,溶液导电性随氢氧化钡物质的量的变化
23.室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B.b点时c(NH)+c(NH3·H2O)=c(Cl-)
C.c点时消耗的盐酸体积:V(HCl)<20.00 mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
24.今有室温下四种溶液,有关叙述不正确的是( )
①
②
③
④
浓度c/mol·L-1
0.1
0.1
0.1
0.1
溶液
氨水
CH3COONa溶液
醋酸
盐酸
A.向盛有20mL①溶液中逐渐加入③溶液,溶液导电能力变化如图1
B.②、③两溶液等体积混合,离子浓度关系:
2c(Na+)=c(CH3COO-)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:
c(Cl-)>c(NH)>c(H+)>c(OH-)
D.用④溶液滴定①溶液,滴定曲线如图2所示,可用酚酞作指示剂
第Ⅱ卷(非选择题 共52分)
25.(13分)(Ⅰ)研究大气中含硫化合物(主要是 SO2 和 H2S)的转化具有重要意义。
(1) 工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离H2,发生的反应为:
2H2S(g) 2H2(g)+S2(g) ΔH 已知:①H2S(g) H2(g)+S(g) ΔH1; ②2S(g) S2(g) ΔH2。
则 ΔH=________________(用含 ΔH1、ΔH2的式子表示)。
(2)土壤中的微生物可将大气中 H2S 经两步反应氧化成 SO42-,两步反应的能量变化示意图如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(Ⅱ)100℃时,在1L恒温恒容的密闭容器中,通入0.1mol N2O4,发生反应:N2O4(g) 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
(3)在0~60s内,以N2O4表示的平均反应速率为 mol·L-1·s-1。
(4)根据图中有关数据,计算100℃时该反应的平衡常数K1= 。若其他条件不变,升高温度至120℃,达到新平衡时的平衡常数是K2,则K1 K2(填“>”、“<”或“=”)。
(Ⅲ)向容积为2L的密闭容器中通入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) H2(g)+CO2(g)。
(5)下列说法能作为判断该反应达到化学平衡状态的依据的是 (填字母序号)。
A.容器内CO、H2O、CO2、H2的浓度之比为1:1:1:1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K= 。(精确到小数点后两位)
26.(10分)中和滴定是高中化学重要的定量实验。请回答下列问题:
(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是 (填选项字母)。
A.滴定终点读数时,俯视滴定管刻度
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.02 mol·L-1的高锰酸钾溶液滴定,发生反应的离子方程式为:
(3)滴定数据如下:
①滴定时,该反应速率开始十分缓慢,一段时间后突然加快,这是因为
(填离子)对该反应具有催化作用,KMnO4溶液应装在 (填
“酸”或“碱”)式滴定管中;滴定终点的现象是 。
②该草酸溶液的物质的量浓度为 。
27.(10分)金属钛性能优越,被称为继铁、铝之后的“第三金属”。钛铁矿(主要成分为FeTiO3,含少量Fe2O3、SiO2等杂质)可用来制备TiO2,同时得到副产品绿矾(FeSO4·7H2O),工艺流程如图所示:
己知:①FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中
(1)酸浸I中Fe2O3与稀硫酸反应的离子方程式: 。
(2)过程II中加入适量铁屑的目的是 。
(3)分离III中步骤②得到绿矾的操作是 。
(4)由滤液IV提取TiO2的过程如下:
①请用化学平衡移动原理解释滤液加热煮沸的目的: 。
②由2Mg+TiCl4→Ti+2MgCl2反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据如表信息,需加热的温度略高于______℃即可。
28.(9分)已知水的电离平衡曲线如图所示,试回答下列问题:
(1)图中ABCDE五点的KW间的大小关系是 .(用ABCDE表示)
(2)若从A点到D点,可采用的措施是 .
a.升温
b.加入少量的盐酸
c.加入少量NaOH固体
(3)点B对应温度条件下,某溶液pH=7,此时,溶液呈 (酸性、碱性、中性),点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2= .
29.(10分)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)
(提示:CH3COONH4溶液为中性)
阳离子
Na+、Ba2+、NH
阴离子
CH3COO-、Cl-、OH-、SO
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是 ,B是 。
(2)25 ℃时,0.1 mol/L B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= (用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
(4)在一定体积0.005 mol/L的C溶液中,加入一定体积的0.00125 mol/L的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 。
2019~2020学年度第一学期期中考试
高二化学试题
2019.11
一、选择题(包括24小题,每小题2分,共计48分。每小题只有一个选项符合题意。)
1
2
3
4
5
6
7
8
9
10
11
12
D
C
A
B
C
B
C
A
C
C
B
D
13
14
15
16
17
18
19
20
21
22
23
24
A
A
B
C
D
B
A
A
D
D
C
D
25.(13分)(Ⅰ)(1)2ΔH1+ ΔH2(2分)
(2)H2S(g)+2O2(g) =SO42-(aq)+2H+(aq) ΔH =-806.39 kJ·mol-1 (2分)
(Ⅱ)(3)1x10-3?(2分) (4)0.36(2分);? <(1分)?
(Ⅲ)(5) B (2分) (6)0.44 (2分)
(10分)(1)CD(2分)
(2)2MnO4-+5H2C2O4+6H+10CO2↑+2Mn2++8H2O (2分)
①Mn2+(1分) ; 酸(1分) ; 当加入最后一滴KMnO4后,锥形瓶中溶液由无色变为红色,且半分钟内不褪色 (2分)
② 0.04mol·L-1
27.(10分)(1)Fe2O3+6H+= 2Fe3++3H2O (2分)
(2)将Fe3+还原为Fe2+(2分)
(3)加热浓缩,冷却结晶,过滤(2分)
(4)①该反应为吸热反应,温度升高平衡正向移动,有利于生成Ti(OH)4(2分)
②1412(2分)
28.(9分)(1). B>C>A=D=E (2分)
(2) b (2分)
(3). 碱性(1分)
(4). 10:1(2分) (5). 14(2分)
29.(10分)(1)CH3COONa NH4Cl
(2)1×10(a-14) mol/L
(3)c(OH-)>c(Ba2+)=c(Cl-)>c(NH)>c(H+)
(4)1∶4(每空2分)
同课章节目录
