高中化学选修四-1.2-燃烧热-能源(共19张PPT)
文档属性
| 名称 | 高中化学选修四-1.2-燃烧热-能源(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-01 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
第二节 燃烧热 能源
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
1:实验测得25℃、 101kPa时1molC完全燃烧放出393.5 kJ的热量。
2:实验测得25℃、 101kPa时1molH2完全
燃烧放出285.8 kJ的热量。
这就是C的燃烧热
(练习与巩固)依据事实,写出下列反应的热化学方程式∶
这就是H2的燃烧热
燃烧热、中和热、溶解热都属于特殊条件下的反应热
思
考
与
交
流
可燃物与氧化剂发生的剧烈的氧化还原 反应,同时伴有发光和放热的现象。
燃 烧?
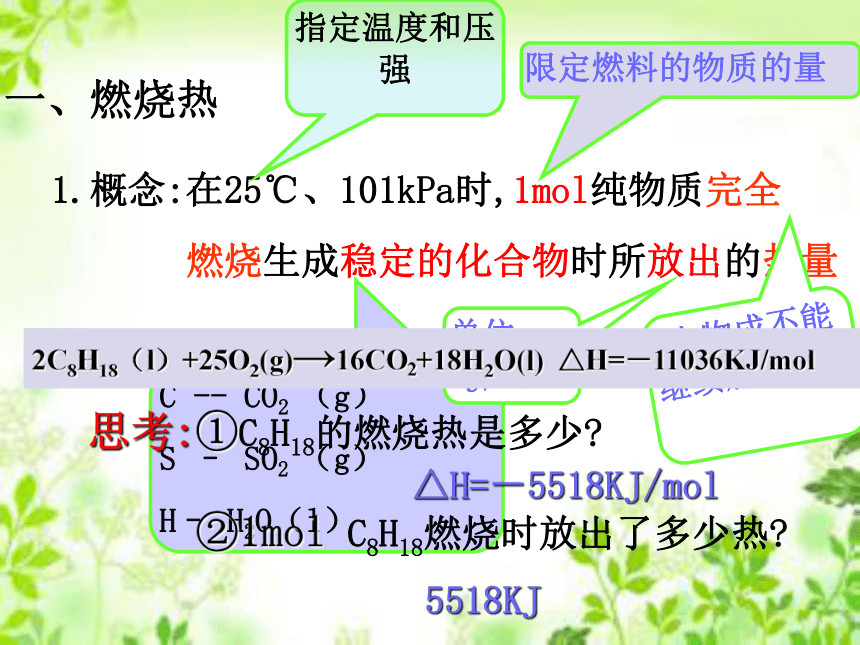
一、燃烧热
1.概念:在25℃、101kPa时,1mol纯物质完全
燃烧生成稳定的化合物时所放出的热量
指定温度和压强
生物成不能继续燃烧
C -- CO2 (g)
S – SO2 (g)
H– H2O(l)
单位: kJ/mol
限定燃料的物质的量
2C8H18(l)+25O2(g)→16CO2+18H2O(l) △H=-11036KJ/mol
思考:①C8H18的燃烧热是多少?
△H=-5518KJ/mol
②1mol C8H18燃烧时放出了多少热?
5518KJ
Ⅰ、在25 0C、101kPa时,完全燃烧生成稳定的
氧化物 如:C→C02,H→H20(l),S→S02
Ⅱ、燃烧热通常由实验测得
Ⅲ、可燃物以1mol为标准进行测量
Ⅳ、系数常用分数表示
注 意
表示酒精燃烧热的正确是( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1370.3 kJ/mol
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H= -1238.3 kJ/mol
A
2.表示的意义:
含义:在250C 101KPa时1molCH4完全燃烧时放出
890.3KJ的热量
3.表示燃烧热的热化学方程式的书写:
以1mol物质的标准来配平其余物质的化学
计量数(常出现分数)
如: CH4的燃烧热为890.3KJ/mol.
【例1】在101kPa时,1mol CH4 完全燃烧生成
CO2和液态H2O,放出 890 kJ的热量,CH4
的燃烧热为多少?44.8 L CH4(标况)
燃烧后所产生的热量为多少?
4.一定量可燃物完全燃烧时放出的热量
Q放 = n(可燃物) × △H
CH4的燃烧热为 890 kJ/mol
2mol×890 kJ/mol=1780kJ
例:C(s)+ O2(g)=CO2(g)△H = - 393.5 kJ/mol 实验测得:在25℃、101kPa时,1mol C(s) 完全燃烧放出 393.5kJ的热量,这就是C的燃烧热。
例:H2(g)+1/2O2(g)=H2O(l) △H=-285.8 kJ/mol
实验测得:在25℃、 101kPa时,1mol H2 (g)完
全燃烧生成液态水时放出285.8 kJ的热量,这就
是H2的燃烧热。
5.燃烧热通常可利用仪器通过实验测得
例:语言表述——CH4的燃烧热为890.3 kJ/mol
符号表示——△H= -890.3 kJ/mol
例:语言表述——H2的燃烧热为285.8 kJ/mol
符号表示——△H= -285.8 kJ/mol
对比下列燃烧热的表达方法,从中你可获得哪些提示?
燃烧热是反应热的一种。由于燃烧是放热反应,故文字表达使用“正值”,但用△H表示时必须注明符号
例2.已知:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
答:ΔH=-285.8 kJ/mol
例3.下列各组物质的燃烧热相等的是:( )
A.碳和一氧化碳 B.1moL碳和2moL碳
C.1moL乙炔和2moL碳 D.淀粉和纤维素
B
一
些
物
质
的
燃
烧
热
⑴由表分析,??????? 是一种比较理想的燃料。
⑵你认为应根据什么标准来选择燃料?
⑶试简述理想燃料应具备哪些优点?
可从物质的燃烧热、燃料的储量、开采、运输、价格、对生态环境的影响等各方面综合考虑。
6、研究燃烧热的意义
甲烷、甲醇
名称 化学式 △H/(kJ·mol-1)
石墨 C(s) -393.5
金刚石 C(s) -395.0
一氧化碳 CO(g) -283.0
甲烷 CH4(g) -890.3
甲醇 CH3OH(l) -726.5
燃烧热与中和热的区别与联系
放热反应
ΔH<0 , 单位 kJ/mol
1mol可燃物
可能是1mol也可以是0.5mol(不限)
不限量
H2O 1mol
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
相
同
点 燃烧热 中和热
能量变化
ΔH
不
同
点 反应物的量
生成物的量
反应热
的含义
2H2(g)+O2g)=2H2O(l) ΔH=-571.6 kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
1、已知:
2、石墨与金刚石的燃烧热是否相同,为什么?
写出石墨和金刚石燃烧的热化学方程式。
ΔH=-285.8 kJ/mol
不相同,因为石墨与金刚石的结构不同, 具有的能量
也不相同
C(石墨s)+ O2(g)= CO2(g) ΔH= -393.5 kl/mol
C(金刚石s)+ O2(g)= CO2(g) ΔH= -395.0 kl/mol
说明金刚石具有的总能量高,不稳定
练习:
一次能源:
二次能源:
直接从自然界取得的能源
一次能源经过加工、
转换得到的能源。
讨 论
1、能源就是能提供 自然资源,包括
等。
2、我国目前使用的主要能源是 ,是不能 。
3、能源是国民经济和社会发展的重要物质基础,它的开 发和利用情况,可以用来衡量一个国家或地区的经济发 展和科学技术水平
3.解决能源的办法是 ,即开发 和节约
,提高能源的 。
4.现在探索开发的新能源有
等,
新能源的主要优势是 。
能量
化石燃料(煤、石油、天然气) 、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
再生
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
三、能源
☆ 阅读P8
☆阅读P9《科学视野》
找出并识记:太阳能、氢能、地热能、风能
各自的优缺点
3、分析以下几个热化学方程式,哪个是表示固态碳和
气态氢气燃烧时的燃烧热的?为什么?
A. C(s)+O2(g)==CO(g) ΔH=-110.5 kJ/mol
B. C(s)+O2(g)==CO2(g) ΔH=-393.5 kJ/mol
C. 2H2(g)+O2(g)==2H2O(l) ΔH=-571.6 kJ/mol
D. H2(g)+O2(g)==H2O(g) ΔH=-241.8 kJ/mol
B
4、我国三峡工程所提供的清洁.廉价强劲.可再生的水电,相当于每年燃烧3×106t原煤的火力发电厂产生的电能。因此,三峡工程有助于控制 ( )
A. 温室效应 B. 酸雨
C. 白色污染 D. 破坏大气臭氧层
A
第二节 燃烧热 能源
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
1:实验测得25℃、 101kPa时1molC完全燃烧放出393.5 kJ的热量。
2:实验测得25℃、 101kPa时1molH2完全
燃烧放出285.8 kJ的热量。
这就是C的燃烧热
(练习与巩固)依据事实,写出下列反应的热化学方程式∶
这就是H2的燃烧热
燃烧热、中和热、溶解热都属于特殊条件下的反应热
思
考
与
交
流
可燃物与氧化剂发生的剧烈的氧化还原 反应,同时伴有发光和放热的现象。
燃 烧?
一、燃烧热
1.概念:在25℃、101kPa时,1mol纯物质完全
燃烧生成稳定的化合物时所放出的热量
指定温度和压强
生物成不能继续燃烧
C -- CO2 (g)
S – SO2 (g)
H– H2O(l)
单位: kJ/mol
限定燃料的物质的量
2C8H18(l)+25O2(g)→16CO2+18H2O(l) △H=-11036KJ/mol
思考:①C8H18的燃烧热是多少?
△H=-5518KJ/mol
②1mol C8H18燃烧时放出了多少热?
5518KJ
Ⅰ、在25 0C、101kPa时,完全燃烧生成稳定的
氧化物 如:C→C02,H→H20(l),S→S02
Ⅱ、燃烧热通常由实验测得
Ⅲ、可燃物以1mol为标准进行测量
Ⅳ、系数常用分数表示
注 意
表示酒精燃烧热的正确是( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1370.3 kJ/mol
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H= -1238.3 kJ/mol
A
2.表示的意义:
含义:在250C 101KPa时1molCH4完全燃烧时放出
890.3KJ的热量
3.表示燃烧热的热化学方程式的书写:
以1mol物质的标准来配平其余物质的化学
计量数(常出现分数)
如: CH4的燃烧热为890.3KJ/mol.
【例1】在101kPa时,1mol CH4 完全燃烧生成
CO2和液态H2O,放出 890 kJ的热量,CH4
的燃烧热为多少?44.8 L CH4(标况)
燃烧后所产生的热量为多少?
4.一定量可燃物完全燃烧时放出的热量
Q放 = n(可燃物) × △H
CH4的燃烧热为 890 kJ/mol
2mol×890 kJ/mol=1780kJ
例:C(s)+ O2(g)=CO2(g)△H = - 393.5 kJ/mol 实验测得:在25℃、101kPa时,1mol C(s) 完全燃烧放出 393.5kJ的热量,这就是C的燃烧热。
例:H2(g)+1/2O2(g)=H2O(l) △H=-285.8 kJ/mol
实验测得:在25℃、 101kPa时,1mol H2 (g)完
全燃烧生成液态水时放出285.8 kJ的热量,这就
是H2的燃烧热。
5.燃烧热通常可利用仪器通过实验测得
例:语言表述——CH4的燃烧热为890.3 kJ/mol
符号表示——△H= -890.3 kJ/mol
例:语言表述——H2的燃烧热为285.8 kJ/mol
符号表示——△H= -285.8 kJ/mol
对比下列燃烧热的表达方法,从中你可获得哪些提示?
燃烧热是反应热的一种。由于燃烧是放热反应,故文字表达使用“正值”,但用△H表示时必须注明符号
例2.已知:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
答:ΔH=-285.8 kJ/mol
例3.下列各组物质的燃烧热相等的是:( )
A.碳和一氧化碳 B.1moL碳和2moL碳
C.1moL乙炔和2moL碳 D.淀粉和纤维素
B
一
些
物
质
的
燃
烧
热
⑴由表分析,??????? 是一种比较理想的燃料。
⑵你认为应根据什么标准来选择燃料?
⑶试简述理想燃料应具备哪些优点?
可从物质的燃烧热、燃料的储量、开采、运输、价格、对生态环境的影响等各方面综合考虑。
6、研究燃烧热的意义
甲烷、甲醇
名称 化学式 △H/(kJ·mol-1)
石墨 C(s) -393.5
金刚石 C(s) -395.0
一氧化碳 CO(g) -283.0
甲烷 CH4(g) -890.3
甲醇 CH3OH(l) -726.5
燃烧热与中和热的区别与联系
放热反应
ΔH<0 , 单位 kJ/mol
1mol可燃物
可能是1mol也可以是0.5mol(不限)
不限量
H2O 1mol
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
相
同
点 燃烧热 中和热
能量变化
ΔH
不
同
点 反应物的量
生成物的量
反应热
的含义
2H2(g)+O2g)=2H2O(l) ΔH=-571.6 kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
1、已知:
2、石墨与金刚石的燃烧热是否相同,为什么?
写出石墨和金刚石燃烧的热化学方程式。
ΔH=-285.8 kJ/mol
不相同,因为石墨与金刚石的结构不同, 具有的能量
也不相同
C(石墨s)+ O2(g)= CO2(g) ΔH= -393.5 kl/mol
C(金刚石s)+ O2(g)= CO2(g) ΔH= -395.0 kl/mol
说明金刚石具有的总能量高,不稳定
练习:
一次能源:
二次能源:
直接从自然界取得的能源
一次能源经过加工、
转换得到的能源。
讨 论
1、能源就是能提供 自然资源,包括
等。
2、我国目前使用的主要能源是 ,是不能 。
3、能源是国民经济和社会发展的重要物质基础,它的开 发和利用情况,可以用来衡量一个国家或地区的经济发 展和科学技术水平
3.解决能源的办法是 ,即开发 和节约
,提高能源的 。
4.现在探索开发的新能源有
等,
新能源的主要优势是 。
能量
化石燃料(煤、石油、天然气) 、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
再生
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
三、能源
☆ 阅读P8
☆阅读P9《科学视野》
找出并识记:太阳能、氢能、地热能、风能
各自的优缺点
3、分析以下几个热化学方程式,哪个是表示固态碳和
气态氢气燃烧时的燃烧热的?为什么?
A. C(s)+O2(g)==CO(g) ΔH=-110.5 kJ/mol
B. C(s)+O2(g)==CO2(g) ΔH=-393.5 kJ/mol
C. 2H2(g)+O2(g)==2H2O(l) ΔH=-571.6 kJ/mol
D. H2(g)+O2(g)==H2O(g) ΔH=-241.8 kJ/mol
B
4、我国三峡工程所提供的清洁.廉价强劲.可再生的水电,相当于每年燃烧3×106t原煤的火力发电厂产生的电能。因此,三峡工程有助于控制 ( )
A. 温室效应 B. 酸雨
C. 白色污染 D. 破坏大气臭氧层
A
