人教版高二化学选修四第一章第二节-燃烧热-能源PPT(共20张PPT)
文档属性
| 名称 | 人教版高二化学选修四第一章第二节-燃烧热-能源PPT(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 414.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-20 12:32:07 | ||
图片预览








文档简介
(共20张PPT)
第一章 化学反应与能量
目标
1、理解燃烧热的概念,
2、认识能源是人类生存和发展的重要基础,
3、了解化学在解决能源危机中的重要作用。
4、重、难点:燃烧热的概念
目标
1、理解燃烧热的概念,
2、认识能源是人类生存和发展的重要基础,
3、了解化学在解决能源危机中的重要作用。
4、重、难点:燃烧热的概念
目标
1、理解燃烧热的概念,
2、认识能源是人类生存和发展的重要基础,
3、了解化学在解决能源危机中的重要作用。
4、重、难点:燃烧热的概念
一、燃烧热
1.燃烧热的的概念:
101kPa时,1mol纯物质完全燃烧生成稳定化合物时所放出的热量。
为什么指定压强?
生成物不能继续燃烧
一般指:
C -- CO2 (g)
N– N2 (g)
S – SO2 (g)
H– H2O(l)
单位: kJ/mol
限定燃料的物质的量
注意:
2C8H18(l)+25O2(g)=16CO2+18H2O(l);△H=-11036KJ/mol
思考:C8H18的燃烧热为多少?
△H=-5518KJ/mol
2.表示的意义:
如: CH4的燃烧热为890.3KJ/mol.
含义: 在101KPa时, 1molCH4完全燃烧时,放出 890.3KJ的热量.
3.表示燃烧热的热化学方程式的书写:
应以1mol物质的标准来配平其余物质的化学计量数(常出现分数)
4.一定量可燃物完全燃烧时放出的热量
Q放=n(可燃物)ⅹ ︱ △H ︱
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H=-890.31KJ/mol
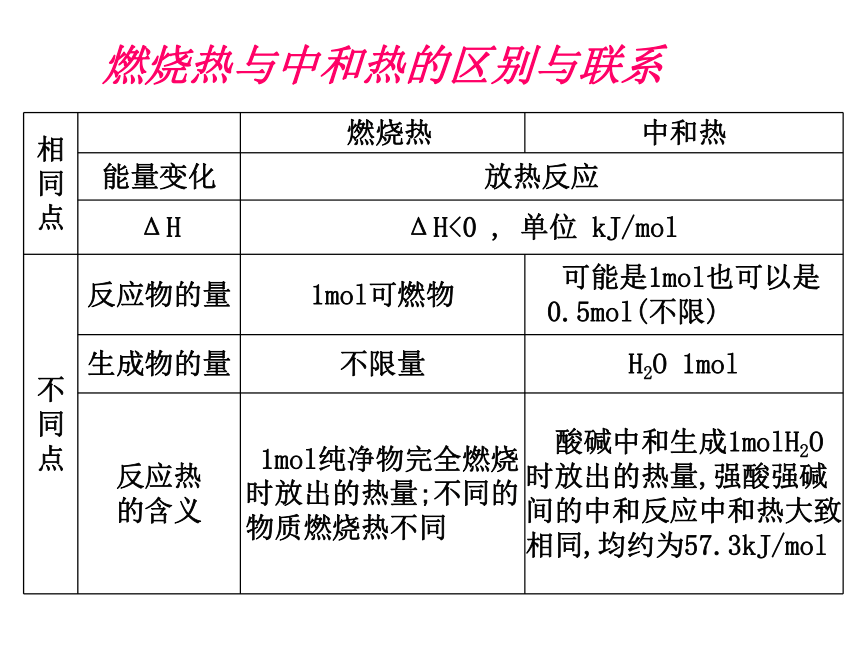
燃烧热与中和热的区别与联系
相
同
点 燃烧热 中和热
能量变化 放热反应
ΔH ΔH<0 , 单位 kJ/mol
不
同
点 反应物的量 1mol可燃物 可能是1mol也可以是0.5mol(不限)
生成物的量 不限量 H2O 1mol
反应热
的含义 1mol纯净物完全燃烧时放出的热量;不同的物质燃烧热不同 酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
选择燃料的标准是什么?
燃烧热、燃料的储量、开采运输储存的条件、价格、对生态环境的影响,等各方面综合考虑。
煤作为燃料的利弊?提高煤燃烧效率的措施有哪些?
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
思考与交流-课本第7页
2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH=-571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
1、已知:
2、石墨与金刚石的燃烧热是否相同,为什么?
请分别写出石墨和金刚石燃烧的热化学方程式。
答:ΔH=-285.8 kJ/mol
不相同,因为石墨与金刚石的晶体结构不同,共具有的能量也不相同
C(石墨s)+ O2(g)= CO2(g) ΔH= -393.5 kl/mol
C(金刚石s)+ O2(g)= CO2(g) ΔH= -395.0 kl/mol
说明金刚石具有的总能量高,不稳定
练 习
3.下列各组物质的燃烧热相等的是:( )
A.碳和一氧化碳 B.1moL碳和2moL碳
C.1moL乙炔和2moL碳 D.淀粉和纤维素
B
285.8 kJ/mol
[练习]
二、能源
1.能源就是能提供 的自然资源,
包括 等。
2.我国目前使用的主要能源是 ,是不能 。
3.解决能源的办法是 ,即开发 和节约 ,提高能源的 。
4.现在探索开发的新能源有 等,
5.新能源的主要优势是 。
能量
化石燃料(煤、石油、天然气) 、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
再生
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
课本知识梳理
能源问题
讨论下列问题:
1、能源、一级能源、二级能源
问:属于一级能源的是:
属于二级能源的是:
A 风能 B电能 C 氢能 D 阳光 E 天然气
A D E
B C
能 源:能提供能量的自然资源
一级能源:来自自然界未经转化的能源。
二级能源:一级能源经过转化得到的能源形式。
2、我国的能源状况如何?
(1)目前使用的主要
能源是何种能源?
(2)我国的能源储量。
(3)我国的人均能源拥有量。
(4)近年来我国能源的总消费量与人均消费量情况。
能源问题
[议一议]1.城市家用燃料使用气体燃料比使用煤、煤球等固体燃料有什么好处?
答案:首先,因气体易扩散,故气体燃料与空气混合充分,容易发生完全燃烧,与固体燃料相比有较高的能量利用率。
其次,气体燃料便于管道运输、使用方便(易点燃、易熄灭)、无渣无尘、清洁卫生。
第三,固体煤中含有硫、氮等杂质,直接燃煤,会产生大量二氧化硫、氮氧化物(NOx)、粉尘,造成大气污染,住宅环境、居室空气的污染则更严重。
1.下列燃料中,不属于化石燃料的是( )
A.煤 B.石油
C.天然气 D.水煤气
2.酸雨危害可包括( )
①对人体的直接危害,引起肺部疾病而使人致死,②引起河流,湖泊的水体酸化,严重影响水生动植物的生长,③破坏土壤,植被,森林 ④腐蚀金属,油漆,皮革,纺织品及建筑材料等,⑤渗入地下,可能引起地下水酸化.
A.①③⑤ B.①②③④
C.①③④⑤ D.①②③④⑤
D
D
课堂巩练习
3.我国发射的“神舟五号”载人飞船的燃料是铝粉与高氯酸铵的混合物。点燃时,铝粉氧化放热引发高氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+O2↑;△H<0。关于该反应叙述不正确的是 ( )
A.该反应属于分解反应、氧化还原反应、放热反应
B.该反应瞬间能产生大量高温气体,推动飞船飞行
C.从能量变化上看,该反应是化学能转变为热能和动能
D.反应中NH4ClO4只起到氧化剂的作用
D
4.通常状况下,将1g 氢气在氯气中完全燃烧,放出92.4KJ热量,下列所示的热化学方程式正确的是 ( )
A.H2(g)+Cl2(g)=1/2HCl(g);
ΔH=92.4KJ/mol
B.H2(g)+Cl2(g)=1/2HCl(g);
ΔH=-92.4KJ/mol
C.H2(g)+Cl2(g)=2HCl(g);
ΔH=-184.8KJ/mol
D.H2(g)+Cl2(g)=2HCl(l);ΔH=184.8/mol
C
5.下列关于燃烧热的说法中正确的是 ( )
A.1mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25℃、1.01×105Pa时,1mol物质燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学方程式前的化学计量数的改变而改变
C
6.在25℃、1.01×105Pa时,1gCH4燃烧时生成CO2与液态H2O,放出55.6KJ的热量,则CH4的燃烧热为 ( )
A.55.6KJ/mol B.889.6KJ/mol
C.-889.6KJ/mol D.444.8KJ
7.关化石燃料的说法正确的是 ( )
A.化石燃料是可再生的,因此在地球上的蕴藏量也是无限的
B.化石燃料虽然在地球上的蕴藏量有限,但形成化石燃料的速率相当快,所以化石燃料相当于无限的
C.化石燃料的形成是非常复杂的,所需时间很长,但化石燃料在地球上的蕴藏量是无限的
D.化石燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生资源
B
D
8.下列说法不正确的是 ( )
A. 化石燃料在任何条件下都能充分燃烧
B. 化石燃料在燃烧过程中能产生污染环境的CO.SO2等有害气体
C. 直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D. 固体煤变为气体燃料后,燃烧效率将提高
9.为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为 ( )
A.碳氢化合物 B.碳水化合物
C.氢气 D.醇类
A
A
10.实验测得25℃、101kPa时1molC完全燃烧放出393.5 kJ的热量,写出C燃烧的热化学方程式:
11.实验测得25℃、101kPa时1molH2完全燃烧放出285.8 kJ的热量,写出H2燃烧的热化学方程式:
.C(s)+O2(g) = CO2(g) ΔH=-393.5 kJ/mol
H2(g)+1/2O2(g) = H2O(l) ΔH=-285.8 kJ/mol
第一章 化学反应与能量
目标
1、理解燃烧热的概念,
2、认识能源是人类生存和发展的重要基础,
3、了解化学在解决能源危机中的重要作用。
4、重、难点:燃烧热的概念
目标
1、理解燃烧热的概念,
2、认识能源是人类生存和发展的重要基础,
3、了解化学在解决能源危机中的重要作用。
4、重、难点:燃烧热的概念
目标
1、理解燃烧热的概念,
2、认识能源是人类生存和发展的重要基础,
3、了解化学在解决能源危机中的重要作用。
4、重、难点:燃烧热的概念
一、燃烧热
1.燃烧热的的概念:
101kPa时,1mol纯物质完全燃烧生成稳定化合物时所放出的热量。
为什么指定压强?
生成物不能继续燃烧
一般指:
C -- CO2 (g)
N– N2 (g)
S – SO2 (g)
H– H2O(l)
单位: kJ/mol
限定燃料的物质的量
注意:
2C8H18(l)+25O2(g)=16CO2+18H2O(l);△H=-11036KJ/mol
思考:C8H18的燃烧热为多少?
△H=-5518KJ/mol
2.表示的意义:
如: CH4的燃烧热为890.3KJ/mol.
含义: 在101KPa时, 1molCH4完全燃烧时,放出 890.3KJ的热量.
3.表示燃烧热的热化学方程式的书写:
应以1mol物质的标准来配平其余物质的化学计量数(常出现分数)
4.一定量可燃物完全燃烧时放出的热量
Q放=n(可燃物)ⅹ ︱ △H ︱
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H=-890.31KJ/mol
燃烧热与中和热的区别与联系
相
同
点 燃烧热 中和热
能量变化 放热反应
ΔH ΔH<0 , 单位 kJ/mol
不
同
点 反应物的量 1mol可燃物 可能是1mol也可以是0.5mol(不限)
生成物的量 不限量 H2O 1mol
反应热
的含义 1mol纯净物完全燃烧时放出的热量;不同的物质燃烧热不同 酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
选择燃料的标准是什么?
燃烧热、燃料的储量、开采运输储存的条件、价格、对生态环境的影响,等各方面综合考虑。
煤作为燃料的利弊?提高煤燃烧效率的措施有哪些?
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
思考与交流-课本第7页
2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH=-571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
1、已知:
2、石墨与金刚石的燃烧热是否相同,为什么?
请分别写出石墨和金刚石燃烧的热化学方程式。
答:ΔH=-285.8 kJ/mol
不相同,因为石墨与金刚石的晶体结构不同,共具有的能量也不相同
C(石墨s)+ O2(g)= CO2(g) ΔH= -393.5 kl/mol
C(金刚石s)+ O2(g)= CO2(g) ΔH= -395.0 kl/mol
说明金刚石具有的总能量高,不稳定
练 习
3.下列各组物质的燃烧热相等的是:( )
A.碳和一氧化碳 B.1moL碳和2moL碳
C.1moL乙炔和2moL碳 D.淀粉和纤维素
B
285.8 kJ/mol
[练习]
二、能源
1.能源就是能提供 的自然资源,
包括 等。
2.我国目前使用的主要能源是 ,是不能 。
3.解决能源的办法是 ,即开发 和节约 ,提高能源的 。
4.现在探索开发的新能源有 等,
5.新能源的主要优势是 。
能量
化石燃料(煤、石油、天然气) 、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
再生
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
课本知识梳理
能源问题
讨论下列问题:
1、能源、一级能源、二级能源
问:属于一级能源的是:
属于二级能源的是:
A 风能 B电能 C 氢能 D 阳光 E 天然气
A D E
B C
能 源:能提供能量的自然资源
一级能源:来自自然界未经转化的能源。
二级能源:一级能源经过转化得到的能源形式。
2、我国的能源状况如何?
(1)目前使用的主要
能源是何种能源?
(2)我国的能源储量。
(3)我国的人均能源拥有量。
(4)近年来我国能源的总消费量与人均消费量情况。
能源问题
[议一议]1.城市家用燃料使用气体燃料比使用煤、煤球等固体燃料有什么好处?
答案:首先,因气体易扩散,故气体燃料与空气混合充分,容易发生完全燃烧,与固体燃料相比有较高的能量利用率。
其次,气体燃料便于管道运输、使用方便(易点燃、易熄灭)、无渣无尘、清洁卫生。
第三,固体煤中含有硫、氮等杂质,直接燃煤,会产生大量二氧化硫、氮氧化物(NOx)、粉尘,造成大气污染,住宅环境、居室空气的污染则更严重。
1.下列燃料中,不属于化石燃料的是( )
A.煤 B.石油
C.天然气 D.水煤气
2.酸雨危害可包括( )
①对人体的直接危害,引起肺部疾病而使人致死,②引起河流,湖泊的水体酸化,严重影响水生动植物的生长,③破坏土壤,植被,森林 ④腐蚀金属,油漆,皮革,纺织品及建筑材料等,⑤渗入地下,可能引起地下水酸化.
A.①③⑤ B.①②③④
C.①③④⑤ D.①②③④⑤
D
D
课堂巩练习
3.我国发射的“神舟五号”载人飞船的燃料是铝粉与高氯酸铵的混合物。点燃时,铝粉氧化放热引发高氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+O2↑;△H<0。关于该反应叙述不正确的是 ( )
A.该反应属于分解反应、氧化还原反应、放热反应
B.该反应瞬间能产生大量高温气体,推动飞船飞行
C.从能量变化上看,该反应是化学能转变为热能和动能
D.反应中NH4ClO4只起到氧化剂的作用
D
4.通常状况下,将1g 氢气在氯气中完全燃烧,放出92.4KJ热量,下列所示的热化学方程式正确的是 ( )
A.H2(g)+Cl2(g)=1/2HCl(g);
ΔH=92.4KJ/mol
B.H2(g)+Cl2(g)=1/2HCl(g);
ΔH=-92.4KJ/mol
C.H2(g)+Cl2(g)=2HCl(g);
ΔH=-184.8KJ/mol
D.H2(g)+Cl2(g)=2HCl(l);ΔH=184.8/mol
C
5.下列关于燃烧热的说法中正确的是 ( )
A.1mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25℃、1.01×105Pa时,1mol物质燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学方程式前的化学计量数的改变而改变
C
6.在25℃、1.01×105Pa时,1gCH4燃烧时生成CO2与液态H2O,放出55.6KJ的热量,则CH4的燃烧热为 ( )
A.55.6KJ/mol B.889.6KJ/mol
C.-889.6KJ/mol D.444.8KJ
7.关化石燃料的说法正确的是 ( )
A.化石燃料是可再生的,因此在地球上的蕴藏量也是无限的
B.化石燃料虽然在地球上的蕴藏量有限,但形成化石燃料的速率相当快,所以化石燃料相当于无限的
C.化石燃料的形成是非常复杂的,所需时间很长,但化石燃料在地球上的蕴藏量是无限的
D.化石燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生资源
B
D
8.下列说法不正确的是 ( )
A. 化石燃料在任何条件下都能充分燃烧
B. 化石燃料在燃烧过程中能产生污染环境的CO.SO2等有害气体
C. 直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D. 固体煤变为气体燃料后,燃烧效率将提高
9.为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为 ( )
A.碳氢化合物 B.碳水化合物
C.氢气 D.醇类
A
A
10.实验测得25℃、101kPa时1molC完全燃烧放出393.5 kJ的热量,写出C燃烧的热化学方程式:
11.实验测得25℃、101kPa时1molH2完全燃烧放出285.8 kJ的热量,写出H2燃烧的热化学方程式:
.C(s)+O2(g) = CO2(g) ΔH=-393.5 kJ/mol
H2(g)+1/2O2(g) = H2O(l) ΔH=-285.8 kJ/mol
