第一单元 脂肪烃 乙炔
图片预览







文档简介
(共23张PPT)
组织建设
化学 · 选修5《有机化学基础》
第三节 乙炔
学习目标定位
1.知道炔烃的结构特点及炔烃的物理性质
2.掌握乙炔的化学性质,能够书写乙炔与卤素单质、卤化氢、氢气、水等反应的化学方程式
一、乙炔
1. 乙炔的分子结构
H—C≡C—H
CH≡CH 或 HC≡CH
直线型,键角1800
分子式:
电子式:
结构式:
结构简式:
空间结构:
C2H2
含有碳碳叁键结构的相邻四原子在同一直线上
乙烷
乙烯
乙炔
当堂训练
描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是( )(双选)
A.6个碳原子有可能在同一直线上
B.6个碳原子有可能在同一平面上
C.6个碳原子不可能在同一直线上
D.6个碳原子不可能在同一平面上
B C
H
H
C=C
H3C
C C—CF3
碳碳叁键属于不饱和键,且一强两弱,易断裂,化学性质较活泼。
乙烷 乙烯 乙炔
348 KJ/mol
615 KJ/mol
812 KJ/mol
【结论】
碳碳键键能资料卡片
C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和。说明叁键中有二个键不稳定,容易断裂,有一个键较稳定。
【分析】
2.乙炔的物理性质
乙炔是无色、无味、密度比空气稍小、微溶于水、易溶于有机溶剂的气体。
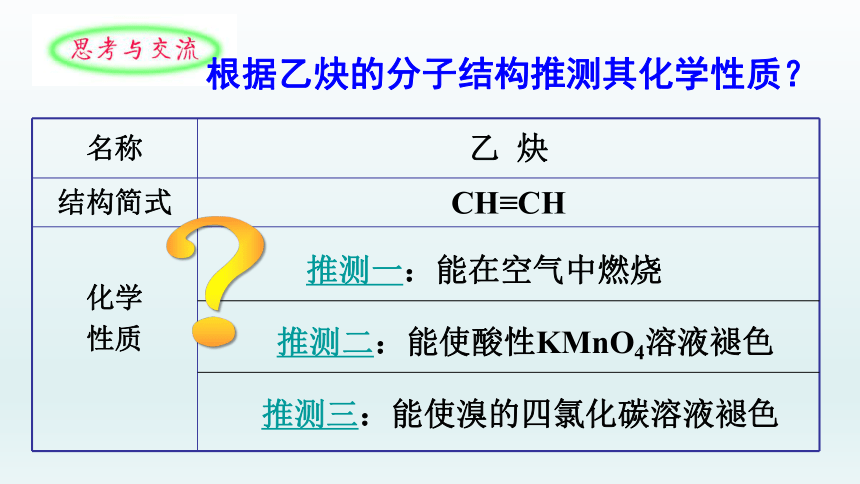
名称 乙 炔
结构简式 CH≡CH
化学
性质
推测一:能在空气中燃烧
?
推测二:能使酸性KMnO4溶液褪色
推测三:能使溴的四氯化碳溶液褪色
根据乙炔的分子结构推测其化学性质?
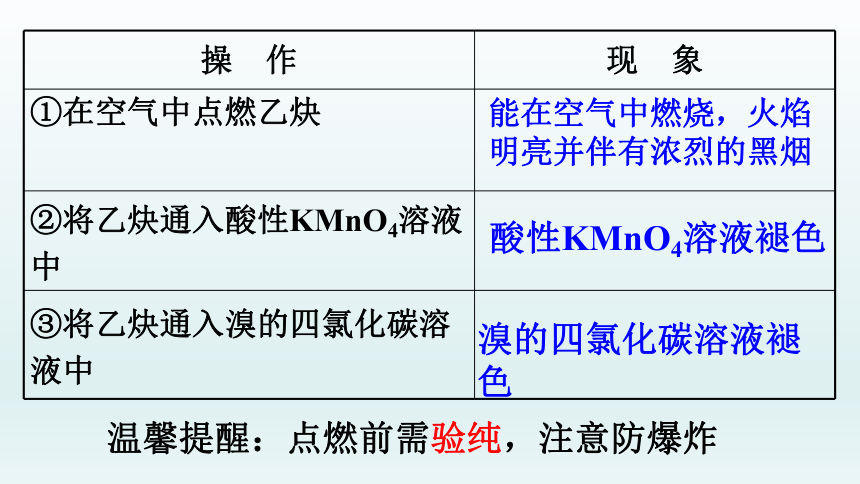
操 作 现 象
①在空气中点燃乙炔
②将乙炔通入酸性KMnO4溶液中
③将乙炔通入溴的四氯化碳溶液中
酸性KMnO4溶液褪色
溴的四氯化碳溶液褪色
能在空气中燃烧,火焰明亮并伴有浓烈的黑烟
温馨提醒:点燃前需验纯,注意防爆炸
a.可燃性:
淡蓝
色火焰
燃烧火焰
明亮,黑烟
燃烧火焰
明亮,浓烟
含碳量逐渐增大
甲烷
乙烯
乙炔
2C2H2+ 5O2 点燃 4CO2 + 2H2O
⑴氧化反应
3.化学性质
b.可被酸性KMnO4氧化,使其褪色
思考:
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
如何检验乙炔被酸性KMnO4溶液氧化后得到的产物是什么?
乙炔能使溴的四氯化碳溶液褪色,与Br2是发生加成反应,还是取代反应?如何设计实验验证?
CH CH
CH≡CH + Br2
加成
取代
CH≡CBr + HBr
Br
Br
?
?
①乙炔与溴单质加成
H-C C-H + Br2
H-C C-H
Br
Br
1,2 -二溴乙烯
1,1,2,2-四溴乙烷
H- C C-H
Br
Br
Br
Br
H-C C-H
Br
Br
+ Br2
CH CH + 2 Br2
CHBr2 CHBr2
CH≡CH + Br2
CHBr = CHBr
⑵加成反应
一定条件下,乙炔能与卤素单质、 H2、 HX、H2O等发生加成反应。
②与H2加成
足量H2:
CH≡CH +2H2 → CH3-CH3
催化剂
③一定条件下与HX加成
(聚氯乙烯)
聚氯乙烯制品
聚氯乙烯薄膜
④一定条件下与H2O加成
△
CH≡CH+H2O CH3CHO
(乙醛)
⑶加聚反应
因研究出世界上第一种导电塑料:掺杂I2的聚乙炔
而获2000年诺贝尔化学奖
美国物理学
家Heeger
美国化学家MacDiarmid
日本化学家Shirakawa
nCH ≡ CH [ CH=CH ]n
催化剂
聚乙炔
(制导电高分子材料)
⑴乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
⑵乙炔燃烧时产生的氧炔焰可用来切割或焊接金属。
3.乙炔的用途
乙炔
氧化反应
加成反应
加聚反应
可燃性
使酸性KMnO4褪色
与X2
与H2
与HX
与H2O
HCN
1. 某气态烃0.5mol能与1mol HCl完全加成,加成产物分子上的氢原子又可被3mol Cl2取代,则气态烃可能是( )
A. CH2 =CH—CH=CH2 B. CH2=CH2
C. CH≡C—CH3 D. CH2=C(CH3)2
C
对点训练
2.在标准状况下将11.2L乙烯和乙炔的混合气通入到溴水中充分反应,测得有128g溴单质参加了反应,则乙烯、乙炔的物质的量之比为( )
A.1∶2 B.2∶3 C.3∶4 D.4∶5
B
3. 1mol 和足量氢气 发生加成,需要消耗H2 mol
CH C CH CH2
3
4. 1mol 最多能和 mol Br2加成
4
5.含一不饱和键的烃,氢化后的产物结构简式为
此烃可能有的结构有( )
A.5种 B.6种 C.7种 D.9种
D
CH3 —CH2—CH—CH2—CH—CH2—CH3
CH2—CH3
CH3
组织建设
化学 · 选修5《有机化学基础》
第三节 乙炔
学习目标定位
1.知道炔烃的结构特点及炔烃的物理性质
2.掌握乙炔的化学性质,能够书写乙炔与卤素单质、卤化氢、氢气、水等反应的化学方程式
一、乙炔
1. 乙炔的分子结构
H—C≡C—H
CH≡CH 或 HC≡CH
直线型,键角1800
分子式:
电子式:
结构式:
结构简式:
空间结构:
C2H2
含有碳碳叁键结构的相邻四原子在同一直线上
乙烷
乙烯
乙炔
当堂训练
描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是( )(双选)
A.6个碳原子有可能在同一直线上
B.6个碳原子有可能在同一平面上
C.6个碳原子不可能在同一直线上
D.6个碳原子不可能在同一平面上
B C
H
H
C=C
H3C
C C—CF3
碳碳叁键属于不饱和键,且一强两弱,易断裂,化学性质较活泼。
乙烷 乙烯 乙炔
348 KJ/mol
615 KJ/mol
812 KJ/mol
【结论】
碳碳键键能资料卡片
C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和。说明叁键中有二个键不稳定,容易断裂,有一个键较稳定。
【分析】
2.乙炔的物理性质
乙炔是无色、无味、密度比空气稍小、微溶于水、易溶于有机溶剂的气体。
名称 乙 炔
结构简式 CH≡CH
化学
性质
推测一:能在空气中燃烧
?
推测二:能使酸性KMnO4溶液褪色
推测三:能使溴的四氯化碳溶液褪色
根据乙炔的分子结构推测其化学性质?
操 作 现 象
①在空气中点燃乙炔
②将乙炔通入酸性KMnO4溶液中
③将乙炔通入溴的四氯化碳溶液中
酸性KMnO4溶液褪色
溴的四氯化碳溶液褪色
能在空气中燃烧,火焰明亮并伴有浓烈的黑烟
温馨提醒:点燃前需验纯,注意防爆炸
a.可燃性:
淡蓝
色火焰
燃烧火焰
明亮,黑烟
燃烧火焰
明亮,浓烟
含碳量逐渐增大
甲烷
乙烯
乙炔
2C2H2+ 5O2 点燃 4CO2 + 2H2O
⑴氧化反应
3.化学性质
b.可被酸性KMnO4氧化,使其褪色
思考:
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
如何检验乙炔被酸性KMnO4溶液氧化后得到的产物是什么?
乙炔能使溴的四氯化碳溶液褪色,与Br2是发生加成反应,还是取代反应?如何设计实验验证?
CH CH
CH≡CH + Br2
加成
取代
CH≡CBr + HBr
Br
Br
?
?
①乙炔与溴单质加成
H-C C-H + Br2
H-C C-H
Br
Br
1,2 -二溴乙烯
1,1,2,2-四溴乙烷
H- C C-H
Br
Br
Br
Br
H-C C-H
Br
Br
+ Br2
CH CH + 2 Br2
CHBr2 CHBr2
CH≡CH + Br2
CHBr = CHBr
⑵加成反应
一定条件下,乙炔能与卤素单质、 H2、 HX、H2O等发生加成反应。
②与H2加成
足量H2:
CH≡CH +2H2 → CH3-CH3
催化剂
③一定条件下与HX加成
(聚氯乙烯)
聚氯乙烯制品
聚氯乙烯薄膜
④一定条件下与H2O加成
△
CH≡CH+H2O CH3CHO
(乙醛)
⑶加聚反应
因研究出世界上第一种导电塑料:掺杂I2的聚乙炔
而获2000年诺贝尔化学奖
美国物理学
家Heeger
美国化学家MacDiarmid
日本化学家Shirakawa
nCH ≡ CH [ CH=CH ]n
催化剂
聚乙炔
(制导电高分子材料)
⑴乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
⑵乙炔燃烧时产生的氧炔焰可用来切割或焊接金属。
3.乙炔的用途
乙炔
氧化反应
加成反应
加聚反应
可燃性
使酸性KMnO4褪色
与X2
与H2
与HX
与H2O
HCN
1. 某气态烃0.5mol能与1mol HCl完全加成,加成产物分子上的氢原子又可被3mol Cl2取代,则气态烃可能是( )
A. CH2 =CH—CH=CH2 B. CH2=CH2
C. CH≡C—CH3 D. CH2=C(CH3)2
C
对点训练
2.在标准状况下将11.2L乙烯和乙炔的混合气通入到溴水中充分反应,测得有128g溴单质参加了反应,则乙烯、乙炔的物质的量之比为( )
A.1∶2 B.2∶3 C.3∶4 D.4∶5
B
3. 1mol 和足量氢气 发生加成,需要消耗H2 mol
CH C CH CH2
3
4. 1mol 最多能和 mol Br2加成
4
5.含一不饱和键的烃,氢化后的产物结构简式为
此烃可能有的结构有( )
A.5种 B.6种 C.7种 D.9种
D
CH3 —CH2—CH—CH2—CH—CH2—CH3
CH2—CH3
CH3
