人教版高中物理选修3-3 学案 第八章 气体 第1节 第4节 Word版含解析
文档属性
| 名称 | 人教版高中物理选修3-3 学案 第八章 气体 第1节 第4节 Word版含解析 |

|
|
| 格式 | zip | ||
| 文件大小 | 469.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 物理 | ||
| 更新时间 | 2020-01-02 09:56:41 | ||
图片预览



文档简介
第1节 气体的等温变化
1.知道什么是等温变化。
2.知道玻意耳定律是实验定律,掌握玻意耳定律的内容、表达式及适用条件。
3.理解气体等温变化的p-V图象、p-图象的物理意义。
一、气体的状态参量及封闭气体压强的计算
1.气体的状态参量:描述气体的状态参量一般有压强、体积、温度。
2.实验探究
二、玻意耳定律
1.内容:一定质量的某种气体,在温度不变的情况下,压强p与体积V成反比。
2.公式:pV=恒量(C)或p1V1=p2V2。
3.条件:气体的质量一定,温度不变。
三、两种等温变化图象
1.气体等温变化的p-V图象
一定质量的气体发生等温变化时的p-V图象如图甲所示。图线的形状为双曲线。
由于它描述的是温度不变时的p-V关系,因此称它为等温线。一定质量的气体,不同温度下的等温线是不同的。
2.p-图象:一定质量的理想气体的p-图象为过原点的倾斜直线,如图乙所示。
判一判
(1)被封闭气体的质量发生变化不影响实验结果。( )
(2)一定质量的某种气体,在温度不变的情况下,压强与体积成正比。( )
提示:(1)× (2)×
课堂任务 封闭气体的压强的计算
1.系统处于平衡状态时,求封闭气体的压强
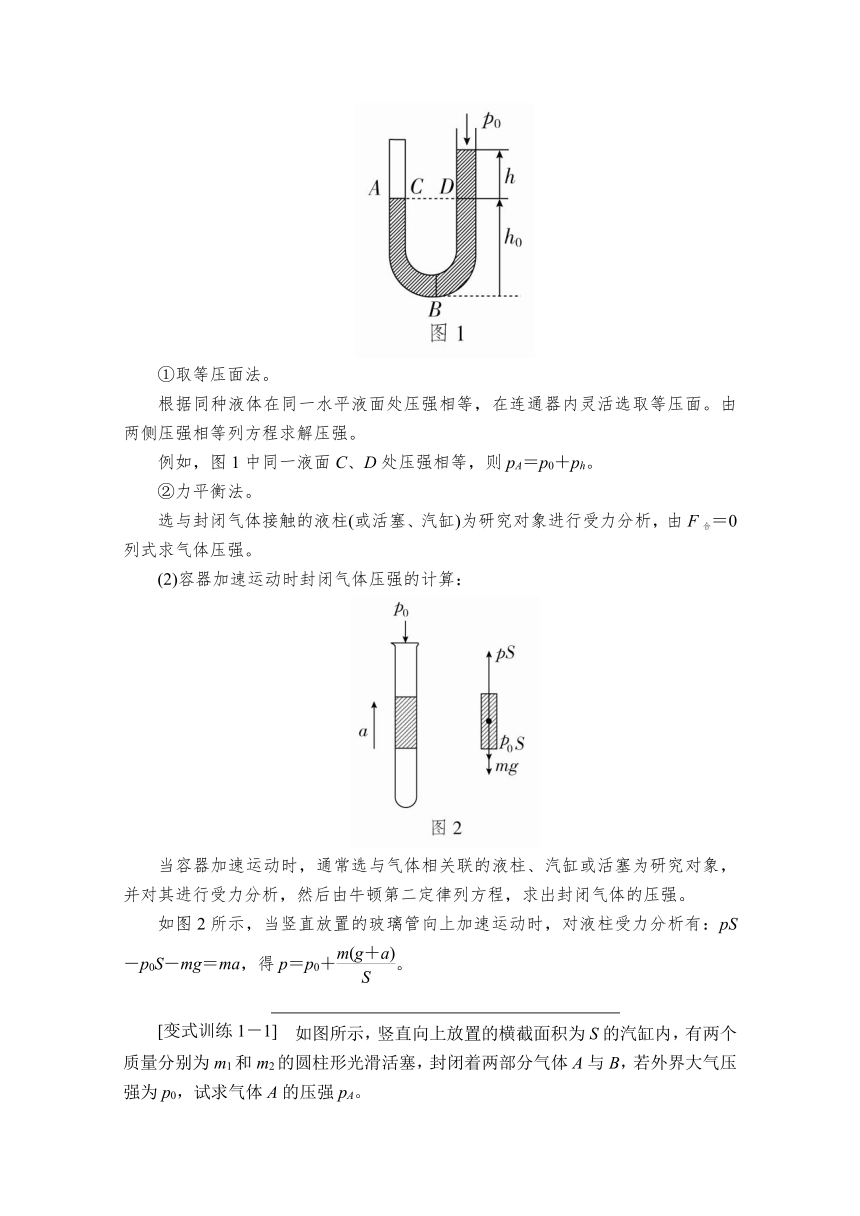
(1)连通器原理:在连通器中,同种液体(中间液体不间断)的同一水平液面上的压强是相等的。
(2)在考虑与气体接触的液柱所产生的附加压强p=ρgh时,应特别注意h是表示液面间竖直高度,不一定是液柱长度。
(3)求由液体封闭的气体压强,一般选择最低液面列平衡方程。
(4)求由固体封闭(如汽缸或活塞封闭)的气体压强,一般对此固体(如汽缸或活塞)进行受力分析,列出力的平衡方程。
2.容器加速运动时封闭气体的压强的求解
容器加速运动时,封闭气体压强的计算步骤如下:
(1)取封闭气体接触的液体(或活塞、汽缸)为研究对象(并不是以气体为研究对象)。
(2)对研究对象进行受力分析。(气体对研究对象的作用力写成F=pS形式)
(3)对研究对象建立直角坐标系并进行受力分析。
(4)分别在x轴和y轴上列牛顿第二定律方程。
(5)解方程。
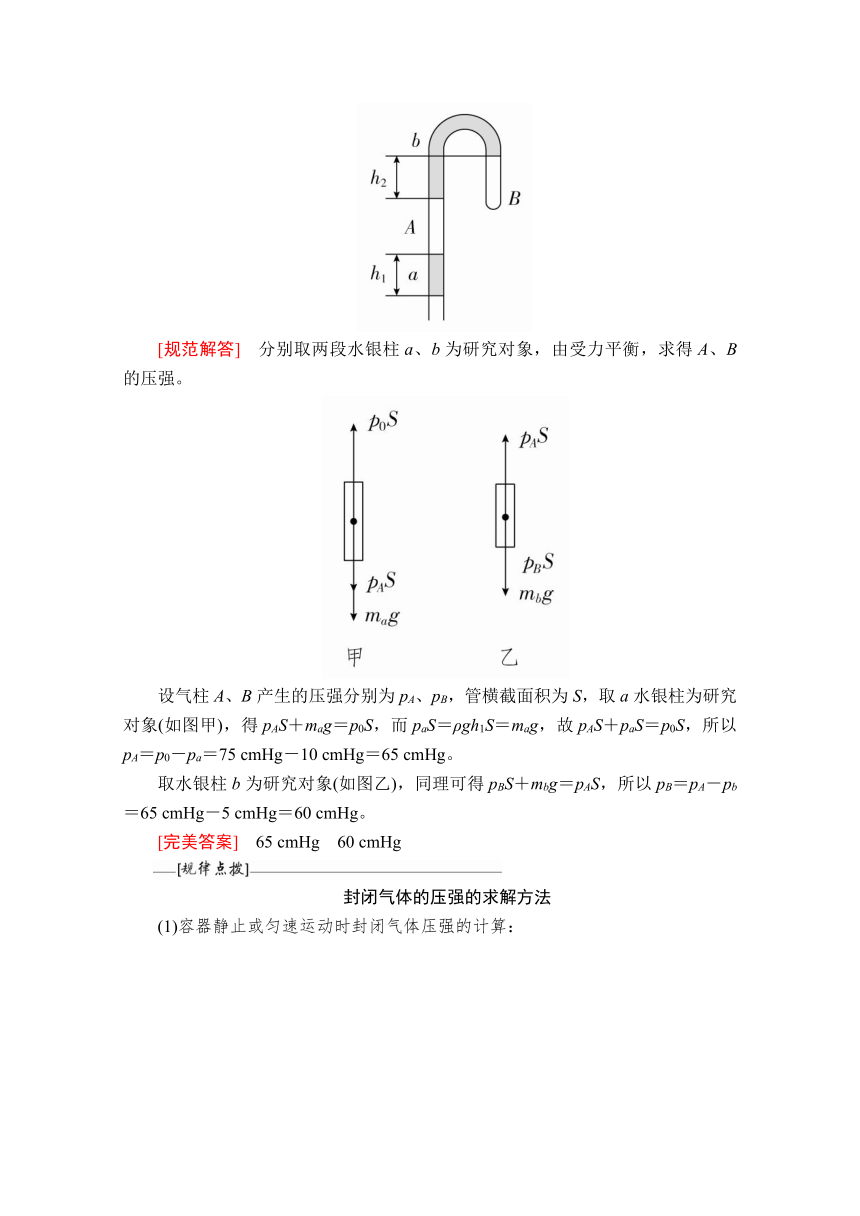
例1 如图所示,竖直放置的U形管,左端开口,右端封闭,管内有a、b两段水银柱,将A、B两段空气柱封闭在管内。已知水银柱a长为10 cm,水银柱b两个液面间的高度差为5 cm,大气压强为75 cmHg,求空气柱A、B产生的压强。
[规范解答] 分别取两段水银柱a、b为研究对象,由受力平衡,求得A、B的压强。
设气柱A、B产生的压强分别为pA、pB,管横截面积为S,取a水银柱为研究对象(如图甲),得pAS+mag=p0S,而paS=ρgh1S=mag,故pAS+paS=p0S,所以pA=p0-pa=75 cmHg-10 cmHg=65 cmHg。
取水银柱b为研究对象(如图乙),同理可得pBS+mbg=pAS,所以pB=pA-pb=65 cmHg-5 cmHg=60 cmHg。
[完美答案] 65 cmHg 60 cmHg
封闭气体的压强的求解方法
(1)容器静止或匀速运动时封闭气体压强的计算:
①取等压面法。
根据同种液体在同一水平液面处压强相等,在连通器内灵活选取等压面。由两侧压强相等列方程求解压强。
例如,图1中同一液面C、D处压强相等,则pA=p0+ph。
②力平衡法。
选与封闭气体接触的液柱(或活塞、汽缸)为研究对象进行受力分析,由F合=0列式求气体压强。
(2)容器加速运动时封闭气体压强的计算:
当容器加速运动时,通常选与气体相关联的液柱、汽缸或活塞为研究对象,并对其进行受力分析,然后由牛顿第二定律列方程,求出封闭气体的压强。
如图2所示,当竖直放置的玻璃管向上加速运动时,对液柱受力分析有:pS-p0S-mg=ma,得p=p0+。
如图所示,竖直向上放置的横截面积为S的汽缸内,有两个质量分别为m1和m2的圆柱形光滑活塞,封闭着两部分气体A与B,若外界大气压强为p0,试求气体A的压强pA。
答案 见解析
解析 用关联物整体法:将质量分别为m1和m2的两个活塞和气柱B看做一个整体,此时气柱B对上、下活塞的压力成为内力,可不必考虑,而气柱B的重力可以忽略,于是等效于将气柱B抽去,而将活塞m1、m2视为一个整体,由该整体受力平衡即可得出:pAS=p0S+(m1+m2)g,解得pA=p0+。
如图所示,上端封闭底部相连的A、B、C三管中水银面相平,三管横截面积的关系是SA>SB>SC。管内水银上方的空气柱长度为LA
C.一样高 D.条件不足,无法确定
答案 A
解析 未打开阀门前,A、B、C三管中水银面相平,所以三管中封闭气体的压强相同,记作p0。假设打开阀门K流出少量水银后,三管中水银面都降低了相同的高度h,三管中水银面仍然相平,对管中封闭气体应用玻意耳定律有:p0L=p(L+h)。解得末压强:p==。此式表明p与空气柱原长L有关。因为LA
课堂任务 玻意耳定律
利用玻意耳定律解题的基本思路
1.明确研究对象:根据题意,确定所研究的气体。
2.明确初、末状态:找出气体变化前后的初、末状态,并确定初、末状态的p、V值。
3.列方程求解:因为是比例式,计算中只需使同一物理量的单位统一即可,不一定用国际单位制中的单位。
4.检验结果:有时列方程求解会得到两个结果,应通过合理性的检验决定取舍。
(1)公式pV=C中的常量C不是一个普适常量,它与气体所
处的温度高低有关,温度越高,常量C越大。
(2)应用玻意耳定律解决等温变化的问题时,一定要先确定好两个状态的体积和压强。
例2 如图所示,在温度不变的情况下,把一根长为100 cm,上端封闭的玻璃管竖直插入水银槽中,插入后管口到槽内水银面的距离是管长的一半,若大气压为75 cmHg,求水银进入管内的长度。
[规范解答] 研究玻璃管内被封闭的空气柱。
初态:玻璃管未插入水银槽之前,p1=p0=75 cmHg;
V1=LS=100·S cm3,
末态:玻璃管插入水银槽后,设管内外水银面高度差为h,则p2=p0+ph=(75+h) cmHg,
V2=S=(50+h)S cm3,
根据玻意耳定律p1V1=p2V2得
75×100S=(75+h)(50+h)S,
即h2+125h-3750=0,
解得h=25 cm(h=-150 cm舍去),
所以,水银进入管内的长度为
-h= cm=25 cm。
[完美答案] 25 cm
变质量问题分析
解析变质量问题时,可以通过巧妙地选择合适的研究对象,使这类问题转化为一定质量的气体问题,用气体定律方程求解。
(1)打气问题
向球、轮胎中充气是一个典型的变质量的气体问题。只要选择球内原有气体和即将打入的气体作为研究对象,就可把充气过程中的气体质量变化的问题转化为定质量气体的状态变化问题。
(2)抽气问题
从容器内抽气的过程中,容器内的气体质量不断减小,这属于变质量问题。我们可以将每次抽气过程中抽出的气体和剩余气体作为研究对象,质量不变,故抽气过程看做是等温膨胀过程。
(3)灌气问题
将一个大容器里的气体分装到多个小容器中的问题也是一个典型的变质量问题。解决这类问题时,可以把大容器中的气体和多个小容器中的气体看做整体来作为研究对象,可将变质量问题转化为定质量问题。
(4)漏气问题
容器漏气过程中气体的质量不断发生变化,属于变质量问题。如果选容器内剩余气体和漏出的气体为研究对象,便可使问题变成一定质量的气体状态变化,可用气体定律方程求解。
输液时,不小心将2立方厘米气体注入血液,在血液中气体的体积多大?(气体按等温变化处理,且人的血压按120 mmHg,大气压按760 mmHg进行计算)
答案 1.7 cm3
解析 由于人的皮肤破了,血液向外流,故人体内的压强肯定大于大气压。人的血压值是其压强的绝对值减去大气压强之后的数值,所以空气进入体内后受的压强变大,p2=120 mmHg+760 mmHg=880 mmHg,
由p1V1=p2V2,
又p1=760 mmHg,V1=2 cm3,
解出V2=1.7 cm3。
如图所示,某压缩式喷雾器的贮液桶的容量是5.7×10-3
m3,往桶内倒入4.2×10-3 m3的药液后开始打气,打气过程中药液不会向外喷出。如果每次能打进2.5×10-4 m3的空气,要使喷雾器内空气的压强达到
4.0×105 Pa,应打几次气?这个压强能否使喷雾器内的药液全部喷完?(设大气压强为1.0×105 Pa)
答案 18次 能
解析 设大气压强为p0,每次打入的气体在大气压下的
体积为ΔV,贮液桶中空气体积为V,要使其压强达到4.0×105 Pa=4p0,需打n次气。根据玻意耳定律可得: p0V+p0nΔV=4p0V。
式中p0=1.0×105 Pa,ΔV=2.5×10-4 m3,
V=(5.7-4.2)×10-3 m3。
将数据代入上式中,解得n=18次。
当打开喷液口时,如果药液能全部喷出,则空气充满整个桶,这时桶内空气压强为p,则:4p0V=p×5.7×10-3。
代入V值,解得p=1.053p0。
可见,由于p>p0,因此药液可以全部喷出。
课堂任务 p-V图象与p- 图象的应用
p-V图象及p-图象上等温线的物理意义
1.一定质量的气体,其等温线是双曲线,双曲线上的每一个点均表示一定质量的气体在该温度下的一个状态,而且同一条等温线上每个点对应的p、V坐标的乘积都是相等的,如图甲所示。
2.玻意耳定律pV=C(常量),其中常量C不是一个普适常量,它随气体温度的升高而增大,温度越高,常量C越大,等温线离坐标轴越远。如图乙所示,4条等温线的关系为T4>T3>T2>T1。
3.一定质量气体的等温变化过程,也可以用p-图象来表示,如图丙所示。等温线是一条延长线通过原点的直线,由于气体的体积不能无穷大,所以靠近原点附近处应用虚线表示,该直线的斜率k==pV=C,即斜率越大,气体的温度越高。
例3 (多选)如图所示是一定质量气体的两条等温线,则下列关于各状态温度的说法中正确的是(A、B、C、D为四种状态) ( )
A.tA=tB B.tB=tC
C.tC>tD D.tD>tA
[规范解答] 根据p-V图象的变化规律可知tC=tD>tA=tB。故正确答案为A、D。
[完美答案] AD
(多选)如图所示为一定质量的气体在不同温度下的两条p-图线。由图可知( )
A.一定质量的气体在发生等温变化时,其压强与体积成正比
B.一定质量的气体在发生等温变化时,其p-图线的延长线经过坐标原点
C.T1>T2
D.T1
解析 由图线可知A错误,B正确。p-图线斜率越大,气体的温度越高,C错误,D正确。
