鲁科版 高中化学 选修三 第3章 物质的聚集状态与物质性质 过关练习 含解析
文档属性
| 名称 | 鲁科版 高中化学 选修三 第3章 物质的聚集状态与物质性质 过关练习 含解析 |

|
|
| 格式 | zip | ||
| 文件大小 | 144.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-03 23:15:45 | ||
图片预览



文档简介
绝密★启用前
鲁科版 高中化学 选修三 第3章 物质的聚集状态与物质性质 过关练习
本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷
一、单选题(共10小题,每小题4.0分,共40分)
1.下列说法正确的是
A. 分子晶体中只存在非极性共价键
B. 稀有气体形成的晶体属于分子晶体
C. 干冰升华时,分子内共价健会发生断裂
D. 金属元素和非金属元素形成的化合物一定是离子化合物
2.在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C--C键间的夹角是 ( )
A. 6个120°
B. 5个108°
C. 4个109°28′
D. 6个109°28′
3.金属晶体的堆积方式、空间利用率和配位数关系正确的是( )
A. 钋Po——简单立方堆积——52%——6
B. 钠Na——钾型——74%——12
C. 锌Zn——镁型——68%——8
D. 银Ag——铜型——74%——8
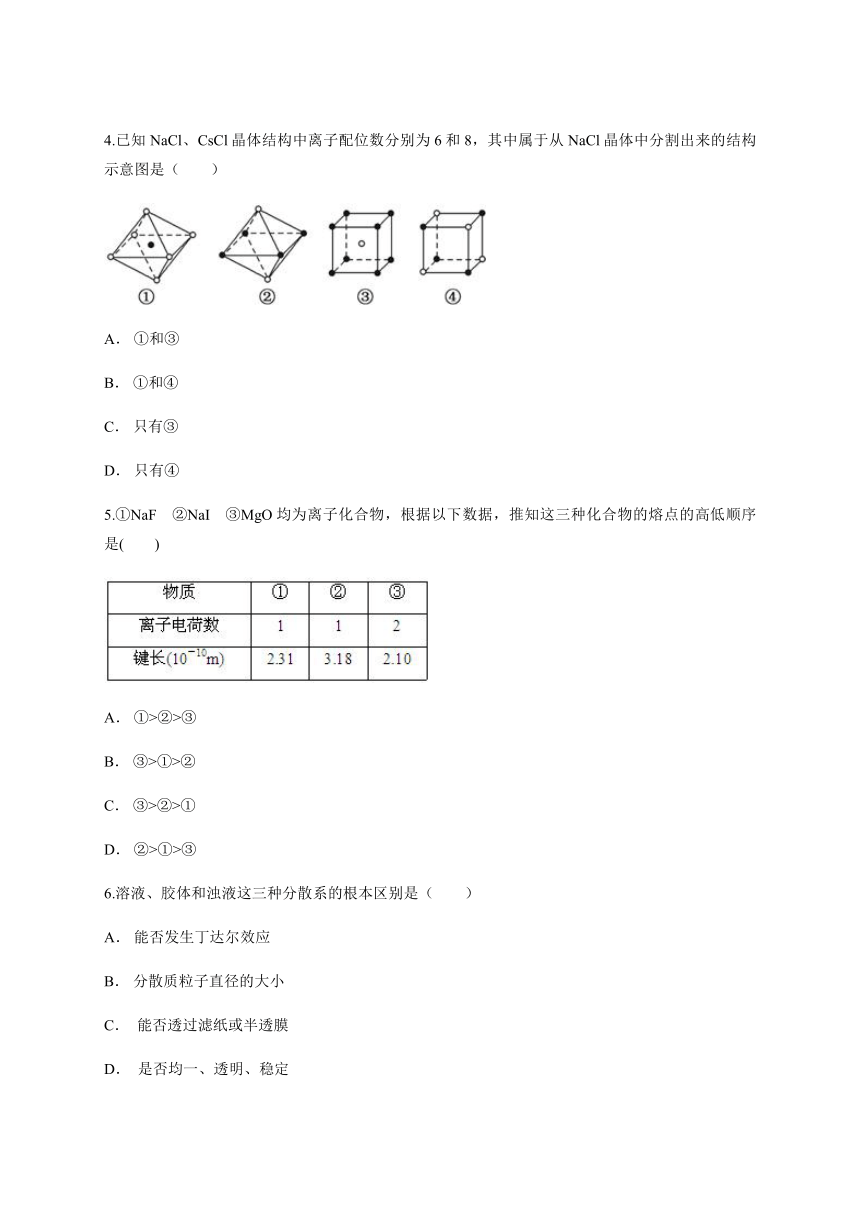
4.已知NaCl、CsCl晶体结构中离子配位数分别为6和8,其中属于从NaCl晶体中分割出来的结构示意图是( )
A. ①和③
B. ①和④
C. 只有③
D. 只有④
5.①NaF ②NaI ③MgO均为离子化合物,根据以下数据,推知这三种化合物的熔点的高低顺序是( )
A. ①>②>③
B. ③>①>②
C. ③>②>①
D. ②>①>③
6.溶液、胶体和浊液这三种分散系的根本区别是( )
A. 能否发生丁达尔效应
B. 分散质粒子直径的大小
C. 能否透过滤纸或半透膜
D. 是否均一、透明、稳定
7.下列几种分散系中,最稳定的是( )
A. 溶液
B. 悬浊液
C. 乳浊液
D. 胶体
8.下列有关离子晶体的数据大小比较不正确的是( )
A. 熔点:NaF>MgF2>AlF3
B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2
D. 硬度:MgO>CaO>BaO
9.下列有关金属晶体判断正确的是( )
A. 简单立方、配位数6、空间利用率68%
B. 钾型、配位数6、空间利用率68%
C. 镁型、配位数8、空间利用率74%
D. 铜型、配位数12、空间利用率74%
10.下列有关晶体和非晶体的说法中正确的是( )
A. 具有规则几何外形的固体均为晶体
B. 晶体具有自范性,非晶体没有自范性
C. 晶体研碎后即变为非晶体
D. 将玻璃加工成规则的固体即变成晶体
二、双选题(共5小题,每小题6.0分,共30分)
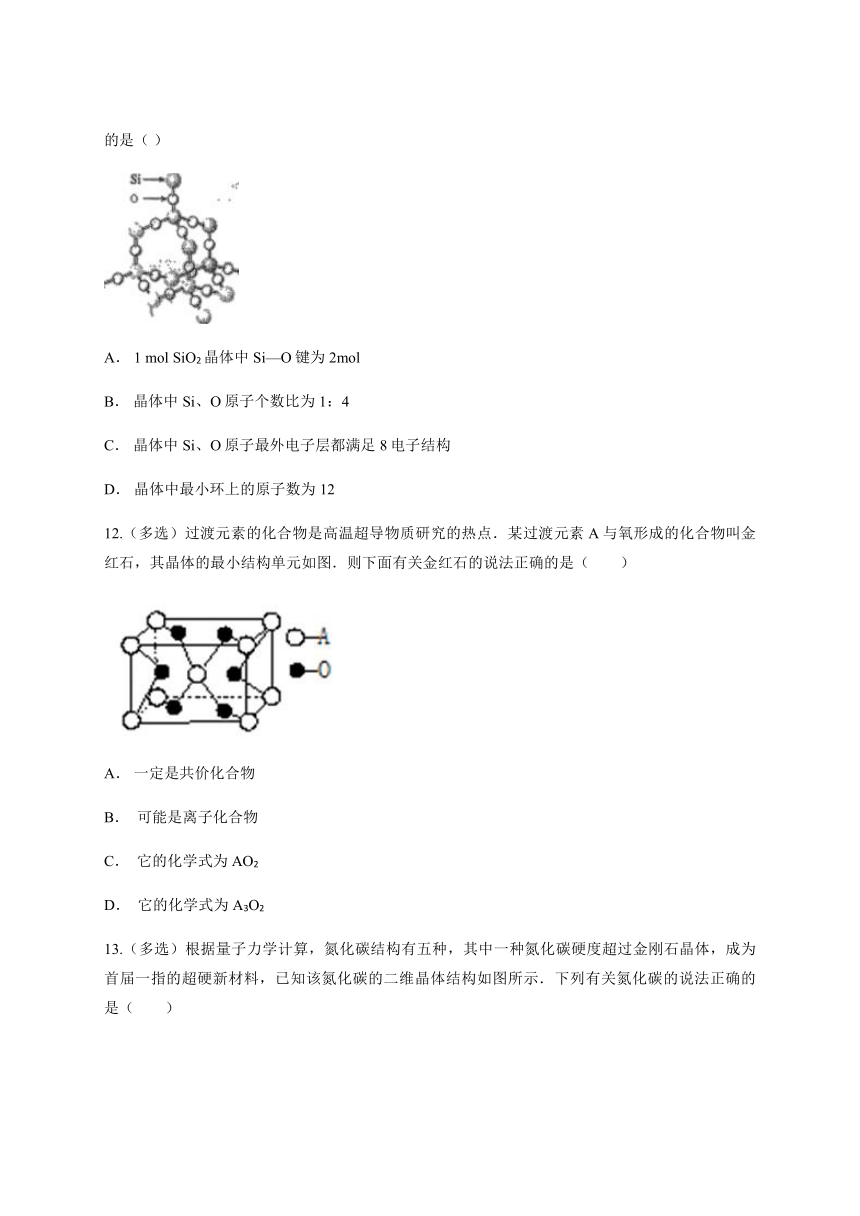
11.(多选)二氧化硅晶体是空间网状结构,如图所示。关于二氧化硅晶体的下列说法中,不正确的是( )
A. 1 mol SiO2晶体中Si—O键为2mol
B. 晶体中Si、O原子个数比为1:4
C. 晶体中Si、O原子最外电子层都满足8电子结构
D. 晶体中最小环上的原子数为12
12.(多选)过渡元素的化合物是高温超导物质研究的热点.某过渡元素A与氧形成的化合物叫金红石,其晶体的最小结构单元如图.则下面有关金红石的说法正确的是( )
A. 一定是共价化合物
B. 可能是离子化合物
C. 它的化学式为AO2
D. 它的化学式为A3O2
13.(多选)根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首届一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示.下列有关氮化碳的说法正确的是( )
A. 氮化碳属于分子晶体
B. 氮化碳的分了式为C3N4
C. 该晶体中的碳、氮原子核外都满足8电子稳定结构
D. 每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
14.(多选)金属晶体的堆积方式、空间利用率和配位数关系正确的是( )
A. 钋Po——简单立方堆积——52%——6
B. 钠Na——钾型——74%——12
C. 锌Zn——镁型——68%——8
D. 银Ag——铜型——74%——12
15.(多选)分析NaCl和CsCl的晶体结构,判断下列说法错误的是( )
A. NaCl和CsCl都属于AB型的离子晶体
B. NaCl和CsCl晶体中阴、阳离子个数比相同,所以阴、阳离子的配位数相等
C. NaCl和CsCl晶体中阴、阳离子的配位数分别为6和8
D. NaCl和CsCl都属于AB型的离子晶体,所以阴、阳离子半径比相同
第Ⅱ卷
三、非选择题(共3小题,每小题10.0分,共30分)
16.Mn、Fe均为第4周期过渡金属元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素基态原子的价电子层的电子排布式为__________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此你的解释是___________
________________________________________________________________________。
(2)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________,Fe原子配位数之比为________。
17.C60、金刚石和石墨的结构模型如图所示(石墨仅表示其中的一层结构):
(1)C60、金刚石和石墨三者的关系互为。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是
NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入一个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是。
(3)石墨层状结构中,平均每个正六边形拥有的碳原子个数是个。
18.硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________ ,该能层具有的原子轨道数为________________、电子数为________________。
(2)硅主要以硅酸盐、________________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________个原子。
(4)单质硅可通过甲硅烷(SiH4) 分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________。
SiH4的稳定性小于CH4,更易生成氧化物,原因是 ________________。
(6)在硅酸盐中,SiO44+四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________。Si与O的原子数之比为 ________________ 化学式为________.
答案解析
1.【答案】B
【解析】分子晶体的单质只存在非极性共价键,而化合物中则含有极性共价键,A不正确;稀有气体为单原子分子,B正确;干冰升华时,分子内共价键不会发生断裂,破坏的是二氧化碳分子之间的作用力,C不正确;只有活泼金属与活泼非金属才能形成离子化合物,而氯化铝等物质则为共价化合物,D不正确
2.【答案】D
【解析】在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数是6;金刚石中,每个碳原子周围与4个碳原子相连,呈正四面体结构,所以每个碳原子上任意两个C--C键间的夹角是109°28′,选D。
3.【答案】A
【解析】根据常见金属晶体的堆积模型,简单立方体堆积只有Po;钾型有Na、K、Fe等,空间利用率68%,配位数8,故B项错误;镁型有Mg、Zn、Ti等,空间利用率为74%,配位数12,故C项错误;铜型有Cu、Ag、Au等,空间利用率为74%,配位数12,故D项错误。
4.【答案】B
【解析】由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl﹣同样每个Cl﹣周围同时吸引着最近的等距离的6个Na+,图①中符合条件,图④中选取其中一个离子,然后沿X、Y、Z三轴切割得到6个等距离的且最近的带相反电荷的离子,所以其配位数也是6,故符合条件。
5.【答案】B
【解析】③中镁离子和氧离子的电荷大,半径小,所以晶格能最大,熔点最高,①②中离子所带电荷相同,但②中碘的半径大于①中氟的半径,故NaI的晶格能小于NaF的晶格能,熔点最低。
6.【答案】B
【解析】根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),
所以溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,
故A、C、D错误,B正确,
7.【答案】A
【解析】A.溶液是稳定的,故A正确;
B.悬浊液不稳定,静置分层,故B错误;
C.乳浊液不稳定,静置分层,故C错误;
D.胶体,为介稳体系,故D错误.
8.【答案】A
【解析】掌握好离子半径的大小变化规律是分析离子晶体性质的一个关键点。由于r(Na+)>r(Mg2+)>r(Al3+),且Na+、Mg2+、Al3+所带电荷数依次增大,所以NaF、MgF2、AlF3的离子键依次增强,晶格能依次增大,故熔点依次升高,A符合题意。r(F-)
【解析】简单立方空间利用率为52%,故A错;钾型配位数为8,故B错;镁型配位数为12,故C错。
10.【答案】B
【解析】A,具有规则几何外形的固体不一定是晶体,故A错误;
B,晶体的规则几何外形是自发形成的,有些固体尽管有规则的几何外形,但由于不是自发形成的,所以不属于晶体,所以晶体具有自范性,非晶体没有自范性,故B正确;
C,晶体研碎后还是晶体,故B错误;
D,将玻璃加工成规则的固体,玻璃仍然不是晶体,属于玻璃态物质,故D错误;
11.【答案】AB
【解析】A.1 mol SiO2 晶体中Si—O键为4mol,不正确
B.晶体中Si、O原子个数比为1:2,不正确
C.晶体中Si、O原子最外电子层都满足8电子结构,晶体中,每个Si原子形成四个共价键后借入4个电子而实现了8电子稳定结构,每个氧原子形成2个共价键后借入2个电子而实现了8电子稳定结构,正确。D.晶体中最小环上的原子数为12,正确
12.【答案】BC
【解析】A,过渡元素都是金属元素,所以某过渡元素A是金属元素,活泼金属和活泼非金属元素之间易存在离子键,金属元素和非金属元素之间可能存在共价键,所以金红石含有的化学键可能是共价键,而非一定是共价键,故A错误.
B,过渡元素都是金属元素,所以某过渡元素A是金属元素,活泼金属和活泼非金属元素之间易存在离子键,金属元素和非金属元素之间可能存在共价键,所以金红石含有的化学键可能是离子键,故B正确.
C,该晶胞中含有的O原子个数为2+0.5×4=4,A原子个数=1+8×0.125 +1=2,所以它的化学式为AO2,故C正确.
D,该晶胞中含有的O原子个数为2+ 0.5×4=4,A原子个数=1+8×0.125 =2,所以它的化学式为AO2,故D错误.
13.【答案】CD
【解析】A,由题给信息,氮化硅是超硬新材料,符合原子晶体的典型物理性质,故A错误;
B,因为氮化碳是原子晶体,不存在分子,故没有分子式,故B错误;
C,根据图中结构可知,每个碳原子周围有四个共价键,每个氮原子周围有三个共价键,碳原子最外层有4个电子,形成四个共价健后成八电子稳定结构,氮原子最外层有5个电子,形成三个共价键后,也是八电子稳定结构,故C正确;
D,根据图知,每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连,故D正确;
14.【答案】AD
【解析】B项钾型空间利用率为68%,配位数为8;C项中Zn为镁型,空间利用率为74%,配位数为12;A、D堆积方式,空间利用率和配位数均正确。
15.【答案】BD
【解析】A,NaCl和CsCl都是由离子构成的晶体,离子个数之比为1:1,则都属于AB型的离子晶体,故A正确;
B,结合图可知,NaCl为立方面向结构,钠离子的配位数为6,CsCl为立方体心结构,铯离子的配位数为8,故B错误;
C,NaCl晶体中,由体心的钠离子看出周围有6个氯离子,CsCl晶体中,由体心的铯离子看出周围有8个氯离子,故C正确;
D,NaCl和CsCl都属于AB型的离子晶体,由离子的电子层越多,离子半径越大可知钠离子半径小于铯离子半径,故D错误;故选BD。
16.【答案】(1)3d54s2 Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态) (2)2∶1 3∶2
【解析】(1)根据锰在元素周期表中的位置可写出其价电子排布,由于Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态),所以,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。
(2)根据题给晶胞的结构,在每个体心立方晶胞中含有的铁原子数目是2个(配位数是8),在每个面心立方晶胞中含有的铁原子数目是4个(配位数是12)。
17.【答案】(1)B (2)2 6 (3)2
【解析】晶体硅的结构与金刚石相似,存在以硅原子为中心和顶点的正四面体结构单元,每个硅原子形成4个Si—Si键,但一个Si—Si键为2个硅原子共有,故1个硅原子可形成2个Si—Si键,即1 mol硅原子能形成2 mol
Si—Si键,石墨中每个碳原子形成3个C—C键,故每个碳原子为3个六边形共用,每个六边形拥有碳原子个数为6×1/3 =2个。
18.【答案】(1)M 9 4
(2)二氧化硅
(3)共价键 3
(4)Mg2Si + 4NH4Cl = SiH4+ 4NH3+ 2MgCl2
(5)①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成。
②C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键。 (6)sp31∶3 [SiO3] n2n-(或SiO32-)
【解析】(1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2,对应能层分别别为K、L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级有3个轨道,d能级有5个轨道,所以共有9个原子轨道,硅原子的M能层有4个电子(3s23p2); 故答案为:M;9;4; (2)硅元素在自然界中主要以化合态(二氧化硅和硅酸盐)形式存在, 故答案为:二氧化硅 (3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合.在金刚石晶体的晶胞中,每个面心有一个碳原子(晶体硅类似结构),则面心位置贡献的原子为 6×1/2=3个;故答案为:共价键;3; (4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2,方程式为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2,故答案为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2; (5)①烷烃中的C-C键和C-H键大于硅烷中的Si-Si键和Si-H键的键能,所以硅烷中Si-Si键和Si-H键的键能易断裂,导致长链硅烷难以生成, 故答案为:C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成; ②键能越大、物质就越稳定,C-H键的键能大于C-O键,故C-H键比C-O键稳定,而Si-H键的键能远小于Si-O键,所以Si-H键不稳定而倾向与形成稳定性更强的Si-O键; 故答案:C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键; (6)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;故答案为:sp3根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32-; 故答案为:1:3;SiO32-;
