人教版九年级化学下册第九单元课题3.溶液的浓度(共50张PPT)
文档属性
| 名称 | 人教版九年级化学下册第九单元课题3.溶液的浓度(共50张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-03 13:10:32 | ||
图片预览









文档简介
(共53张PPT)
课题3
溶液的浓度
吉化六中
赵平
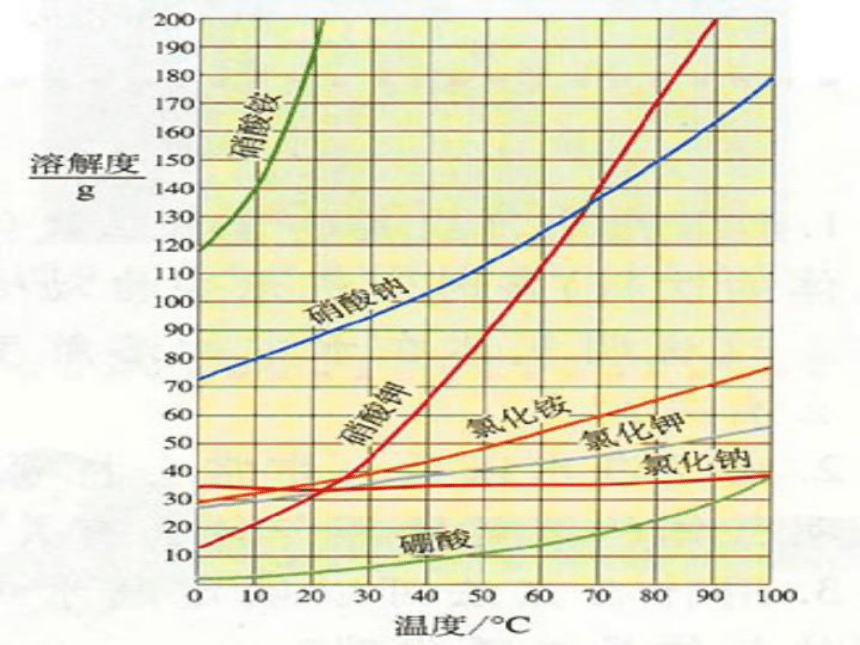
1.我们在描述溶解度的概念时最主要注意
哪四个要素?
2.影响固体溶解度的外因是什么?
它是怎样影响固体溶解度的?
复习提问
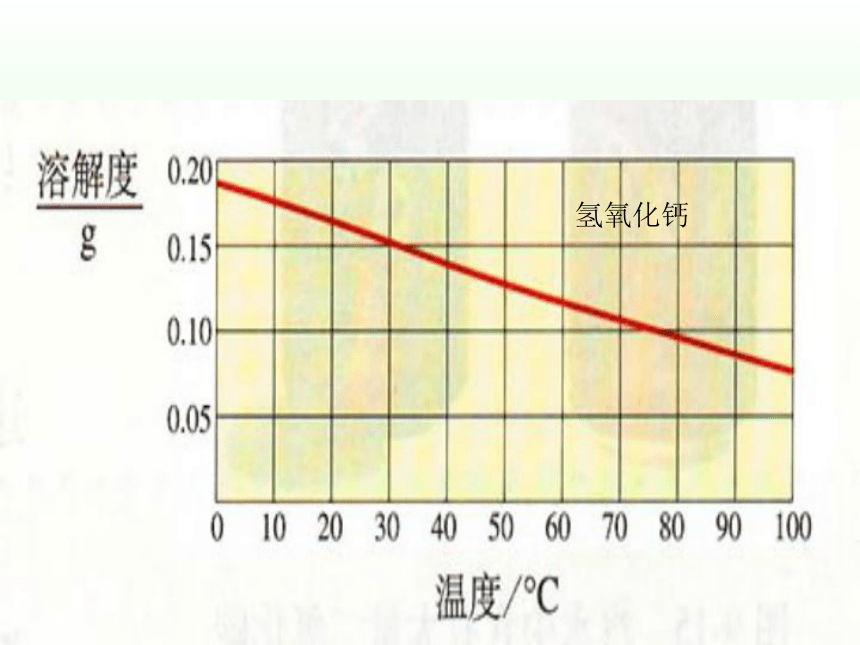
氢氧化钙
3、气体的溶解度
与哪些条件有关?
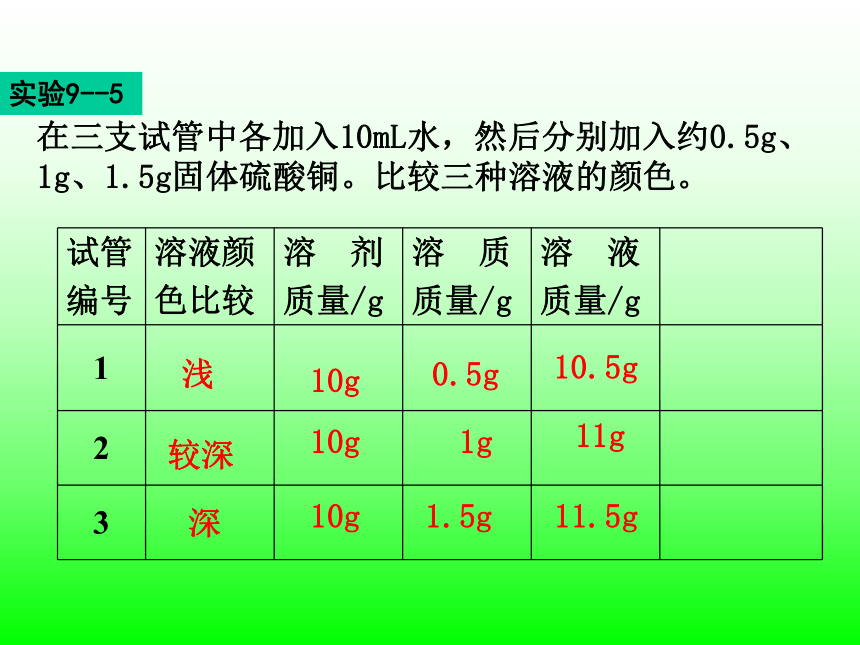
请同学们观察三种硫酸铜溶液的颜色得出三种溶液从稀到浓的结论再讨论三种溶液的组成。
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、1.5g固体硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
1
2
3
浅
较深
深
10g
10g
10g
0.5g
1g
1.5g
10.5g
11g
11.5g
实验9--5
飞机喷洒农药
喷洒药水
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木.
1.酒精度为52%(V/V)(多见于饮用酒)
11.5%(V/V)
750mL
2.100mL中有某物质多少毫克(多见于各种饮料)
酱油中某物质含量6mg/100mL(见商标)
3.某物质含量为X%
一、溶质的质量分数---表示溶液组成的一种方法
溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
温馨提示:溶质的质量分数用百分数表示!
溶质质量
溶液质量
=
×100%
=
溶质质量
溶质质量+溶剂质量
×100%
2.表达式:
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、1.5g固体硫酸铜。
计算并比较三种溶液的溶质质量分数。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
1
2
3
浅
较深
深
10g
10g
10g
0.5g
1g
1.5g
10.5g
11g
11.5g
实验9--5
溶质质量分数
4.8%
9.1%
13%
溶质质量
溶剂质量
溶液中溶质质量分数
10
90
20
80
20%
10%
实验9-6
一、溶质的质量分数---表示溶液组成的一种方法
溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
溶质质量
溶液质量
=
×100%
=
溶质质量
溶质质量+溶剂质量
×100%
2.表达式:
3.意义:
a%
每100份质量的溶液含a份质量的溶质
(如:10%
的氯化钠溶液就是100克氯化钠溶液里含氯化钠10克)
(份质量:克/千克/吨。。。。)
对10%的氯化钠溶液含义的解释错误的是:
A.100克氯化钠溶液中溶解有10克氯化钠
B.将氯化钠与水按1:10的质量比配成的溶液
C.将10克氯化钠溶解于90克水中所得到的溶液
D.100克水中溶解了10克氯化钠
B、D
溶质质量
溶剂质量
溶液质量
溶质的
质量分数
分成三分
加水
加入溶质
蒸发少量水
减少
减少
减少
不变
不变
增加
增加
减小
增加
不变
增加
增大
不变
减少
减少
增大
加
水
加硫酸铜
分析质量分数的变化
硫酸铜溶液
①溶质质量
②溶剂质量
a.增大溶质的质量分数方法:增加溶质质量或减少溶剂质量
b.减小溶质的质量分数方法:减少溶质质量或增加溶剂质量
影响溶质的质量分数的因素
1.一定质量的氯化钠溶液露置在空气中,一段时间后由于水分的
蒸发(无晶体析出),氯化钠的质量分数如何变化?
增大
2.将一定质量的食盐水由20
℃升温到40
℃
(若果不考虑水分的
蒸发),
则食盐的质量分数如何变化?
不变
3.将一定质量硝酸钾的饱和溶液由40
℃降温到20
℃
,溶液中
硝酸钾的质量分数如何变化?
变小
4.
20
℃氯化钠的饱和溶液蒸发掉10克水,析出3.6克晶体,
恢复到20
℃后,溶液中氯化钠的质量分数如何变化?
不变
6.若使100克10%的氯化钠溶液溶质的质量分数增大一倍,可采取什么方法?
①加
克氯化钠
②蒸发
克水
③加入质量分数大于20
%的氯化钠溶液
(如加
克30
%的氯化钠溶液)
12.5
50
100
二、有关质量分数的计算
推导公式
溶质质量=溶液质量×溶质的质量分数
溶质的质量分数
溶质质量
溶液质量
=
×100%
=
溶质质量
溶质质量+溶剂质量
×100%
溶液质量=溶质质量÷溶质的质量分数
溶剂质量=溶液质量-溶质质量
解:
氯化钠的质量=
150kg×16%
=24kg
水的质量
=150kg
-24kg
=126kg
答:需要氯化钠是24kg和水的质量是126kg
。
计算类型:
例1:在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种,现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
㈠溶质质量分数的简单计算及溶液的配制
例2、20g
10%的氯化钠溶液中,加入2g水或2g氯化钠固体或蒸发掉2g水(无晶体析出),求所得溶液中氯化钠的质量分数。
加水:
20g
×10%
20g+
2g
×100%
≈
9.1%
加氯化钠:
20g
×10%+2g
20g+
2g
×100%
≈
18.2%
答:~~~~~~
蒸发水:
20g-
2g
20g
×10%
×100%
≈
11.1%
例3、50克胆矾(CuSO4·
5H2O)溶在150克水中,求溶液中硫酸铜的质量分数。
注意:结晶水合物溶在水中,溶质不算结晶水!
50g
×
×100%
=
16%
50g
+150g
160
250
CuSO4-------
CuSO4·
5H2O
250
X
50
g
解:
答~~~
1.求以下的蔗糖溶液中溶质的质量分数:
(1).将30克蔗糖完全溶于120克水中;
(2).将上述溶液平均分为三杯;
(3).在一杯溶液中加入10克水;
(4).向另一杯溶液中加入10克蔗糖且完全溶解;
(5).将第三杯溶液蒸发掉10克水(无晶体析出);
(6).若将(1)所得溶液中溶质的质量分数变为
原来一半,需加水多少克
20
%
20
%
16.6
%
33.3%
25
%
150
g
怎样配制50g
6%氯化钠溶液?
步骤一:计算出需要氯化钠的质量和水的质量。
需要氯化钠的质量:
50g
×
6%
=
3g
步骤二:用托盘天平称量3g氯化钠,放入烧杯中。
需要蒸馏水的质量:
50g
-
3g
=47
g
实验活动5
步骤三:用50
ml量筒量取47
ml的水,(接近刻线时用胶头滴管滴入)倒入盛有氯化钠
的烧杯中。
50g6%氯化钠溶液配制成功了.OK!
步骤四:用玻璃棒搅拌,使氯化钠完全溶解。
实验活动5
怎样配制50g
6%氯化钠溶液?
配制操作流程图
溶液配制过程(四个步骤)
计算
称量
托盘天平
药匙
烧杯
玻璃棒
仪器:
重点!
溶解
量取
量筒
胶头滴管
1.实验室配制100克溶质质量分数为10%的食盐水,应选用的仪器是(
)
A、托盘天平、酒精灯、试管、药匙
B、托盘天平、玻璃棒、烧杯、漏斗
C、托盘天平、铁架台、试管、量筒
D、托盘天平、玻璃棒、烧杯、量筒
D
2.怎样配制100g
20%的氢氧化钠溶液?
2.配制100g质量分数为20%的氢氧化钠溶液,需要氢氧化钠固体和水各多少克?怎样配制?
需要氯化钠的质量:
100g
×
20%
=
20g
需要水的质量:
100g
-
20g
=80
g
配制步骤:①计算
②称量(用托盘天平称量20g氢氧化钠,放入烧杯中.注意:称量时应将药品放在烧杯中!!)
③量取(用100
ml量筒量取80
ml的水,接近刻度线时用滴管滴加,并将量取的80
ml水倒入盛有氢氧化钠的烧杯中,)
④溶解(用玻璃棒搅拌,使氢氧化钠完全溶解)
例1:把50g溶质质量分数为98%的浓硫酸稀释成20%的硫酸溶液,需要加水多少克
解:设稀释后溶液质量为X
50g
×
98%
=
X
·
20%
X
=
㈡溶液稀释的计算
稀释加水的质量:
245g-50g=195g
稀释前溶液中硫酸质量
稀释后溶液中硫酸质量
答:需要加水195克。
50g
×
20
%
98
%
=
245g
想一想:还有其它的解法?
重点!
(m水=
m稀-
m浓)
方法二:要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
解:设需加水的质量为X
50g×98%
=
(50g+
X
)
·
20%
X
=
195g
答:需要195克水。
例2:配制245g20%的稀硫酸,需要98%的浓硫酸多少克
解:需要98%浓硫酸的质量为X
245g
×
20%
=
X
·
98%
X
=
稀释后溶液中硫酸质量
稀释前溶液中硫酸质量
答:需要98%的浓硫酸是50克。
245g
×
98
%
20
%
=
50g
想一想:物质的质量、密度、体积三者是什么关系?
m=ρV
例2:配制100毫升溶质的质量分数为20%的稀硫酸,需要质量分数为98%的浓硫酸多少毫升
解:查表得出:20%的硫酸的密度为1.14g/cm3,
98%的硫酸的密度为1.84g/cm3。
设:需98%的浓硫酸的体积为V。
100cm3×1.14g/cm3×20%
稀释后溶液中含硫酸的质量
稀释前溶液中含硫酸的质量
V=
12.6cm3
答:配制100mL20%的稀硫酸需要12.6mL98%的浓硫酸。
硫酸的密度(g/cm3)和硫酸溶液中溶质的质量分数(%)对照表(20℃)
密度
1.01
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
质量分数
1
10
20
30
40
50
60
70
80
90
98
题中需要多少毫升的水?
水的质量是(100cm3×1.14g/cm3-12.6cm3×1.84g/cm3)g=90.8g
想一想:怎样配制该溶液呢?
V×1.84g/cm3×98%
=
需要98%浓硫酸的体积:12.6mL
需要水的体积:
90.8mL
配制步骤:①计算
②量取(用100
ml量筒量取90.8
ml的水,再用20
ml量筒量取12.6
ml
98%的浓硫酸)
③混匀(
先把90.8
ml的水倒入烧杯中,再把12.6
ml
98%的浓硫酸沿着烧杯壁慢慢的注入并用玻璃棒不断的搅拌)
温馨提示:
⑴溶液通常是用量筒量取体积来计算的,要注意溶液体积与质量之间的换算,即密度的应用。
⑵对于溶液的稀释或蒸发浓缩的计算,要抓住溶液的稀释或蒸发浓缩前后,溶质的质量不变,即
浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数
在一定温度下的饱和溶液中:
溶质的质量分数=
溶质质量
溶液质量
×100%
=
溶解度
100克+溶解度
×100%
溶质质量
溶剂质量
溶解度
100g
=
(正比例关系)
㈢饱和溶液中溶质的质量分数计算
例1:20℃时,氯化钠的溶解度为36克,
(1)计算此温度下饱和氯化钠溶液里氯化钠的质量分数
(2)能否配制出20℃溶质质量分数为36%的氯化钠溶液
=26.5%
=
36克
100克+36克
×100%
氯化钠的质量分数
不能。一定温度下的饱和溶液是浓度最大的!
例2、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:溶质在溶液中的质量分数
分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度
36
/(100+36)。
解:
x
=
18
<
20
则:溶质在溶液中的质量分数为:
×100%
≈
26.5%
x
g
g
g
1、下列叙述中正确的是(
)
对于易溶物,浓度很大时,不一定达到饱和。
A、浓度大的溶液一定是饱和溶液
B、饱和溶液的浓度一定大
C、通过溶液中溶质的质量分数可以换算出该溶质的溶解度
D、通过饱和溶液中溶质的溶解度可以换算出该溶质的质量分数
对于不易溶的物质,浓度很稀时就可能已经饱和。
只有饱和溶液时,才能进行二者的换算。
√
D
3、600C时,50克水最多能溶解55克硝酸钾,把600C时210克硝酸钾饱和溶液蒸发掉50克水后,再降至600C。晶体析出,求溶质在溶液中的质量分数。
分析:既然蒸发水后又降温,有晶体析出,说明溶液已经饱和,则溶液中溶质的质量分数可直接根据溶解度计算。
解:
g
g
g
例1.13克锌粒与100g稀硫酸恰好完全反应,
试求①生成氢气和稀硫酸的质量分数
②反应后所得溶液的溶质质量分数
解:
①设生成氢气的质量为X硫酸的质量分数为y
Zn+
H2SO4
=ZnSO4+
H2
↑
65
98
2
13g
100g·y
x
X
=0.4
g
(四)化学反应中溶质的质量分数的计算
=
=
65
98
100g·y
13g
Y=19.6%
65
2
13g
x
②设生成硫酸锌的质量为z
Zn+
H2SO4
=ZnSO4+
H2
↑
65
161
13g
z
65
161
13g
z
=
Z=32.2g
硫酸锌的质量分数
=
32.2g
13g+100g-0.4g
×
100
%
=28.6﹪
答:。。。。
100克某稀盐酸溶液与25克碳酸钙恰好完全反应,
试计算①这种稀盐酸中溶质的质量分数
②反应后溶液中溶质的质量分数
课题3
溶液的浓度
吉化六中
赵平
1.我们在描述溶解度的概念时最主要注意
哪四个要素?
2.影响固体溶解度的外因是什么?
它是怎样影响固体溶解度的?
复习提问
氢氧化钙
3、气体的溶解度
与哪些条件有关?
请同学们观察三种硫酸铜溶液的颜色得出三种溶液从稀到浓的结论再讨论三种溶液的组成。
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、1.5g固体硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
1
2
3
浅
较深
深
10g
10g
10g
0.5g
1g
1.5g
10.5g
11g
11.5g
实验9--5
飞机喷洒农药
喷洒药水
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木.
1.酒精度为52%(V/V)(多见于饮用酒)
11.5%(V/V)
750mL
2.100mL中有某物质多少毫克(多见于各种饮料)
酱油中某物质含量6mg/100mL(见商标)
3.某物质含量为X%
一、溶质的质量分数---表示溶液组成的一种方法
溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
温馨提示:溶质的质量分数用百分数表示!
溶质质量
溶液质量
=
×100%
=
溶质质量
溶质质量+溶剂质量
×100%
2.表达式:
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、1.5g固体硫酸铜。
计算并比较三种溶液的溶质质量分数。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
1
2
3
浅
较深
深
10g
10g
10g
0.5g
1g
1.5g
10.5g
11g
11.5g
实验9--5
溶质质量分数
4.8%
9.1%
13%
溶质质量
溶剂质量
溶液中溶质质量分数
10
90
20
80
20%
10%
实验9-6
一、溶质的质量分数---表示溶液组成的一种方法
溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
溶质质量
溶液质量
=
×100%
=
溶质质量
溶质质量+溶剂质量
×100%
2.表达式:
3.意义:
a%
每100份质量的溶液含a份质量的溶质
(如:10%
的氯化钠溶液就是100克氯化钠溶液里含氯化钠10克)
(份质量:克/千克/吨。。。。)
对10%的氯化钠溶液含义的解释错误的是:
A.100克氯化钠溶液中溶解有10克氯化钠
B.将氯化钠与水按1:10的质量比配成的溶液
C.将10克氯化钠溶解于90克水中所得到的溶液
D.100克水中溶解了10克氯化钠
B、D
溶质质量
溶剂质量
溶液质量
溶质的
质量分数
分成三分
加水
加入溶质
蒸发少量水
减少
减少
减少
不变
不变
增加
增加
减小
增加
不变
增加
增大
不变
减少
减少
增大
加
水
加硫酸铜
分析质量分数的变化
硫酸铜溶液
①溶质质量
②溶剂质量
a.增大溶质的质量分数方法:增加溶质质量或减少溶剂质量
b.减小溶质的质量分数方法:减少溶质质量或增加溶剂质量
影响溶质的质量分数的因素
1.一定质量的氯化钠溶液露置在空气中,一段时间后由于水分的
蒸发(无晶体析出),氯化钠的质量分数如何变化?
增大
2.将一定质量的食盐水由20
℃升温到40
℃
(若果不考虑水分的
蒸发),
则食盐的质量分数如何变化?
不变
3.将一定质量硝酸钾的饱和溶液由40
℃降温到20
℃
,溶液中
硝酸钾的质量分数如何变化?
变小
4.
20
℃氯化钠的饱和溶液蒸发掉10克水,析出3.6克晶体,
恢复到20
℃后,溶液中氯化钠的质量分数如何变化?
不变
6.若使100克10%的氯化钠溶液溶质的质量分数增大一倍,可采取什么方法?
①加
克氯化钠
②蒸发
克水
③加入质量分数大于20
%的氯化钠溶液
(如加
克30
%的氯化钠溶液)
12.5
50
100
二、有关质量分数的计算
推导公式
溶质质量=溶液质量×溶质的质量分数
溶质的质量分数
溶质质量
溶液质量
=
×100%
=
溶质质量
溶质质量+溶剂质量
×100%
溶液质量=溶质质量÷溶质的质量分数
溶剂质量=溶液质量-溶质质量
解:
氯化钠的质量=
150kg×16%
=24kg
水的质量
=150kg
-24kg
=126kg
答:需要氯化钠是24kg和水的质量是126kg
。
计算类型:
例1:在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种,现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
㈠溶质质量分数的简单计算及溶液的配制
例2、20g
10%的氯化钠溶液中,加入2g水或2g氯化钠固体或蒸发掉2g水(无晶体析出),求所得溶液中氯化钠的质量分数。
加水:
20g
×10%
20g+
2g
×100%
≈
9.1%
加氯化钠:
20g
×10%+2g
20g+
2g
×100%
≈
18.2%
答:~~~~~~
蒸发水:
20g-
2g
20g
×10%
×100%
≈
11.1%
例3、50克胆矾(CuSO4·
5H2O)溶在150克水中,求溶液中硫酸铜的质量分数。
注意:结晶水合物溶在水中,溶质不算结晶水!
50g
×
×100%
=
16%
50g
+150g
160
250
CuSO4-------
CuSO4·
5H2O
250
X
50
g
解:
答~~~
1.求以下的蔗糖溶液中溶质的质量分数:
(1).将30克蔗糖完全溶于120克水中;
(2).将上述溶液平均分为三杯;
(3).在一杯溶液中加入10克水;
(4).向另一杯溶液中加入10克蔗糖且完全溶解;
(5).将第三杯溶液蒸发掉10克水(无晶体析出);
(6).若将(1)所得溶液中溶质的质量分数变为
原来一半,需加水多少克
20
%
20
%
16.6
%
33.3%
25
%
150
g
怎样配制50g
6%氯化钠溶液?
步骤一:计算出需要氯化钠的质量和水的质量。
需要氯化钠的质量:
50g
×
6%
=
3g
步骤二:用托盘天平称量3g氯化钠,放入烧杯中。
需要蒸馏水的质量:
50g
-
3g
=47
g
实验活动5
步骤三:用50
ml量筒量取47
ml的水,(接近刻线时用胶头滴管滴入)倒入盛有氯化钠
的烧杯中。
50g6%氯化钠溶液配制成功了.OK!
步骤四:用玻璃棒搅拌,使氯化钠完全溶解。
实验活动5
怎样配制50g
6%氯化钠溶液?
配制操作流程图
溶液配制过程(四个步骤)
计算
称量
托盘天平
药匙
烧杯
玻璃棒
仪器:
重点!
溶解
量取
量筒
胶头滴管
1.实验室配制100克溶质质量分数为10%的食盐水,应选用的仪器是(
)
A、托盘天平、酒精灯、试管、药匙
B、托盘天平、玻璃棒、烧杯、漏斗
C、托盘天平、铁架台、试管、量筒
D、托盘天平、玻璃棒、烧杯、量筒
D
2.怎样配制100g
20%的氢氧化钠溶液?
2.配制100g质量分数为20%的氢氧化钠溶液,需要氢氧化钠固体和水各多少克?怎样配制?
需要氯化钠的质量:
100g
×
20%
=
20g
需要水的质量:
100g
-
20g
=80
g
配制步骤:①计算
②称量(用托盘天平称量20g氢氧化钠,放入烧杯中.注意:称量时应将药品放在烧杯中!!)
③量取(用100
ml量筒量取80
ml的水,接近刻度线时用滴管滴加,并将量取的80
ml水倒入盛有氢氧化钠的烧杯中,)
④溶解(用玻璃棒搅拌,使氢氧化钠完全溶解)
例1:把50g溶质质量分数为98%的浓硫酸稀释成20%的硫酸溶液,需要加水多少克
解:设稀释后溶液质量为X
50g
×
98%
=
X
·
20%
X
=
㈡溶液稀释的计算
稀释加水的质量:
245g-50g=195g
稀释前溶液中硫酸质量
稀释后溶液中硫酸质量
答:需要加水195克。
50g
×
20
%
98
%
=
245g
想一想:还有其它的解法?
重点!
(m水=
m稀-
m浓)
方法二:要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
解:设需加水的质量为X
50g×98%
=
(50g+
X
)
·
20%
X
=
195g
答:需要195克水。
例2:配制245g20%的稀硫酸,需要98%的浓硫酸多少克
解:需要98%浓硫酸的质量为X
245g
×
20%
=
X
·
98%
X
=
稀释后溶液中硫酸质量
稀释前溶液中硫酸质量
答:需要98%的浓硫酸是50克。
245g
×
98
%
20
%
=
50g
想一想:物质的质量、密度、体积三者是什么关系?
m=ρV
例2:配制100毫升溶质的质量分数为20%的稀硫酸,需要质量分数为98%的浓硫酸多少毫升
解:查表得出:20%的硫酸的密度为1.14g/cm3,
98%的硫酸的密度为1.84g/cm3。
设:需98%的浓硫酸的体积为V。
100cm3×1.14g/cm3×20%
稀释后溶液中含硫酸的质量
稀释前溶液中含硫酸的质量
V=
12.6cm3
答:配制100mL20%的稀硫酸需要12.6mL98%的浓硫酸。
硫酸的密度(g/cm3)和硫酸溶液中溶质的质量分数(%)对照表(20℃)
密度
1.01
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
质量分数
1
10
20
30
40
50
60
70
80
90
98
题中需要多少毫升的水?
水的质量是(100cm3×1.14g/cm3-12.6cm3×1.84g/cm3)g=90.8g
想一想:怎样配制该溶液呢?
V×1.84g/cm3×98%
=
需要98%浓硫酸的体积:12.6mL
需要水的体积:
90.8mL
配制步骤:①计算
②量取(用100
ml量筒量取90.8
ml的水,再用20
ml量筒量取12.6
ml
98%的浓硫酸)
③混匀(
先把90.8
ml的水倒入烧杯中,再把12.6
ml
98%的浓硫酸沿着烧杯壁慢慢的注入并用玻璃棒不断的搅拌)
温馨提示:
⑴溶液通常是用量筒量取体积来计算的,要注意溶液体积与质量之间的换算,即密度的应用。
⑵对于溶液的稀释或蒸发浓缩的计算,要抓住溶液的稀释或蒸发浓缩前后,溶质的质量不变,即
浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数
在一定温度下的饱和溶液中:
溶质的质量分数=
溶质质量
溶液质量
×100%
=
溶解度
100克+溶解度
×100%
溶质质量
溶剂质量
溶解度
100g
=
(正比例关系)
㈢饱和溶液中溶质的质量分数计算
例1:20℃时,氯化钠的溶解度为36克,
(1)计算此温度下饱和氯化钠溶液里氯化钠的质量分数
(2)能否配制出20℃溶质质量分数为36%的氯化钠溶液
=26.5%
=
36克
100克+36克
×100%
氯化钠的质量分数
不能。一定温度下的饱和溶液是浓度最大的!
例2、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:溶质在溶液中的质量分数
分析:溶解度即为“溶解的限度”,50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度
36
/(100+36)。
解:
x
=
18
<
20
则:溶质在溶液中的质量分数为:
×100%
≈
26.5%
x
g
g
g
1、下列叙述中正确的是(
)
对于易溶物,浓度很大时,不一定达到饱和。
A、浓度大的溶液一定是饱和溶液
B、饱和溶液的浓度一定大
C、通过溶液中溶质的质量分数可以换算出该溶质的溶解度
D、通过饱和溶液中溶质的溶解度可以换算出该溶质的质量分数
对于不易溶的物质,浓度很稀时就可能已经饱和。
只有饱和溶液时,才能进行二者的换算。
√
D
3、600C时,50克水最多能溶解55克硝酸钾,把600C时210克硝酸钾饱和溶液蒸发掉50克水后,再降至600C。晶体析出,求溶质在溶液中的质量分数。
分析:既然蒸发水后又降温,有晶体析出,说明溶液已经饱和,则溶液中溶质的质量分数可直接根据溶解度计算。
解:
g
g
g
例1.13克锌粒与100g稀硫酸恰好完全反应,
试求①生成氢气和稀硫酸的质量分数
②反应后所得溶液的溶质质量分数
解:
①设生成氢气的质量为X硫酸的质量分数为y
Zn+
H2SO4
=ZnSO4+
H2
↑
65
98
2
13g
100g·y
x
X
=0.4
g
(四)化学反应中溶质的质量分数的计算
=
=
65
98
100g·y
13g
Y=19.6%
65
2
13g
x
②设生成硫酸锌的质量为z
Zn+
H2SO4
=ZnSO4+
H2
↑
65
161
13g
z
65
161
13g
z
=
Z=32.2g
硫酸锌的质量分数
=
32.2g
13g+100g-0.4g
×
100
%
=28.6﹪
答:。。。。
100克某稀盐酸溶液与25克碳酸钙恰好完全反应,
试计算①这种稀盐酸中溶质的质量分数
②反应后溶液中溶质的质量分数
同课章节目录
