人教版九年级化学下册第十单元 课题2 酸和碱的中和反应课件(共18张PPT)
文档属性
| 名称 | 人教版九年级化学下册第十单元 课题2 酸和碱的中和反应课件(共18张PPT) | 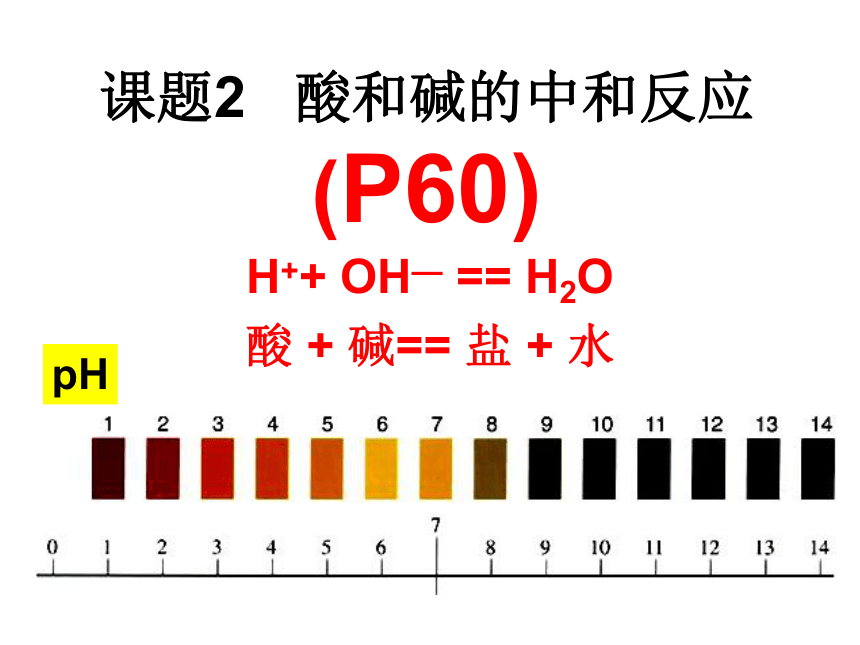 | |
| 格式 | ppt | ||
| 文件大小 | 676.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-05 09:02:47 | ||
图片预览




文档简介
(共18张PPT)
课题2 酸和碱的中和反应
(P60)
H++ OH— == H2O
酸 + 碱== 盐 + 水
pH
(1)认识酸和碱之间发生的中和反应。理解
中和反应等概念。
(2)了解酸和碱对生命活动和农作物的影响
以及中和反应在实际中的应用。
【教学目的】
重点:酸和碱中和反应及化学方程式的书写
难点:酸和碱反应的探究过程及理解中和
反应的实质
【教学重点难点】
(1)盐酸与氧化铝反应
(2)氢氧化钠溶液与二氧化碳反应
(3)生石灰与硫酸反应
6HCl + Al2O3 === 2AlCl3 + 3H2O
2NaOH + CO2== Na2CO3 + H2O
CaO + H2SO4 == CaSO4 + H2O
默写下列化学方程式
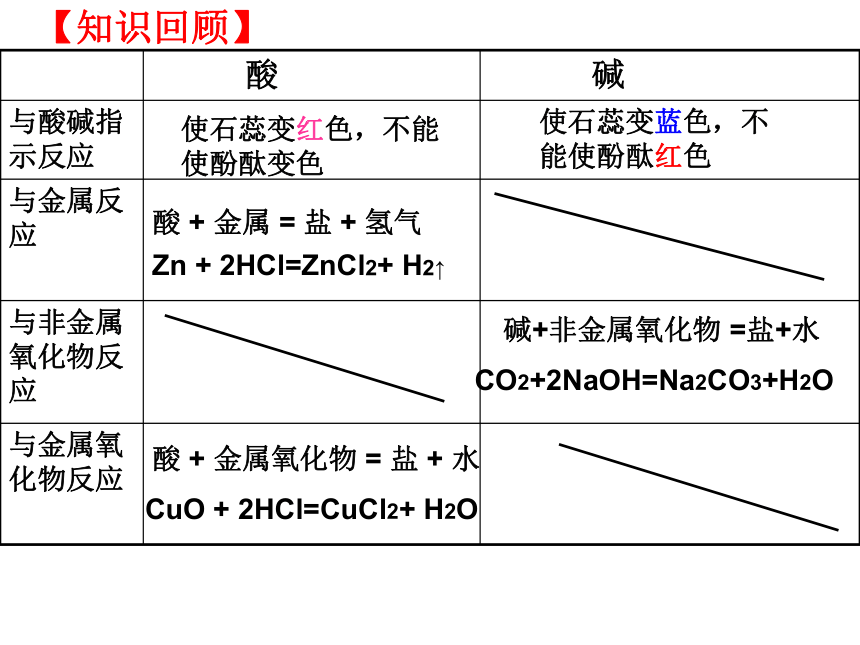
【知识回顾】
酸 碱
与酸碱指示反应
与金属反应
与非金属氧化物反应
与金属氧化物反应
使石蕊变红色,不能使酚酞变色
使石蕊变蓝色,不能使酚酞红色
Zn + 2HCl=ZnCl2+ H2↑
酸 + 金属 = 盐 + 氢气
碱+非金属氧化物 =盐+水
CO2+2NaOH=Na2CO3+H2O
酸 + 金属氧化物 = 盐 + 水
CuO + 2HCl=CuCl2+ H2O
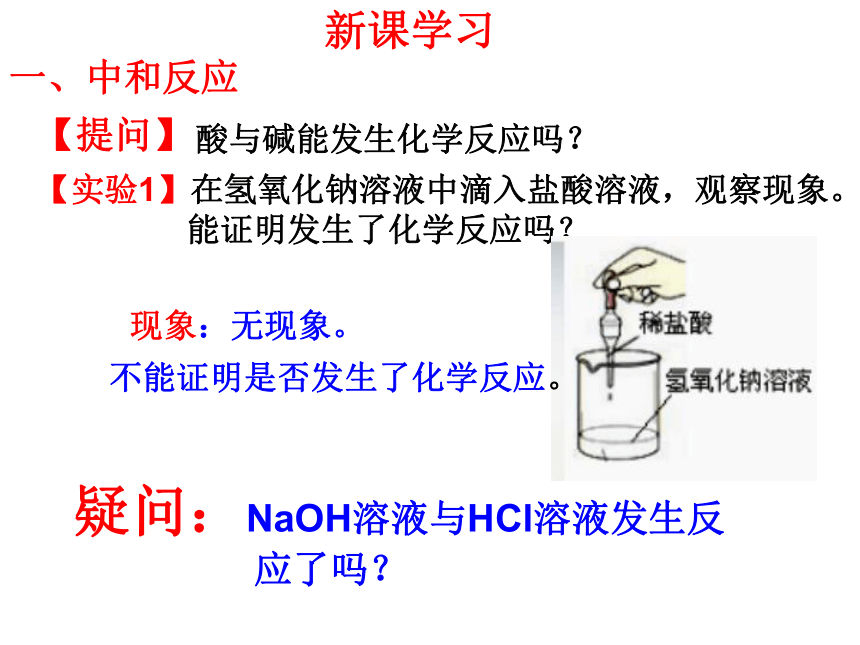
一、中和反应
【提问】
酸与碱能发生化学反应吗?
现象:无现象。
新课学习
【实验1】在氢氧化钠溶液中滴入盐酸溶液,观察现象。
能证明发生了化学反应吗?
疑问:NaOH溶液与HCl溶液发生反
应了吗?
不能证明是否发生了化学反应。
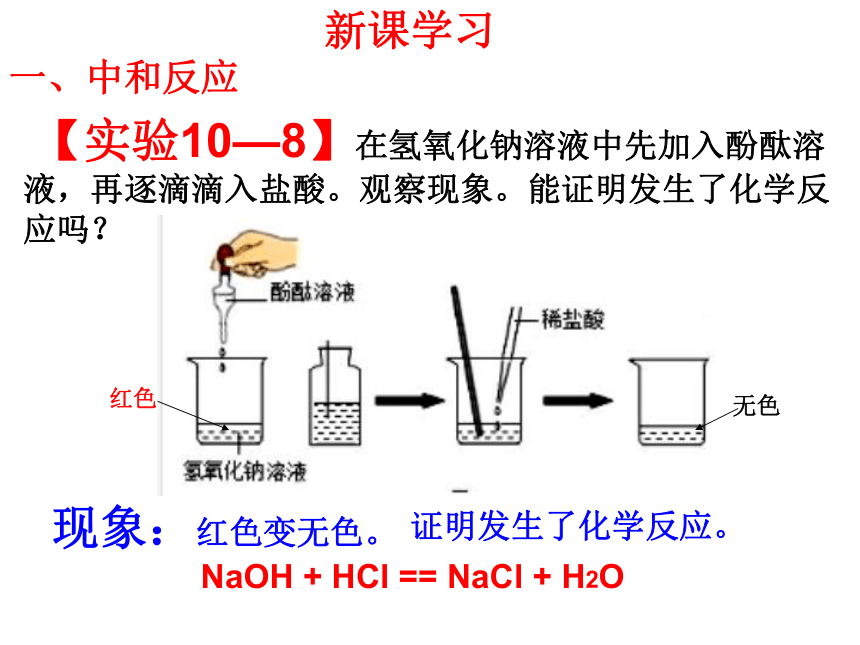
一、中和反应
【实验10—8】在氢氧化钠溶液中先加入酚酞溶液,再逐滴滴入盐酸。观察现象。能证明发生了化学反应吗?
新课学习
现象:红色变无色。
NaOH + HCl == NaCl + H2O
红色
无色
证明发生了化学反应。
一、中和反应
新课学习
【结论】
其他一些酸与碱也能发生化学反应,如:
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
2NaOH + H2SO4 == Na2SO4 + 2H2O
酸与碱反应生成盐和水
酸 + 碱 == 盐 + 水
概念:酸与碱作用生成盐和水的反应
叫中和反应。(放热反应)
常称“酸碱中和”
2.酸与碱能发生化学反应的微观原因:
酸在溶液中解离出的H+和碱在溶液中解离出的OH—反应生成稳定的H2O分子,所以酸和碱能发生化学反应。
H+ + OH— == H2O
(酸碱中和反应的本质)
二、中和反应在实际中的应用
阅读教材P61有关内容,思考下列问题:
(1)为了有利于农作物生长,利用熟石灰改良酸性
土壤,原因是__________________________。
(2)某工厂排出的废液中含有硫酸,为了不
污染环境,在处理废水时一般加入__________。
化学方程式为________________________。
熟石灰是碱,能中和土壤中的酸
熟石灰
涂一些碱性物质可减轻痛痒。因为碱性物质可中和蚊虫分泌的蚁酸。
(3)胃病患者常服用“胃舒平”(主要成分Al(OH)3)
可缓解病情,用化学方程式表示原因是:
________________________________。
(4)被蚊虫(分泌有毒蚁酸),叮咬后怎样处理可减
轻痛痒,有什么道理?
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O
3HCl + Al(OH)3 == AlCl3 + 3H2O
2.溶液酸碱度的表示方法:
3.PH范围:0——14.
1.溶液的酸碱度:
三、溶液的酸碱度的表示法—PH
溶液的酸碱度是用来精确衡量溶液酸碱性强弱程度的。
用PH表示。
酸性增强
碱性增强
中性
PH<7,为酸性溶液,PH越小,酸性越强。
PH=7,为中性溶液
PH>7,为碱性溶液,PH越大,碱性越强。
4.测定溶液PH的最简单方法:
用广泛PH试纸(测得的值取整数)
用PH试纸分别测下表中各溶液的PH,注意操作方法,并将观察到的现象填入下表,
【实验10—9】
PH 酸碱性
稀盐酸
稀硫酸
氢氧化钠溶液
氯化钠溶液
红色
红色
蓝色
黄色
酸性
酸性
碱性
中性
用玻璃棒蘸取少量溶液滴在试纸中间,再与标准比色卡比较,读出PH值。
测定溶液PH的操作方法:
酸溶液一定显酸性,但酸性溶液不一定是酸溶液(如
NH4Cl溶液显酸性),
碱溶液一定显碱性,但碱性溶液不一定是碱溶液(如
Na2CO3溶液显碱性,称纯碱)
[思考与交流]
2.酸性溶液一定是酸溶液吗?碱性溶液一定是碱溶液吗?
3.盐溶液一定显中性吗?
有些盐溶液显中性,如NaCl, Na2SO4,KNO3
有些盐溶液显酸性,如铵盐溶液,铁盐溶液等
有些盐溶液显碱性,如Na2CO3、NaHCO3等
溶液的酸碱性与溶液的酸碱度有什么区别?
溶液的酸碱性是从定性上认识溶液是酸性或碱性,溶液的酸碱度是从定量上认识溶液酸碱程度的强弱。
【实验10—10】测定生活中一些物质的PH.
酸碱性 酸碱性
橘汁 汽水
糖水 自来水
牛奶 唾液
番茄汁 草木灰
肥皂水 洗洁精
苹果汁 白醋
厕所清洁剂 牙膏
酸性
中性
中性
酸性
碱性
酸性
酸性
酸性
中性
中性
碱性
碱性
酸性
碱性
酸碱中和PH变化图
NaOH溶液体积
PH
7
P
PH
HCl溶液体积
7
P
.盐酸滴入氢氧化钠溶液中
.氢氧化钠滴入盐酸溶液中
(1)在化工生产中,许多反应必须在一定的_____溶液中
进行。
(2)在农业生产中,一般农作物适宜在____________
_____的土壤中生长。调节土壤的_____是改良土壤
的方法之一。
(3)正常雨水的PH=_______,酸雨的PH值<_______。
随时监测雨水PH,能即时了解_______情况,以便采
取必要的措施。
(4)健康人的体液必须维持在一定的_______范围内,
如果出现异常,则可能导致_______。
PH
PH=7或接近
中性
PH
5.6
5.6
酸碱度
空气污染
疾病
3.溶液的酸碱度在生活生产中的应用:
(5)洗发剂为_____,护发素为_____。用护发素护发的原因是__________________,减少对头发的伤害。
碱性
酸性
能中和洗发剂的碱性
【课堂练习二】
1.下列物质中可以与盐酸反应,但是不生成气体的是( )
A.Ag B.MgCO3 C.Al(OH)3 D.Fe
2.下列溶液中pH值最小的是( )
A.使无色酚酞变红的溶液 B.使紫色石蕊不变色的溶液
C.使紫色石蕊变蓝的溶液 D.使紫色石蕊变红的溶液
3.根据下表判断,肉类变质过程中酸碱性的变化趋势是
A.酸性变弱 B.酸性变强 ( )
C.酸性不变 D.碱性变弱
C
D
A
4、结合下表中所列物质的pH判断,在下列各组物质中,
分别能使紫色石蕊溶液变红、不变色、变蓝的是( )
A.柠檬汁、食盐水、厕所清洁剂
B.牙膏、蒸馏水、肥皂水
C.草木灰、蒸馏水、柠檬汁
D.橘汁、食盐水、草木灰水
5、已知下列各组中两种溶液的pH。试问哪一组溶液相互
混合后,溶液的PH可能等于7( )
A.pH=3 pH=4 B.pH=3 pH=10
C.PH=7 pH=11 D.pH=1 pH=7
D
B
【作业】
《课后作业》对应练习
《高分突破》对应训练
课题2 酸和碱的中和反应
(P60)
H++ OH— == H2O
酸 + 碱== 盐 + 水
pH
(1)认识酸和碱之间发生的中和反应。理解
中和反应等概念。
(2)了解酸和碱对生命活动和农作物的影响
以及中和反应在实际中的应用。
【教学目的】
重点:酸和碱中和反应及化学方程式的书写
难点:酸和碱反应的探究过程及理解中和
反应的实质
【教学重点难点】
(1)盐酸与氧化铝反应
(2)氢氧化钠溶液与二氧化碳反应
(3)生石灰与硫酸反应
6HCl + Al2O3 === 2AlCl3 + 3H2O
2NaOH + CO2== Na2CO3 + H2O
CaO + H2SO4 == CaSO4 + H2O
默写下列化学方程式
【知识回顾】
酸 碱
与酸碱指示反应
与金属反应
与非金属氧化物反应
与金属氧化物反应
使石蕊变红色,不能使酚酞变色
使石蕊变蓝色,不能使酚酞红色
Zn + 2HCl=ZnCl2+ H2↑
酸 + 金属 = 盐 + 氢气
碱+非金属氧化物 =盐+水
CO2+2NaOH=Na2CO3+H2O
酸 + 金属氧化物 = 盐 + 水
CuO + 2HCl=CuCl2+ H2O
一、中和反应
【提问】
酸与碱能发生化学反应吗?
现象:无现象。
新课学习
【实验1】在氢氧化钠溶液中滴入盐酸溶液,观察现象。
能证明发生了化学反应吗?
疑问:NaOH溶液与HCl溶液发生反
应了吗?
不能证明是否发生了化学反应。
一、中和反应
【实验10—8】在氢氧化钠溶液中先加入酚酞溶液,再逐滴滴入盐酸。观察现象。能证明发生了化学反应吗?
新课学习
现象:红色变无色。
NaOH + HCl == NaCl + H2O
红色
无色
证明发生了化学反应。
一、中和反应
新课学习
【结论】
其他一些酸与碱也能发生化学反应,如:
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
2NaOH + H2SO4 == Na2SO4 + 2H2O
酸与碱反应生成盐和水
酸 + 碱 == 盐 + 水
概念:酸与碱作用生成盐和水的反应
叫中和反应。(放热反应)
常称“酸碱中和”
2.酸与碱能发生化学反应的微观原因:
酸在溶液中解离出的H+和碱在溶液中解离出的OH—反应生成稳定的H2O分子,所以酸和碱能发生化学反应。
H+ + OH— == H2O
(酸碱中和反应的本质)
二、中和反应在实际中的应用
阅读教材P61有关内容,思考下列问题:
(1)为了有利于农作物生长,利用熟石灰改良酸性
土壤,原因是__________________________。
(2)某工厂排出的废液中含有硫酸,为了不
污染环境,在处理废水时一般加入__________。
化学方程式为________________________。
熟石灰是碱,能中和土壤中的酸
熟石灰
涂一些碱性物质可减轻痛痒。因为碱性物质可中和蚊虫分泌的蚁酸。
(3)胃病患者常服用“胃舒平”(主要成分Al(OH)3)
可缓解病情,用化学方程式表示原因是:
________________________________。
(4)被蚊虫(分泌有毒蚁酸),叮咬后怎样处理可减
轻痛痒,有什么道理?
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O
3HCl + Al(OH)3 == AlCl3 + 3H2O
2.溶液酸碱度的表示方法:
3.PH范围:0——14.
1.溶液的酸碱度:
三、溶液的酸碱度的表示法—PH
溶液的酸碱度是用来精确衡量溶液酸碱性强弱程度的。
用PH表示。
酸性增强
碱性增强
中性
PH<7,为酸性溶液,PH越小,酸性越强。
PH=7,为中性溶液
PH>7,为碱性溶液,PH越大,碱性越强。
4.测定溶液PH的最简单方法:
用广泛PH试纸(测得的值取整数)
用PH试纸分别测下表中各溶液的PH,注意操作方法,并将观察到的现象填入下表,
【实验10—9】
PH 酸碱性
稀盐酸
稀硫酸
氢氧化钠溶液
氯化钠溶液
红色
红色
蓝色
黄色
酸性
酸性
碱性
中性
用玻璃棒蘸取少量溶液滴在试纸中间,再与标准比色卡比较,读出PH值。
测定溶液PH的操作方法:
酸溶液一定显酸性,但酸性溶液不一定是酸溶液(如
NH4Cl溶液显酸性),
碱溶液一定显碱性,但碱性溶液不一定是碱溶液(如
Na2CO3溶液显碱性,称纯碱)
[思考与交流]
2.酸性溶液一定是酸溶液吗?碱性溶液一定是碱溶液吗?
3.盐溶液一定显中性吗?
有些盐溶液显中性,如NaCl, Na2SO4,KNO3
有些盐溶液显酸性,如铵盐溶液,铁盐溶液等
有些盐溶液显碱性,如Na2CO3、NaHCO3等
溶液的酸碱性与溶液的酸碱度有什么区别?
溶液的酸碱性是从定性上认识溶液是酸性或碱性,溶液的酸碱度是从定量上认识溶液酸碱程度的强弱。
【实验10—10】测定生活中一些物质的PH.
酸碱性 酸碱性
橘汁 汽水
糖水 自来水
牛奶 唾液
番茄汁 草木灰
肥皂水 洗洁精
苹果汁 白醋
厕所清洁剂 牙膏
酸性
中性
中性
酸性
碱性
酸性
酸性
酸性
中性
中性
碱性
碱性
酸性
碱性
酸碱中和PH变化图
NaOH溶液体积
PH
7
P
PH
HCl溶液体积
7
P
.盐酸滴入氢氧化钠溶液中
.氢氧化钠滴入盐酸溶液中
(1)在化工生产中,许多反应必须在一定的_____溶液中
进行。
(2)在农业生产中,一般农作物适宜在____________
_____的土壤中生长。调节土壤的_____是改良土壤
的方法之一。
(3)正常雨水的PH=_______,酸雨的PH值<_______。
随时监测雨水PH,能即时了解_______情况,以便采
取必要的措施。
(4)健康人的体液必须维持在一定的_______范围内,
如果出现异常,则可能导致_______。
PH
PH=7或接近
中性
PH
5.6
5.6
酸碱度
空气污染
疾病
3.溶液的酸碱度在生活生产中的应用:
(5)洗发剂为_____,护发素为_____。用护发素护发的原因是__________________,减少对头发的伤害。
碱性
酸性
能中和洗发剂的碱性
【课堂练习二】
1.下列物质中可以与盐酸反应,但是不生成气体的是( )
A.Ag B.MgCO3 C.Al(OH)3 D.Fe
2.下列溶液中pH值最小的是( )
A.使无色酚酞变红的溶液 B.使紫色石蕊不变色的溶液
C.使紫色石蕊变蓝的溶液 D.使紫色石蕊变红的溶液
3.根据下表判断,肉类变质过程中酸碱性的变化趋势是
A.酸性变弱 B.酸性变强 ( )
C.酸性不变 D.碱性变弱
C
D
A
4、结合下表中所列物质的pH判断,在下列各组物质中,
分别能使紫色石蕊溶液变红、不变色、变蓝的是( )
A.柠檬汁、食盐水、厕所清洁剂
B.牙膏、蒸馏水、肥皂水
C.草木灰、蒸馏水、柠檬汁
D.橘汁、食盐水、草木灰水
5、已知下列各组中两种溶液的pH。试问哪一组溶液相互
混合后,溶液的PH可能等于7( )
A.pH=3 pH=4 B.pH=3 pH=10
C.PH=7 pH=11 D.pH=1 pH=7
D
B
【作业】
《课后作业》对应练习
《高分突破》对应训练
同课章节目录
