人教版高中化学选修4教学讲义,复习补习资料(含知识讲解,巩固练习):10【基础】《化学反应速率与化学平衡》单元复习与巩固
文档属性
| 名称 | 人教版高中化学选修4教学讲义,复习补习资料(含知识讲解,巩固练习):10【基础】《化学反应速率与化学平衡》单元复习与巩固 |
|
|
| 格式 | zip | ||
| 文件大小 | 673.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-05 00:00:00 | ||
图片预览





文档简介
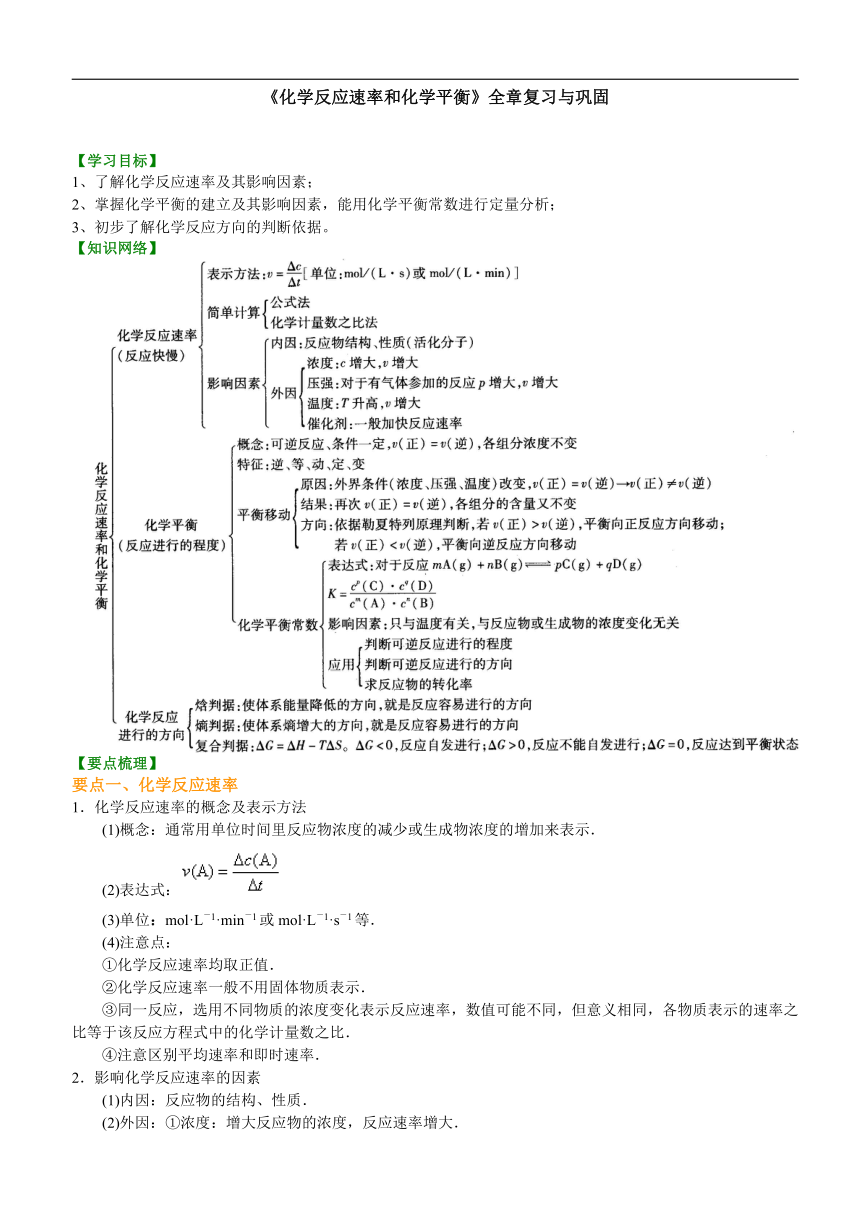
《化学反应速率和化学平衡》全章复习与巩固
【学习目标】
1、了解化学反应速率及其影响因素;
2、掌握化学平衡的建立及其影响因素,能用化学平衡常数进行定量分析;
3、初步了解化学反应方向的判断依据。
【知识网络】
【要点梳理】
要点一、化学反应速率
1.化学反应速率的概念及表示方法
(1)概念:通常用单位时间里反应物浓度的减少或生成物浓度的增加来表示.
(2)表达式:
(3)单位:mol·L-1·min-1或mol·L-1·s-1等.
(4)注意点:
①化学反应速率均取正值.
②化学反应速率一般不用固体物质表示.
③同一反应,选用不同物质的浓度变化表示反应速率,数值可能不同,但意义相同,各物质表示的速率之比等于该反应方程式中的化学计量数之比.
④注意区别平均速率和即时速率.
2.影响化学反应速率的因素
(1)内因:反应物的结构、性质.
(2)外因:①浓度:增大反应物的浓度,反应速率增大.
②温度:升高温度,反应速率增大.
③压强:对于有气体参加的反应,增大压强,气体物质的浓度增大,反应速率增大.
④催化剂:使用催化剂,反应速率增大.
要点二、化学平衡
(1)可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应.
(2)化学平衡的概念:是指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态.
(3)化学平衡的特征:
①逆:可逆反应
②等:v(正)=v(逆)
③动:动态平衡v(正)=v(逆)≠0
④定:平衡状态时反应混合物中各组分的浓度保持不变
⑤变:当浓度、温度、压强等条件改变时,化学平衡即发生移动
要点三、化学平衡的移动及影响因素
1.化学平衡的移动
(1)定义:可逆反应中旧化学平衡的破坏,新化学平衡的建立过程叫做化学平衡的移动.
(2)化学平衡移动的本质原因是v(正)≠v(逆).如催化剂能同等程度改变v(正)和v(逆),所以,加入催化剂,化学平衡不发生移动.
2.影响化学平衡的条件
条件的变化
平衡移动的方向
平衡移动的结果(均与改变条件时比较)
①浓度
向正反应方向移动
向逆反应方向移动
②压强
(气体)
增大
减小
向缩小气体体积方向移动
向增大气体体积方向移动
使气体压强减小
使气体压强增大
③温度
升高
降低
向吸热方向移动
向放热方向移动
使温度降低
使温度升高
3.化学平衡移动原理(即勒夏特列原理)
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.
要点四、化学平衡常数与转化率
1、化学平衡常数:?
对于一般的可逆反应:mA+nBpC+qD。其中m、n、p、q分别表示化学方程式中反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数可以表示为:
?
在一定温度下,可逆反应达到化学平衡时,生成物的浓度、反应物的浓度的关系依上述规律,其常数(用K表示)叫该反应的化学平衡常数
2、化学平衡常数的意义
①平衡常数的大小不随反应物或生成物浓度的改变而改变,只随温度的改变而改变。
②可以推断反应进行的程度。
K的意义:K很大,反应进行的程度很大,转化率大;K居中,典型的可逆反应,改变条件反应的方向变化;K 很小,反应进行的程度小,转化率小。
3、转化率:
可逆反应到达平衡时,某反应物的转化浓度(等于某反应物的起始浓度和平衡浓度的差)与该反应物的起始浓度比值的百分比。可用于表示可逆反应进行的程度。
要点五、化学反应进行的方向 ?
1、焓变和熵变的不同:
焓变(△H)指的是内能的变化值,常以热的形式表现出来。
熵变(△S)指的是体系的混乱程度。 S(g)>S(l)>S(s)
2、自发反应与否的判断依据
△H-T△S<0 正反应自发进行
△H-T△S>0 逆反应自发进行
【典型例题】
类型一、化学反应速率的概念及简单计算
例1 一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X (g)+Y (g)Z (g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
【思路点拨】解题时注意,题干中给出的是生成物的物质的量的变化,在分析选项时需要转化成反应物的浓度变化。
【答案】A
【解析】根据题意可以列出:
所以,故A选项正确;将容器的体积变为20 L的瞬间各物质的浓度均减半,根据平衡移动原理,此平衡应向逆反应方向移动,所以Z的平衡浓度比原来的要小,故B选项错误;由于此反应的正反应是气体体积缩小的反应,因此增大压强此平衡向右移动,反应物X和Y的转化率均增大,故C选项错误;X的体积分数增大,说明平衡向逆反应方向移动,而升高温度平衡应向吸热反应方向移动,因此此反应的正反应应为放热反应,即ΔH<0,所以D选项错误。
【总结升华】本题的易错点有:忽略化学反应速率为单位时间内物质浓度的变化而错选其他选项;对平衡移动原理(勒夏特列原理)理解片面而错选B或D。
举一反三:
【变式1】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
A.2.5mol·L-1·min-1和2.0mol·L-1
B.2.5mol·L-1·min-1和2.5mol·L-1
C.3.0mol·L-1·min-1和3.0mol·L-1
D.5.0mol·L-1·min-1和3.0mol·L-1
【答案】B
【解析】在4~8 min内反应物的浓度改变量为10mol·L-1,故4~8 min内的平均反应速率为2.5mol·L-1·min-1;图中从0 min开始到8 min反应物的浓度降低到原来的,根据这一幅度,可以推测从第8 min到第16 min,反应物的浓度降低到2.5mol·L-1。
类型二、化学反应速率的影响因素
例2(2019 晋江模拟)下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是( )
试管
温度
过氧化氢溶液浓度
催化剂
A
常温
3%
--
B
水浴加热
3%
--
C
水浴加热
6%
MnO2
D
常温
6%
--
【思路点拨】利用了控制变量法探究影响过氧化氢分解快慢的因素,根据浓度、催化剂和温度对反应速率的影响来分析。
【答案】C
【解析】使用合适的催化剂,改变反应历程,加快反应;升高温度,活化分子百分数增加,有效碰撞增多,加快反应;增大浓度,增加单位体积内的活化分子数,反应加快,显然只有C中温度高,浓度大、使用催化剂,则C中反应速率最快。故选C。
【总结升华】决定化学反应速率的根本原因是反应物本身的性质,而浓度、温度、压强、催化剂是外界影响因素。
举一反三:
【变式1】2SO2 (g)+O2 (g)2SO3 (g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5,不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3 (g)生成的平均速率为
【答案】D
【解析】催化剂可以同等程度的改变正、逆反应速率,A错;增大反应体系压强的方法有许多种,当向反应体系中充入无关气体时,压强增大,但反应速率不变,B错;降低温度将减小反应速率,达到平衡的时间增长,C错;反应速率就是用某一时间段内浓度的变化值除以反应时间来计算的,D对。
类型三、化学平衡状态的判断
例3 (1)下列方法中可以证明2 HI (g)H2 (g)+I2 (g)已达平衡状态的是________(填序号)。
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③(HI)=(I2)时
④反应速率时
⑤c (HI)∶c (H2)∶c (I2)=2∶1∶1时
⑥温度和体积一定时,某一生成物浓度不再变化时
⑦温度和体积一定时,容器内压强不再变化时
⑧条件一定,混合气体的平均相对分子质量不再变化时
⑨温度和体积一定时,混合气体的颜色不再变化时
⑩温度和压强一定时,混合气体的密度不再变化时
(2)在上述⑥~⑩的说法中能说明2NO2 (g)N2O4 (g)达到平衡状态的是________。
【思路点拨】解答时特别需要注意,反应(1)和反应(2)的不同之处,前者反应前后分子数不变;后者的正反应分子数减少。
【答案】(1)②⑥⑨ (2)⑥⑦⑧⑨⑩
【解析】由第(1)题反应的特征可知:此反应在反应前后气体的体积不发生变化,即在反应的任何一个阶段,容器内压强不发生改变。气体的总质量不变、总物质的量不变,因此混合气体的密度、平均相对分子质量均不发生改变。
由第(2)题反应的特征可知:反应前后气体体积发生改变,因此若平衡发生移动则混合气体的平均相对分子质量、混合气体密度都发生改变,当反应处于平衡状态时,这些都不再改变,此时c (NO2)恒定,混合气体的颜色不再变化。
【总结升华】判断化学平衡状态时要抓住“v (正)=v (逆)”和“各物质的百分含量不变”这两个核心判据。
举一反三:
【变式1】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3 (g)+NO (g)+NO2 (g)2N2 (g)+3H2O (g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
【答案】C
【解析】该反应是气体体积增大的放热反应。A项升高温度,平衡逆向移动,平衡常数减小,不正确;B项增大NH3的浓度,平衡向右移动,使氮氧化物的转化率增大,不正确;C项NO、N2的消耗分别代表正向、逆向的反应速率,速率的比值等于方程式中的化学计量数的比值,说明正、逆反应速率相等,故C正确;催化剂不影响化学平衡,D不正确。
类型四、根据化学平衡移动方向进行有关判断
例4 可逆反应:3A (g)3B (?)+C (?) ΔH>0,随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是( )
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C可能都是气体
【思路点拨】题目给出的化学方程式,正向为吸热反应,温度升高平衡正向移动。
【答案】CD
【解析】升温平衡正向移动,气体平均相对分子质量减小,有两种可能:①气体质量不变,气体物质的量增加,此时B与C均为气体。②气体质量减小,气体物质的量不变,此时B为气体,C为固体(或液体)。
【总结升华】气体平均相对分子质量为总质量与总物质的量的比值。其数值的减小,可能由两种情况引起:一是气体总质量减小,一是气体总物质的量减小。分析本题时,这两种情况都应该考虑。
例5 1和2分别为A在两个恒容容器中的平衡体系A (g)2B (g)和2A (g)B (g)的转化率,在温度不变的情况下,两反应器均增加A的物质的量,下列判断正确的是( )
A.1、2均减小 B.1、2均增大
C.1减小, 2增大 D.1增大,2减小
【答案】C
【解析】上述两个反应中反应物和生成物都只有一种,不管增加反应物还是生成物的量,都相当于增大压强。根据平衡移动的原理,A (g)2B (g)平衡将逆向移动,1减小,2A (g)B (g)平衡将正向移动,2增大。则选项C符合题意。
举一反三:
【变式1】在一定温度下,反应H2 (g)+X2 (g)HX (g)的平衡常数为10。若将1.0 mol的HX (g)通入体积为1.0 L的密闭容器中,在该温度时HX (g)的最大分解率接近于( )
A.5% B.17% C.25% D.33%
【答案】B
【解析】
,解得x=0.0833
所以。
【变式2】硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2==H2SO4+2HI
Ⅱ 2HIH2+I2
Ⅲ 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI (g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v (HI)=________。该温度下,H2 (g)+I2 (g)2HI (g)的平衡常数K=______。
相同温度下,若开始加入HI (g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2 (g)+O2 (g)==2H2O (1) ΔH=-572 kJ·mol-1 某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
【答案】(1)c (2)0.1 mol·L-1·min-1 64 b (3)向右 b (4)80%
【解析】本题主要考查了化学反应速率、化学平衡、水的电离平衡和化学计算。
(1)a项,反应Ⅲ在常温下不能进行;b项,SO2的还原性比HI强;C项,根据盖斯定律Ⅰ×2+Ⅱ×2+Ⅲ得总反应:2H2O==2H2+O2,循环过程中消耗了H2O;d项,根据总反应知产生1 mol O2的同时产生2 mol H2。
(2)由题干数据分析该反应:
0~2 min内平均反应速率
平衡常数。
第三问,若开始加入HI的物质的量是原来的2倍,相当于先将Ⅲ加入到2 L的容器(达到的平衡状态与原平衡一致,即HI的浓度、H2的体积分数与原平衡相同),再将体积压缩至1 L,因为该反应为体积不变的反应,加压平衡不移动,所以HI浓度为原来的2倍,H2的体积分数不变;温度不变,平衡常数不变;加入HI的物质的量增大,反应物浓度增大,反应速率加快,达到平衡的时间缩短。
(3)Zn与稀H2SO4反应,c (H+)减小,水的电离平衡向右移动;若向原溶液加入NaNO3,Zn与H+、NO3-反应不生成H2;若加CuSO4,Zn+CuSO4==ZnSO4+Cu,Zn与Cu构成原电池,加快反应速率;若加Na2SO4对反应速率没有影响;若加NaHSO3,HSO3-消耗H+生成H2O和SO2,减缓反应速率。
(4)生成1 mol液态水,理论上放热,则该电池的能量转化率为:。
类型五、化学平衡图像分析
例6某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )。 A.反应Ⅰ△H>0,P2>P1 B.反应Ⅱ△H<0,T1>T2 C.反应Ⅲ△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ△H<0,T2>T1
【思路点拨】当题目中涉及多个变量时,应先固定其中的几个变量,只分析其余的一个变量,即固定变量法,这样分析影响因素时才比较简单、确切。另外,分析图像时需要注意其纵、横坐标所代表的物理量。
【答案】BC
【解析】A.反应Ⅰ的特点是正反应方向为气体体积减小的方向,结合图象,压强增大A的转化率应增大,所以P2>P1,它随温度的升高A的转化率降低,所以正反应为放热反应△H<0,故A错误;
B.关于反应Ⅱ由图象可以看出T1条件下达到平衡所用的时间少,所以T1>T2,而在T1条件下达平衡时n(C)小,所以说明低温有利于C的生成,故它主要的正反应为放热反应△H<0,B正确;
C.关于反应Ⅲ,由图象可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应为吸热反应△H>0,而当T2<T1时正反应为放热反应△H<0,故C正确;
D.关于反应Ⅳ,由图象可以看出T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向进行,因此正反应为吸热反应△H>0,故D错误。
故选BC。
【总结升华】平衡图像题可采用如下解题模式:
(1)先分析题中反应的特点(是放热反应还是吸热反应,是气体体积增大的反应还是气体体积缩小的反应等)。一定要抓住图像中条件改变瞬间所引起的浓度、压强、速率的变化,然后针对各种条件改变时引起的变化的特征进行对照分析。
(2)再分析图像所表达的各个量之间的关系(两个坐标轴各表示什么物理量,曲线的变化趋势如何,是单一曲线还是多条曲线,曲线上的关键点,如起点、拐点、交点、终点的含义是什么等)。
举一反三:
【变式1】图中曲线a表示放热反应X(g)+Y(g)Z(g)+N(s)进行过程中X的转化率随时间变化的关系,
若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度??? B.加大X的投入量
C.使用催化剂??? D.缩小体积
【答案】C
【解析】升高温度,X的转化率降低,A不可取;加大X的投入量,则X的转化率降低,B不可取;使用催化剂可以提高反应速率,但平衡不移动,X的转化率不变,C措施可取;缩小体积,平衡向正反应方向移动,X的转化率提高,D措施不可取。
【巩固练习】
一、选择题
1.在2 L的密闭容器中,发生以下反应:2A(g)+B(g)2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 mol B.3.2 mol
C.2.8 mol D.1.2 mol
2.(2019 陕西西安期中)在密闭容器中,一定量的混合气体发生反应:xA (g)+yB (g)C (g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
A.x+y<z B.平衡向正反应方向移动 C.B的转化率降低 D.C的体积分数增大
3.下列关于化学反应限度的说法中正确的是( )
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
4.在下列反应中:A2(g)+B2(g)2AB(g) ΔH<0当其达到平衡时,在下图所示的曲线中,符合勒夏特列原理的是( )
A.①② B.③④
C.① D.①⑤
5.在某温度下,可逆反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
A.K越大,达到平衡时,反应进行的程度越大
B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度的改变而改变
D.K随温度和压强的改变而改变
6.在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )
测定时刻/s
t1
t2
t3
t4
c(A)/(mol·L-1)
6
3
2
2
c(B)/(mol·L-1)
5
3.5
3
3
c(C)/(mol·L-1)
1
2.5
3
3
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为2A+B2C
D.在t2~t3内A的平均反应速率为[1/(t3-t2)]mol·L-1·s-1
7.在10L恒容密闭容器中充入X(g)和Y(g),发生反应:X(g)+Y(g)?M(g)+N(g),所得实验数据如表:
实验
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是( )
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10﹣2mol/(L?min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
8.COCl2(g)CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥
C.②③⑥ D.③⑤⑥
9.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是( )
A.0.16 B.0.08
C.0.04 D.0.02
10.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A(g)+3B(g) 2C(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中C气体的体积占10%,下列推断正确的是( )
①原混合气体的体积为1.2V L ②原混合气体的体积为1.1V L ③反应达平衡时气体A消耗掉0.05V L ④反应达平衡时气体B消耗掉0.05V L
A.②③ B.②④
C.①③ D.①④
11.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
容器编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
Ⅰ
387
0.20
0.080
0.080
Ⅱ
387
0.40
Ⅲ
207
0.20
0.090
0.090
下列说法正确的是( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
二、填空题
1.现有反应aA(g)+bB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比c(B)/c(C) 将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________。(填“变浅”“变深”或“不变”)
2.硝基苯甲酸乙酯在OH﹣存在下发生水解反应:
O2NC6H4COOC2H5+OH﹣?O2NC6H4COO﹣+C2H5OH
两种反应物的初始浓度均为0.050mol?L﹣1,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示.回答下列问题:
t/s
0
120
180
240
330
530
600
700
800
α/%
0
33.0
41.8
48.8
58.0
69.0
70.4
71.0
71.0
(1)列示计算该反应在120~180s与180~240s区间的平均反应速率 、 ;比较两者大小可得出的结论是 。
(2)列式计算15℃时该反应的平衡常数 。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有 (要求写出两条)。
3.(2019 北京丰台一模)诺贝尔化学奖获得者乔治·欧拉教授率领团队首次采用金属钌作催化剂,从空气中捕获CO2直接转化为甲醇,为通往未来“甲醇经济”迈出了重要一步,并依据该原理开发如图所示转化。
(1)CO2中含有的化学键类型是键 。
(2)将生成的甲醇(沸点为64.7℃)与水分离可采取的方法是 。
(3)上图所示转化中,由第1步至第4步的反应热(ΔH)依次是a kJ/mol、b kJ/mol、c kJ/mol、d kJ/mol,则该转化总反应的热化学方程式是 。
(4)500℃时,利用金属钌做催化剂,在固定容积的密闭容器中可直接实现如(3)中转化得到甲醇。测得该反应体系中X、Y浓度随时间变化如图。
①Y的化学式是 ,判断的理由是 。
②下列说法正确的是 (选填字母)。
a.Y的转化率是75%
b.其他条件不变时,若在恒压条件下进行该反应,Y的转化率高于75%
c.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应
d.金属钌可大大提高该反应中反应物的转化率
③从反应开始到平衡,用氢气表示的平均反应速率v(H2) = mol/(L·min)。
【参考答案与解析】
一、选择题
1.C
【解析】由题意可知在前10 s内,反应的A的物质的量为0.12 mol/(L·s)×10 s×2 L=2.4 mol,故反应的B的物质的量为1.2 mol,则10 s时,容器中B的物质的量为4 mol-1.2 mol=2.8 mol。
2.C
【解析】平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,如果平衡不移动,A的浓度是0.25 moL/L,而再达到平衡时测得A的浓度为0.30 mol/L,说明体积增大,化学平衡逆向移动。A项,减小压强,平衡向气体体积增大的方向移动,则x+y>z,错误;B项,由上述分析可知,平衡逆向移动,错误;C项,平衡逆向移动,B的转化率降低,正确;D项,平衡逆向移动,C的体积分数减小,错误。
3.B
【解析】化学反应限度即化学平衡。改变外界条件可以引起化学平衡的移动,即改变反应的限度,A错,B正确;对于反应前后气体体积不变的反应,如H2(g)+I2(g) 2HI(g),压强不随反应进行的程度而改变,C错;达到化学平衡时,反应物与生成物浓度不一定相等,D错。
4.D
【解析】由题意可知,该反应为气体分子数不变的放热反应,故升高温度,平衡逆向移动,φ(AB)降低,①曲线符合题意;加压,平衡不移动,故⑤曲线符合题意。
5.A
【解析】由平衡常数的定义可知,K越大,说明生成物浓度越大,反应物浓度越小,故说明反应进行的程度越大,K仅与温度有关,与反应物浓度及压强无关。
6.D
【解析】从表中数据可以看出,反应没有进行到底,所以这是一个可逆反应,反应方程式为2A+BC,t3时刻达到了平衡而不是反应终止,所以A、C错误;达到平衡时,A转化了2/3而B转化了2/5,所以B选项也不正确。
7.C
【解析】A.v(N)=v(M)===1.0×10﹣3mol/(L?min),故A错误;
实验②中,该反应的平衡常数K===1.0,故B错误;
该反应的平衡常数K===1.0,解得a=0.12,实验③中,X的转化率=100%=60%,故C正确;
D.对比实验①②可知,反应X(g)+Y(g)?M(g)+N(g)正反应为放热反应,升温平衡左移,平衡常数减小,转化率减小,实验③X的转化率为60%,则实验④中X的转化率小于60%,达到平衡时,b<0.060,故D错误;
故选C。
8.B
【解析】本题考查化学平衡的移动。该反应为体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。恒压通入惰性气体,相当于减压。恒容通入惰性气体与加催化剂均对平衡无影响。增加CO的浓度,将导致平衡逆向移动。
9.C
【解析】温度不变时K相等。
第一次平衡各物质浓度变化如下(单位:mol·L-1):
第二次平衡各物质浓度变化如下:(单位:mol/L)
则有:,x=0.16。
平衡时H2的浓度为0.04 mol/L。
10.A
【解析】设达平衡时消耗A的体积为x,消耗B的体积为y,混合气体体积缩小ΔV为z。
A+3B2C ΔV
解得:x=0.05V L,y=0.15V L,z=0.1V L,则原混合气体的体积为:V L+0.1V L=1.1V L,②③正确。
11.AD
【解析】A.平衡时c(CH3OCH3)=c(H2O)==0.080mol/L,(CH3OH)== 0.04mol/L,容器I中化学平衡常数K1==4,容器Ⅲ中平衡时c(CH3OCH3)=c(H2O)= =0.090mol/L,c(CH3OH)==0.02mol/L,化学平衡常数K3==20.25>4,所以降低温度,化学平衡常数增大,反应向正反应方向移动,则正反应是放热反应,故A正确;
B.该反应是反应前后气体体积不变的反应,温度相同,化学平衡常数相同,反应物的转化率相同,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,故B错误;
C.相同条件下,温度越高,反应速率越大,所以容器I中的反应速率大于容器Ⅲ,则容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短,故C错误;
D.c(CH3OH)=0.15mol/L、c(CH3OCH3 )=0.15mol/L、c(H2O)=0.10mol/L,浓度商==0.67<4,平衡向正反应方向移动,故D正确;
故选AD。
二、填空题
1. (1)放 > (2)增大 减小 (3)增大 减小 (4)减小 (5)不变 (6)变深 变浅
【解析】升高温度,B的转化率变大,说明此反应的正反应为吸热反应;减小压强,混合体系中C的质量分数变小,说明减小压强时平衡向逆反应方向移动,则a+b>p;催化剂对化学平衡无影响;若B为有色物质,体积不变时加入C,平衡向逆反应方向移动,生成更多的B而使混合物的颜色加深;如维持容器内压强不变,充入氖气可使容器体积增大,虽然平衡向逆反应方向移动,B的物质的量增加,但B的浓度比原平衡时小,因而混合物的颜色变浅。
2.(1)7.3×10﹣5mol/L;5.8×10﹣5mol/L;随着反应进行,反应物浓度降低,反应速率减慢;
(2);
(3)增加OH﹣的浓度;移去产物。
【解析】(1)120~180s内的平均速率为v==7.3×10﹣5mol/L,180~240s区间的平均反应速率为v==5.8×10﹣5mol/L。反应速率逐渐减小,原因是随着反应进行,反应物浓度降低,反应速率减慢;
(2)700s时,转化率不再发生改变,可说明达到平衡状态,此时得O2NC6H4COOC2H5的转化率为71.0%,则c(O2NC6H4COO﹣)=c(C2H5OH)=0.05mol/L×71.0%,
c(O2NC6H4COOC2H5)=0.05mol/L×(1﹣71.0%),
所以K==6.0;
(3)为提高O2NC6H4COOC2H5的平衡转化率,可使平衡向正向移动,可增加OH﹣的浓度、移去产物。
3.(1)极性共价键(2)蒸馏
(3)CO2(g) + 3H2(g) CH3OH(l) + H2O(l) ΔH=(a+b+c+d) kJ/mol
(4)①CO2 Y随反应进行浓度减小,因此Y为反应物,且其相同时间内转化量与X相同,则其在方程式中的化学计量数应与X相同,因此Y是CO2
② abc
③0. 225 mol/(L·min)
【解析】(1)CO2中含有极性共价键;
(2)甲醇(沸点为64.7℃)与水的沸点不同,所以用蒸馏的方法分离;
(3)根据盖斯定律,可知反应热的大小与起态和始态有关与过程无关,所以该转化总反应的热化学方程式是CO2 (g)+3H2 (g)CH3OH (l)+H2O (l) ΔH=(a+b+c+d) kJ/mol;
(4)①由图可知X的量在增加,Y的量再减少,而且变化量相同,所以Y是反应物,而且计量数与生成物的计量数相同,所以Y是CO2;Y随反应进行浓度减小,因此Y为反应,且其相同时间内转化量与X相同,则其在方程式中的化学计量数应与X相同,因此Y是CO2;
②a.Y的转化率是×100%=75%;
b.因为正反应是气体体积减少的反应,所以其他条件不变时,若在恒压条件下进行该反应,相当于增大压强,Y的转化率变大;
c.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应;
d.催化剂只改变反应的速率,但平衡不移动。
③v(CO2)==0.075mol/(L(min),而v(H2)= v(CO2)=0.225 mol/(L(min)。
【学习目标】
1、了解化学反应速率及其影响因素;
2、掌握化学平衡的建立及其影响因素,能用化学平衡常数进行定量分析;
3、初步了解化学反应方向的判断依据。
【知识网络】
【要点梳理】
要点一、化学反应速率
1.化学反应速率的概念及表示方法
(1)概念:通常用单位时间里反应物浓度的减少或生成物浓度的增加来表示.
(2)表达式:
(3)单位:mol·L-1·min-1或mol·L-1·s-1等.
(4)注意点:
①化学反应速率均取正值.
②化学反应速率一般不用固体物质表示.
③同一反应,选用不同物质的浓度变化表示反应速率,数值可能不同,但意义相同,各物质表示的速率之比等于该反应方程式中的化学计量数之比.
④注意区别平均速率和即时速率.
2.影响化学反应速率的因素
(1)内因:反应物的结构、性质.
(2)外因:①浓度:增大反应物的浓度,反应速率增大.
②温度:升高温度,反应速率增大.
③压强:对于有气体参加的反应,增大压强,气体物质的浓度增大,反应速率增大.
④催化剂:使用催化剂,反应速率增大.
要点二、化学平衡
(1)可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应.
(2)化学平衡的概念:是指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态.
(3)化学平衡的特征:
①逆:可逆反应
②等:v(正)=v(逆)
③动:动态平衡v(正)=v(逆)≠0
④定:平衡状态时反应混合物中各组分的浓度保持不变
⑤变:当浓度、温度、压强等条件改变时,化学平衡即发生移动
要点三、化学平衡的移动及影响因素
1.化学平衡的移动
(1)定义:可逆反应中旧化学平衡的破坏,新化学平衡的建立过程叫做化学平衡的移动.
(2)化学平衡移动的本质原因是v(正)≠v(逆).如催化剂能同等程度改变v(正)和v(逆),所以,加入催化剂,化学平衡不发生移动.
2.影响化学平衡的条件
条件的变化
平衡移动的方向
平衡移动的结果(均与改变条件时比较)
①浓度
向正反应方向移动
向逆反应方向移动
②压强
(气体)
增大
减小
向缩小气体体积方向移动
向增大气体体积方向移动
使气体压强减小
使气体压强增大
③温度
升高
降低
向吸热方向移动
向放热方向移动
使温度降低
使温度升高
3.化学平衡移动原理(即勒夏特列原理)
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.
要点四、化学平衡常数与转化率
1、化学平衡常数:?
对于一般的可逆反应:mA+nBpC+qD。其中m、n、p、q分别表示化学方程式中反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数可以表示为:
?
在一定温度下,可逆反应达到化学平衡时,生成物的浓度、反应物的浓度的关系依上述规律,其常数(用K表示)叫该反应的化学平衡常数
2、化学平衡常数的意义
①平衡常数的大小不随反应物或生成物浓度的改变而改变,只随温度的改变而改变。
②可以推断反应进行的程度。
K的意义:K很大,反应进行的程度很大,转化率大;K居中,典型的可逆反应,改变条件反应的方向变化;K 很小,反应进行的程度小,转化率小。
3、转化率:
可逆反应到达平衡时,某反应物的转化浓度(等于某反应物的起始浓度和平衡浓度的差)与该反应物的起始浓度比值的百分比。可用于表示可逆反应进行的程度。
要点五、化学反应进行的方向 ?
1、焓变和熵变的不同:
焓变(△H)指的是内能的变化值,常以热的形式表现出来。
熵变(△S)指的是体系的混乱程度。 S(g)>S(l)>S(s)
2、自发反应与否的判断依据
△H-T△S<0 正反应自发进行
△H-T△S>0 逆反应自发进行
【典型例题】
类型一、化学反应速率的概念及简单计算
例1 一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X (g)+Y (g)Z (g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
【思路点拨】解题时注意,题干中给出的是生成物的物质的量的变化,在分析选项时需要转化成反应物的浓度变化。
【答案】A
【解析】根据题意可以列出:
所以,故A选项正确;将容器的体积变为20 L的瞬间各物质的浓度均减半,根据平衡移动原理,此平衡应向逆反应方向移动,所以Z的平衡浓度比原来的要小,故B选项错误;由于此反应的正反应是气体体积缩小的反应,因此增大压强此平衡向右移动,反应物X和Y的转化率均增大,故C选项错误;X的体积分数增大,说明平衡向逆反应方向移动,而升高温度平衡应向吸热反应方向移动,因此此反应的正反应应为放热反应,即ΔH<0,所以D选项错误。
【总结升华】本题的易错点有:忽略化学反应速率为单位时间内物质浓度的变化而错选其他选项;对平衡移动原理(勒夏特列原理)理解片面而错选B或D。
举一反三:
【变式1】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
A.2.5mol·L-1·min-1和2.0mol·L-1
B.2.5mol·L-1·min-1和2.5mol·L-1
C.3.0mol·L-1·min-1和3.0mol·L-1
D.5.0mol·L-1·min-1和3.0mol·L-1
【答案】B
【解析】在4~8 min内反应物的浓度改变量为10mol·L-1,故4~8 min内的平均反应速率为2.5mol·L-1·min-1;图中从0 min开始到8 min反应物的浓度降低到原来的,根据这一幅度,可以推测从第8 min到第16 min,反应物的浓度降低到2.5mol·L-1。
类型二、化学反应速率的影响因素
例2(2019 晋江模拟)下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是( )
试管
温度
过氧化氢溶液浓度
催化剂
A
常温
3%
--
B
水浴加热
3%
--
C
水浴加热
6%
MnO2
D
常温
6%
--
【思路点拨】利用了控制变量法探究影响过氧化氢分解快慢的因素,根据浓度、催化剂和温度对反应速率的影响来分析。
【答案】C
【解析】使用合适的催化剂,改变反应历程,加快反应;升高温度,活化分子百分数增加,有效碰撞增多,加快反应;增大浓度,增加单位体积内的活化分子数,反应加快,显然只有C中温度高,浓度大、使用催化剂,则C中反应速率最快。故选C。
【总结升华】决定化学反应速率的根本原因是反应物本身的性质,而浓度、温度、压强、催化剂是外界影响因素。
举一反三:
【变式1】2SO2 (g)+O2 (g)2SO3 (g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5,不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3 (g)生成的平均速率为
【答案】D
【解析】催化剂可以同等程度的改变正、逆反应速率,A错;增大反应体系压强的方法有许多种,当向反应体系中充入无关气体时,压强增大,但反应速率不变,B错;降低温度将减小反应速率,达到平衡的时间增长,C错;反应速率就是用某一时间段内浓度的变化值除以反应时间来计算的,D对。
类型三、化学平衡状态的判断
例3 (1)下列方法中可以证明2 HI (g)H2 (g)+I2 (g)已达平衡状态的是________(填序号)。
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③(HI)=(I2)时
④反应速率时
⑤c (HI)∶c (H2)∶c (I2)=2∶1∶1时
⑥温度和体积一定时,某一生成物浓度不再变化时
⑦温度和体积一定时,容器内压强不再变化时
⑧条件一定,混合气体的平均相对分子质量不再变化时
⑨温度和体积一定时,混合气体的颜色不再变化时
⑩温度和压强一定时,混合气体的密度不再变化时
(2)在上述⑥~⑩的说法中能说明2NO2 (g)N2O4 (g)达到平衡状态的是________。
【思路点拨】解答时特别需要注意,反应(1)和反应(2)的不同之处,前者反应前后分子数不变;后者的正反应分子数减少。
【答案】(1)②⑥⑨ (2)⑥⑦⑧⑨⑩
【解析】由第(1)题反应的特征可知:此反应在反应前后气体的体积不发生变化,即在反应的任何一个阶段,容器内压强不发生改变。气体的总质量不变、总物质的量不变,因此混合气体的密度、平均相对分子质量均不发生改变。
由第(2)题反应的特征可知:反应前后气体体积发生改变,因此若平衡发生移动则混合气体的平均相对分子质量、混合气体密度都发生改变,当反应处于平衡状态时,这些都不再改变,此时c (NO2)恒定,混合气体的颜色不再变化。
【总结升华】判断化学平衡状态时要抓住“v (正)=v (逆)”和“各物质的百分含量不变”这两个核心判据。
举一反三:
【变式1】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3 (g)+NO (g)+NO2 (g)2N2 (g)+3H2O (g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
【答案】C
【解析】该反应是气体体积增大的放热反应。A项升高温度,平衡逆向移动,平衡常数减小,不正确;B项增大NH3的浓度,平衡向右移动,使氮氧化物的转化率增大,不正确;C项NO、N2的消耗分别代表正向、逆向的反应速率,速率的比值等于方程式中的化学计量数的比值,说明正、逆反应速率相等,故C正确;催化剂不影响化学平衡,D不正确。
类型四、根据化学平衡移动方向进行有关判断
例4 可逆反应:3A (g)3B (?)+C (?) ΔH>0,随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是( )
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C可能都是气体
【思路点拨】题目给出的化学方程式,正向为吸热反应,温度升高平衡正向移动。
【答案】CD
【解析】升温平衡正向移动,气体平均相对分子质量减小,有两种可能:①气体质量不变,气体物质的量增加,此时B与C均为气体。②气体质量减小,气体物质的量不变,此时B为气体,C为固体(或液体)。
【总结升华】气体平均相对分子质量为总质量与总物质的量的比值。其数值的减小,可能由两种情况引起:一是气体总质量减小,一是气体总物质的量减小。分析本题时,这两种情况都应该考虑。
例5 1和2分别为A在两个恒容容器中的平衡体系A (g)2B (g)和2A (g)B (g)的转化率,在温度不变的情况下,两反应器均增加A的物质的量,下列判断正确的是( )
A.1、2均减小 B.1、2均增大
C.1减小, 2增大 D.1增大,2减小
【答案】C
【解析】上述两个反应中反应物和生成物都只有一种,不管增加反应物还是生成物的量,都相当于增大压强。根据平衡移动的原理,A (g)2B (g)平衡将逆向移动,1减小,2A (g)B (g)平衡将正向移动,2增大。则选项C符合题意。
举一反三:
【变式1】在一定温度下,反应H2 (g)+X2 (g)HX (g)的平衡常数为10。若将1.0 mol的HX (g)通入体积为1.0 L的密闭容器中,在该温度时HX (g)的最大分解率接近于( )
A.5% B.17% C.25% D.33%
【答案】B
【解析】
,解得x=0.0833
所以。
【变式2】硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2==H2SO4+2HI
Ⅱ 2HIH2+I2
Ⅲ 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI (g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v (HI)=________。该温度下,H2 (g)+I2 (g)2HI (g)的平衡常数K=______。
相同温度下,若开始加入HI (g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2 (g)+O2 (g)==2H2O (1) ΔH=-572 kJ·mol-1 某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
【答案】(1)c (2)0.1 mol·L-1·min-1 64 b (3)向右 b (4)80%
【解析】本题主要考查了化学反应速率、化学平衡、水的电离平衡和化学计算。
(1)a项,反应Ⅲ在常温下不能进行;b项,SO2的还原性比HI强;C项,根据盖斯定律Ⅰ×2+Ⅱ×2+Ⅲ得总反应:2H2O==2H2+O2,循环过程中消耗了H2O;d项,根据总反应知产生1 mol O2的同时产生2 mol H2。
(2)由题干数据分析该反应:
0~2 min内平均反应速率
平衡常数。
第三问,若开始加入HI的物质的量是原来的2倍,相当于先将Ⅲ加入到2 L的容器(达到的平衡状态与原平衡一致,即HI的浓度、H2的体积分数与原平衡相同),再将体积压缩至1 L,因为该反应为体积不变的反应,加压平衡不移动,所以HI浓度为原来的2倍,H2的体积分数不变;温度不变,平衡常数不变;加入HI的物质的量增大,反应物浓度增大,反应速率加快,达到平衡的时间缩短。
(3)Zn与稀H2SO4反应,c (H+)减小,水的电离平衡向右移动;若向原溶液加入NaNO3,Zn与H+、NO3-反应不生成H2;若加CuSO4,Zn+CuSO4==ZnSO4+Cu,Zn与Cu构成原电池,加快反应速率;若加Na2SO4对反应速率没有影响;若加NaHSO3,HSO3-消耗H+生成H2O和SO2,减缓反应速率。
(4)生成1 mol液态水,理论上放热,则该电池的能量转化率为:。
类型五、化学平衡图像分析
例6某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )。 A.反应Ⅰ△H>0,P2>P1 B.反应Ⅱ△H<0,T1>T2 C.反应Ⅲ△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ△H<0,T2>T1
【思路点拨】当题目中涉及多个变量时,应先固定其中的几个变量,只分析其余的一个变量,即固定变量法,这样分析影响因素时才比较简单、确切。另外,分析图像时需要注意其纵、横坐标所代表的物理量。
【答案】BC
【解析】A.反应Ⅰ的特点是正反应方向为气体体积减小的方向,结合图象,压强增大A的转化率应增大,所以P2>P1,它随温度的升高A的转化率降低,所以正反应为放热反应△H<0,故A错误;
B.关于反应Ⅱ由图象可以看出T1条件下达到平衡所用的时间少,所以T1>T2,而在T1条件下达平衡时n(C)小,所以说明低温有利于C的生成,故它主要的正反应为放热反应△H<0,B正确;
C.关于反应Ⅲ,由图象可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应为吸热反应△H>0,而当T2<T1时正反应为放热反应△H<0,故C正确;
D.关于反应Ⅳ,由图象可以看出T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向进行,因此正反应为吸热反应△H>0,故D错误。
故选BC。
【总结升华】平衡图像题可采用如下解题模式:
(1)先分析题中反应的特点(是放热反应还是吸热反应,是气体体积增大的反应还是气体体积缩小的反应等)。一定要抓住图像中条件改变瞬间所引起的浓度、压强、速率的变化,然后针对各种条件改变时引起的变化的特征进行对照分析。
(2)再分析图像所表达的各个量之间的关系(两个坐标轴各表示什么物理量,曲线的变化趋势如何,是单一曲线还是多条曲线,曲线上的关键点,如起点、拐点、交点、终点的含义是什么等)。
举一反三:
【变式1】图中曲线a表示放热反应X(g)+Y(g)Z(g)+N(s)进行过程中X的转化率随时间变化的关系,
若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度??? B.加大X的投入量
C.使用催化剂??? D.缩小体积
【答案】C
【解析】升高温度,X的转化率降低,A不可取;加大X的投入量,则X的转化率降低,B不可取;使用催化剂可以提高反应速率,但平衡不移动,X的转化率不变,C措施可取;缩小体积,平衡向正反应方向移动,X的转化率提高,D措施不可取。
【巩固练习】
一、选择题
1.在2 L的密闭容器中,发生以下反应:2A(g)+B(g)2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 mol B.3.2 mol
C.2.8 mol D.1.2 mol
2.(2019 陕西西安期中)在密闭容器中,一定量的混合气体发生反应:xA (g)+yB (g)C (g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
A.x+y<z B.平衡向正反应方向移动 C.B的转化率降低 D.C的体积分数增大
3.下列关于化学反应限度的说法中正确的是( )
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
4.在下列反应中:A2(g)+B2(g)2AB(g) ΔH<0当其达到平衡时,在下图所示的曲线中,符合勒夏特列原理的是( )
A.①② B.③④
C.① D.①⑤
5.在某温度下,可逆反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
A.K越大,达到平衡时,反应进行的程度越大
B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度的改变而改变
D.K随温度和压强的改变而改变
6.在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )
测定时刻/s
t1
t2
t3
t4
c(A)/(mol·L-1)
6
3
2
2
c(B)/(mol·L-1)
5
3.5
3
3
c(C)/(mol·L-1)
1
2.5
3
3
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为2A+B2C
D.在t2~t3内A的平均反应速率为[1/(t3-t2)]mol·L-1·s-1
7.在10L恒容密闭容器中充入X(g)和Y(g),发生反应:X(g)+Y(g)?M(g)+N(g),所得实验数据如表:
实验
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是( )
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10﹣2mol/(L?min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
8.COCl2(g)CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥
C.②③⑥ D.③⑤⑥
9.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是( )
A.0.16 B.0.08
C.0.04 D.0.02
10.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A(g)+3B(g) 2C(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中C气体的体积占10%,下列推断正确的是( )
①原混合气体的体积为1.2V L ②原混合气体的体积为1.1V L ③反应达平衡时气体A消耗掉0.05V L ④反应达平衡时气体B消耗掉0.05V L
A.②③ B.②④
C.①③ D.①④
11.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
容器编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
Ⅰ
387
0.20
0.080
0.080
Ⅱ
387
0.40
Ⅲ
207
0.20
0.090
0.090
下列说法正确的是( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
二、填空题
1.现有反应aA(g)+bB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比c(B)/c(C) 将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________。(填“变浅”“变深”或“不变”)
2.硝基苯甲酸乙酯在OH﹣存在下发生水解反应:
O2NC6H4COOC2H5+OH﹣?O2NC6H4COO﹣+C2H5OH
两种反应物的初始浓度均为0.050mol?L﹣1,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示.回答下列问题:
t/s
0
120
180
240
330
530
600
700
800
α/%
0
33.0
41.8
48.8
58.0
69.0
70.4
71.0
71.0
(1)列示计算该反应在120~180s与180~240s区间的平均反应速率 、 ;比较两者大小可得出的结论是 。
(2)列式计算15℃时该反应的平衡常数 。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有 (要求写出两条)。
3.(2019 北京丰台一模)诺贝尔化学奖获得者乔治·欧拉教授率领团队首次采用金属钌作催化剂,从空气中捕获CO2直接转化为甲醇,为通往未来“甲醇经济”迈出了重要一步,并依据该原理开发如图所示转化。
(1)CO2中含有的化学键类型是键 。
(2)将生成的甲醇(沸点为64.7℃)与水分离可采取的方法是 。
(3)上图所示转化中,由第1步至第4步的反应热(ΔH)依次是a kJ/mol、b kJ/mol、c kJ/mol、d kJ/mol,则该转化总反应的热化学方程式是 。
(4)500℃时,利用金属钌做催化剂,在固定容积的密闭容器中可直接实现如(3)中转化得到甲醇。测得该反应体系中X、Y浓度随时间变化如图。
①Y的化学式是 ,判断的理由是 。
②下列说法正确的是 (选填字母)。
a.Y的转化率是75%
b.其他条件不变时,若在恒压条件下进行该反应,Y的转化率高于75%
c.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应
d.金属钌可大大提高该反应中反应物的转化率
③从反应开始到平衡,用氢气表示的平均反应速率v(H2) = mol/(L·min)。
【参考答案与解析】
一、选择题
1.C
【解析】由题意可知在前10 s内,反应的A的物质的量为0.12 mol/(L·s)×10 s×2 L=2.4 mol,故反应的B的物质的量为1.2 mol,则10 s时,容器中B的物质的量为4 mol-1.2 mol=2.8 mol。
2.C
【解析】平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,如果平衡不移动,A的浓度是0.25 moL/L,而再达到平衡时测得A的浓度为0.30 mol/L,说明体积增大,化学平衡逆向移动。A项,减小压强,平衡向气体体积增大的方向移动,则x+y>z,错误;B项,由上述分析可知,平衡逆向移动,错误;C项,平衡逆向移动,B的转化率降低,正确;D项,平衡逆向移动,C的体积分数减小,错误。
3.B
【解析】化学反应限度即化学平衡。改变外界条件可以引起化学平衡的移动,即改变反应的限度,A错,B正确;对于反应前后气体体积不变的反应,如H2(g)+I2(g) 2HI(g),压强不随反应进行的程度而改变,C错;达到化学平衡时,反应物与生成物浓度不一定相等,D错。
4.D
【解析】由题意可知,该反应为气体分子数不变的放热反应,故升高温度,平衡逆向移动,φ(AB)降低,①曲线符合题意;加压,平衡不移动,故⑤曲线符合题意。
5.A
【解析】由平衡常数的定义可知,K越大,说明生成物浓度越大,反应物浓度越小,故说明反应进行的程度越大,K仅与温度有关,与反应物浓度及压强无关。
6.D
【解析】从表中数据可以看出,反应没有进行到底,所以这是一个可逆反应,反应方程式为2A+BC,t3时刻达到了平衡而不是反应终止,所以A、C错误;达到平衡时,A转化了2/3而B转化了2/5,所以B选项也不正确。
7.C
【解析】A.v(N)=v(M)===1.0×10﹣3mol/(L?min),故A错误;
实验②中,该反应的平衡常数K===1.0,故B错误;
该反应的平衡常数K===1.0,解得a=0.12,实验③中,X的转化率=100%=60%,故C正确;
D.对比实验①②可知,反应X(g)+Y(g)?M(g)+N(g)正反应为放热反应,升温平衡左移,平衡常数减小,转化率减小,实验③X的转化率为60%,则实验④中X的转化率小于60%,达到平衡时,b<0.060,故D错误;
故选C。
8.B
【解析】本题考查化学平衡的移动。该反应为体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。恒压通入惰性气体,相当于减压。恒容通入惰性气体与加催化剂均对平衡无影响。增加CO的浓度,将导致平衡逆向移动。
9.C
【解析】温度不变时K相等。
第一次平衡各物质浓度变化如下(单位:mol·L-1):
第二次平衡各物质浓度变化如下:(单位:mol/L)
则有:,x=0.16。
平衡时H2的浓度为0.04 mol/L。
10.A
【解析】设达平衡时消耗A的体积为x,消耗B的体积为y,混合气体体积缩小ΔV为z。
A+3B2C ΔV
解得:x=0.05V L,y=0.15V L,z=0.1V L,则原混合气体的体积为:V L+0.1V L=1.1V L,②③正确。
11.AD
【解析】A.平衡时c(CH3OCH3)=c(H2O)==0.080mol/L,(CH3OH)== 0.04mol/L,容器I中化学平衡常数K1==4,容器Ⅲ中平衡时c(CH3OCH3)=c(H2O)= =0.090mol/L,c(CH3OH)==0.02mol/L,化学平衡常数K3==20.25>4,所以降低温度,化学平衡常数增大,反应向正反应方向移动,则正反应是放热反应,故A正确;
B.该反应是反应前后气体体积不变的反应,温度相同,化学平衡常数相同,反应物的转化率相同,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,故B错误;
C.相同条件下,温度越高,反应速率越大,所以容器I中的反应速率大于容器Ⅲ,则容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短,故C错误;
D.c(CH3OH)=0.15mol/L、c(CH3OCH3 )=0.15mol/L、c(H2O)=0.10mol/L,浓度商==0.67<4,平衡向正反应方向移动,故D正确;
故选AD。
二、填空题
1. (1)放 > (2)增大 减小 (3)增大 减小 (4)减小 (5)不变 (6)变深 变浅
【解析】升高温度,B的转化率变大,说明此反应的正反应为吸热反应;减小压强,混合体系中C的质量分数变小,说明减小压强时平衡向逆反应方向移动,则a+b>p;催化剂对化学平衡无影响;若B为有色物质,体积不变时加入C,平衡向逆反应方向移动,生成更多的B而使混合物的颜色加深;如维持容器内压强不变,充入氖气可使容器体积增大,虽然平衡向逆反应方向移动,B的物质的量增加,但B的浓度比原平衡时小,因而混合物的颜色变浅。
2.(1)7.3×10﹣5mol/L;5.8×10﹣5mol/L;随着反应进行,反应物浓度降低,反应速率减慢;
(2);
(3)增加OH﹣的浓度;移去产物。
【解析】(1)120~180s内的平均速率为v==7.3×10﹣5mol/L,180~240s区间的平均反应速率为v==5.8×10﹣5mol/L。反应速率逐渐减小,原因是随着反应进行,反应物浓度降低,反应速率减慢;
(2)700s时,转化率不再发生改变,可说明达到平衡状态,此时得O2NC6H4COOC2H5的转化率为71.0%,则c(O2NC6H4COO﹣)=c(C2H5OH)=0.05mol/L×71.0%,
c(O2NC6H4COOC2H5)=0.05mol/L×(1﹣71.0%),
所以K==6.0;
(3)为提高O2NC6H4COOC2H5的平衡转化率,可使平衡向正向移动,可增加OH﹣的浓度、移去产物。
3.(1)极性共价键(2)蒸馏
(3)CO2(g) + 3H2(g) CH3OH(l) + H2O(l) ΔH=(a+b+c+d) kJ/mol
(4)①CO2 Y随反应进行浓度减小,因此Y为反应物,且其相同时间内转化量与X相同,则其在方程式中的化学计量数应与X相同,因此Y是CO2
② abc
③0. 225 mol/(L·min)
【解析】(1)CO2中含有极性共价键;
(2)甲醇(沸点为64.7℃)与水的沸点不同,所以用蒸馏的方法分离;
(3)根据盖斯定律,可知反应热的大小与起态和始态有关与过程无关,所以该转化总反应的热化学方程式是CO2 (g)+3H2 (g)CH3OH (l)+H2O (l) ΔH=(a+b+c+d) kJ/mol;
(4)①由图可知X的量在增加,Y的量再减少,而且变化量相同,所以Y是反应物,而且计量数与生成物的计量数相同,所以Y是CO2;Y随反应进行浓度减小,因此Y为反应,且其相同时间内转化量与X相同,则其在方程式中的化学计量数应与X相同,因此Y是CO2;
②a.Y的转化率是×100%=75%;
b.因为正反应是气体体积减少的反应,所以其他条件不变时,若在恒压条件下进行该反应,相当于增大压强,Y的转化率变大;
c.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应;
d.催化剂只改变反应的速率,但平衡不移动。
③v(CO2)==0.075mol/(L(min),而v(H2)= v(CO2)=0.225 mol/(L(min)。
