人教版九年级下册 第八单元课题 2 金属的化学性质第1课时 金属的化学性质(18张PPT)
文档属性
| 名称 | 人教版九年级下册 第八单元课题 2 金属的化学性质第1课时 金属的化学性质(18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 12.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-06 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
金属的化学性质
第八
单元
第一课时
人教版九年级义务教育化学
西汉金兽
西汉长信宫灯(青铜)
东汉铁器
看一看,比一比
在现代考古中发现,出土的金器保存完好,铜器比铁器保存得好,而且年代比铁器早。你知道这是为什么吗?
知识回顾
活泼性:Mg>Fe
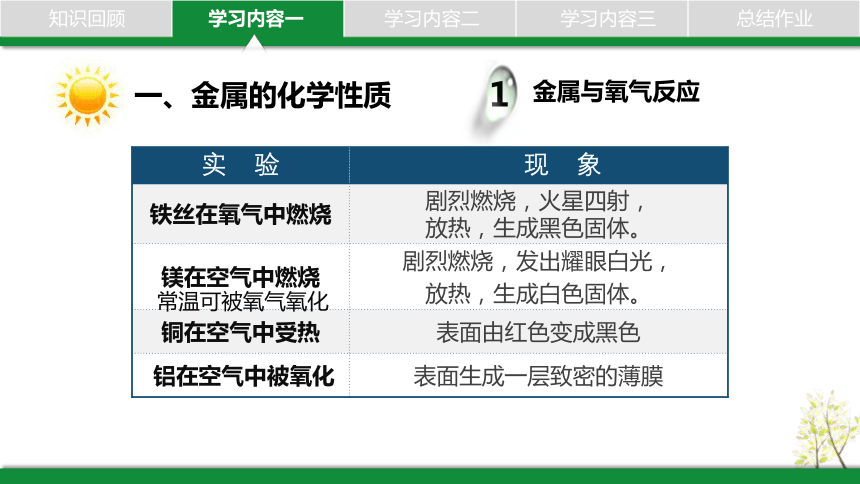
一、金属的化学性质
金属与氧气反应
1
实 验 现 象
铁丝在氧气中燃烧 剧烈燃烧,火星四射,
放热,生成黑色固体。
镁在空气中燃烧 剧烈燃烧,发出耀眼白光,
放热,生成白色固体。
铜在空气中受热 表面由红色变成黑色
铝在空气中被氧化 表面生成一层致密的薄膜
常温可被氧气氧化
镁、铝等在常温下就能与氧气反应;
铁、铜等在高温下能与氧气反应;
金即使在高温时也不与氧气反应。
镁、铝较活泼,铁、铜次之,金最不活泼。
比较一下不同金属和氧气反应条件有何不同?
归纳:不同的金属与氧气的反应条件 .
不同
金属与氧气反应
1
铝在空气中与氧气反应,表面生成一层致密的
氧化铝(Al2O3)薄膜,阻止铝进一步被氧化,因
此,铝具有很好的抗腐蚀性能。
思考:1、从上面的学习中知道铝比铁活泼,可是
通常看见铁生锈而没有看到铝生锈。这是为什么呢?
你发现了吗?
西汉金兽
西汉长信宫灯(青铜)
东汉铁器
铁>铜>金
活泼性顺序:
实验室制取氢气可用什么药品?反应的化学方程式?
Zn +H2SO4=ZnSO4 + H2↑
问题:(1)还有其他金属能与稀酸(稀盐酸或稀硫酸)反应放出氢气吗?
(2)反应剧烈程度有无差异呢?
探究实验:金属与盐酸、稀硫酸的反应
A.镁、锌、铁、铜分别跟稀盐酸反应
B.镁、锌、铁、铜分别跟稀硫酸反应
实验步骤:
1.取四支试管,分别加入Cu、Fe、Zn、Mg;
2.分别往试管中倾倒约五分之一体积的稀盐酸或稀硫酸;
3.观察有无气体产生及气体产生快慢,并且记录下来;
4.用手触摸试管外壁,感受反应是否放热。
金
属 现象 反应方程式
有无气泡?快慢程度 金属+稀盐酸
有无气泡?快慢程度 金属+稀硫酸
有气泡(快)
无变化
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
无
Mg+H2SO4= MgSO4+H2↑
无
Zn +H2SO4= ZnSO4+H2↑
Fe + H2SO4= FeSO4+H2↑
+2
氯化亚铁
+2
硫酸亚铁
有气泡(中)
有气泡(慢)
有气泡(快)
有气泡(中)
有气泡(慢)
无变化
镁
锌
铁
铜
镁
锌
铁
铜
1、 能与稀盐酸或稀硫酸反应,放出氢气,
而 却不能。
2、铁、镁、锌与稀盐酸或稀硫酸反应时剧烈程度不同。
____反应最剧烈,其次是____,然后是____。
镁
锌
铁
讨论交流:从你的探究中,你的发现或收获?
活动性:Mg > Zn > Fe > Cu
Mg、Zn、Fe
Cu
单质
化合物
化合物
单质
这种由一种单质与一种化合物反应,生成另一单质和另一种化合物的反应叫做置换反应。
我会观察
置换反应
对于以下反应,从反应物和生成物的类别角度分析,
这些反应有何特点
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
(2019年黄冈)下列化学反应属于置换反应的是( )
A.Zn+H2SO4===ZnSO4+H2↑
B.Ba(OH)2+H2SO4===BaSO4↓+2H2O
C.4Fe(OH)2+O2+2H2O === 4Fe(OH)3
D.2HgO===2Hg+O2↑
A
△
置换反应、化合反应、分解反应都属于基本反应类型。
交流和分享
这堂课我学会了……
作业
完成学案上《巩固与练习》1-6题。
金属的化学性质
第八
单元
谢谢同学们!再见
第一课时
金属的化学性质
第八
单元
第一课时
人教版九年级义务教育化学
西汉金兽
西汉长信宫灯(青铜)
东汉铁器
看一看,比一比
在现代考古中发现,出土的金器保存完好,铜器比铁器保存得好,而且年代比铁器早。你知道这是为什么吗?
知识回顾
活泼性:Mg>Fe
一、金属的化学性质
金属与氧气反应
1
实 验 现 象
铁丝在氧气中燃烧 剧烈燃烧,火星四射,
放热,生成黑色固体。
镁在空气中燃烧 剧烈燃烧,发出耀眼白光,
放热,生成白色固体。
铜在空气中受热 表面由红色变成黑色
铝在空气中被氧化 表面生成一层致密的薄膜
常温可被氧气氧化
镁、铝等在常温下就能与氧气反应;
铁、铜等在高温下能与氧气反应;
金即使在高温时也不与氧气反应。
镁、铝较活泼,铁、铜次之,金最不活泼。
比较一下不同金属和氧气反应条件有何不同?
归纳:不同的金属与氧气的反应条件 .
不同
金属与氧气反应
1
铝在空气中与氧气反应,表面生成一层致密的
氧化铝(Al2O3)薄膜,阻止铝进一步被氧化,因
此,铝具有很好的抗腐蚀性能。
思考:1、从上面的学习中知道铝比铁活泼,可是
通常看见铁生锈而没有看到铝生锈。这是为什么呢?
你发现了吗?
西汉金兽
西汉长信宫灯(青铜)
东汉铁器
铁>铜>金
活泼性顺序:
实验室制取氢气可用什么药品?反应的化学方程式?
Zn +H2SO4=ZnSO4 + H2↑
问题:(1)还有其他金属能与稀酸(稀盐酸或稀硫酸)反应放出氢气吗?
(2)反应剧烈程度有无差异呢?
探究实验:金属与盐酸、稀硫酸的反应
A.镁、锌、铁、铜分别跟稀盐酸反应
B.镁、锌、铁、铜分别跟稀硫酸反应
实验步骤:
1.取四支试管,分别加入Cu、Fe、Zn、Mg;
2.分别往试管中倾倒约五分之一体积的稀盐酸或稀硫酸;
3.观察有无气体产生及气体产生快慢,并且记录下来;
4.用手触摸试管外壁,感受反应是否放热。
金
属 现象 反应方程式
有无气泡?快慢程度 金属+稀盐酸
有无气泡?快慢程度 金属+稀硫酸
有气泡(快)
无变化
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
无
Mg+H2SO4= MgSO4+H2↑
无
Zn +H2SO4= ZnSO4+H2↑
Fe + H2SO4= FeSO4+H2↑
+2
氯化亚铁
+2
硫酸亚铁
有气泡(中)
有气泡(慢)
有气泡(快)
有气泡(中)
有气泡(慢)
无变化
镁
锌
铁
铜
镁
锌
铁
铜
1、 能与稀盐酸或稀硫酸反应,放出氢气,
而 却不能。
2、铁、镁、锌与稀盐酸或稀硫酸反应时剧烈程度不同。
____反应最剧烈,其次是____,然后是____。
镁
锌
铁
讨论交流:从你的探究中,你的发现或收获?
活动性:Mg > Zn > Fe > Cu
Mg、Zn、Fe
Cu
单质
化合物
化合物
单质
这种由一种单质与一种化合物反应,生成另一单质和另一种化合物的反应叫做置换反应。
我会观察
置换反应
对于以下反应,从反应物和生成物的类别角度分析,
这些反应有何特点
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
(2019年黄冈)下列化学反应属于置换反应的是( )
A.Zn+H2SO4===ZnSO4+H2↑
B.Ba(OH)2+H2SO4===BaSO4↓+2H2O
C.4Fe(OH)2+O2+2H2O === 4Fe(OH)3
D.2HgO===2Hg+O2↑
A
△
置换反应、化合反应、分解反应都属于基本反应类型。
交流和分享
这堂课我学会了……
作业
完成学案上《巩固与练习》1-6题。
金属的化学性质
第八
单元
谢谢同学们!再见
第一课时
同课章节目录
