2019新教材高中化学必修1第一章第一节物质的分类及转化第1课时17ppt
文档属性
| 名称 | 2019新教材高中化学必修1第一章第一节物质的分类及转化第1课时17ppt |  | |
| 格式 | zip | ||
| 文件大小 | 10.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-05 21:20:01 | ||
图片预览





文档简介
(共17张PPT)
第一节 物质的分类及转化
第1课时 物质的分类
1.认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类;
2.了解分散系的含义、分类;
3.通过实验探究胶体的制备和性质,认识胶体是一种常见的分散系掌握胶体的性质;
4.能从不同层次认识物质的多样性,并对物质进行分类.
一、根据物质的组成和性质分类
任何物质都是由元素组成的,根据元素组成对物质
进行分类是化学研究的基础。
每一种元素都可以形成单质。由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
如,金刚石、石墨和C60是碳元素的同素异形体;氧气和臭氧(O3)是氧元素的同素异形体。
绝大多数元素都能与其他元素形成化合物。不同的元素在形成化合物时,可以按照一定的规律,以不同的方式进行组合。一百多种元素组成了种类繁多的物质。
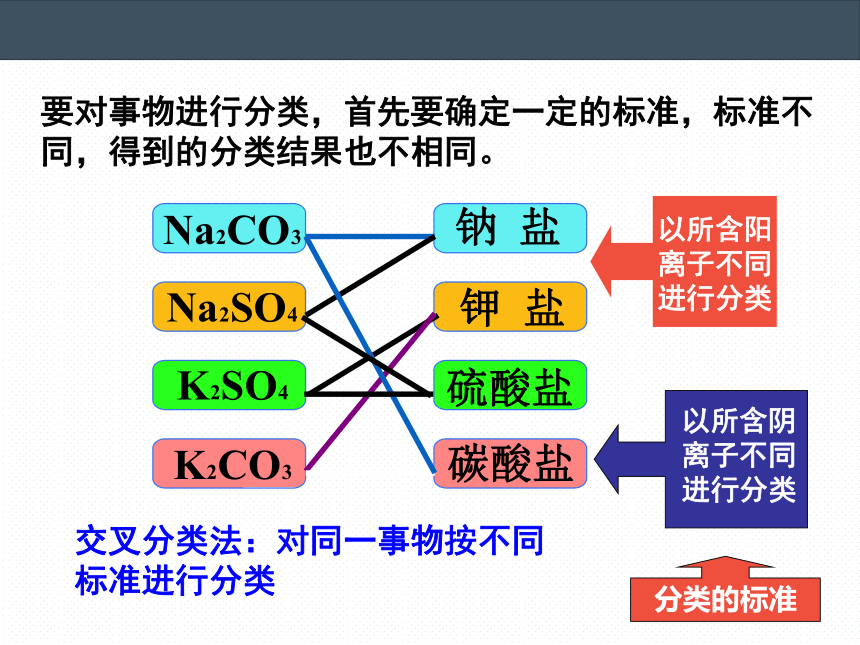
要对事物进行分类,首先要确定一定的标准,标准不同,得到的分类结果也不相同。
以所含阳离子不同进行分类
以所含阴离子不同进行分类
分类的标准
交叉分类法:对同一事物按不同标准进行分类
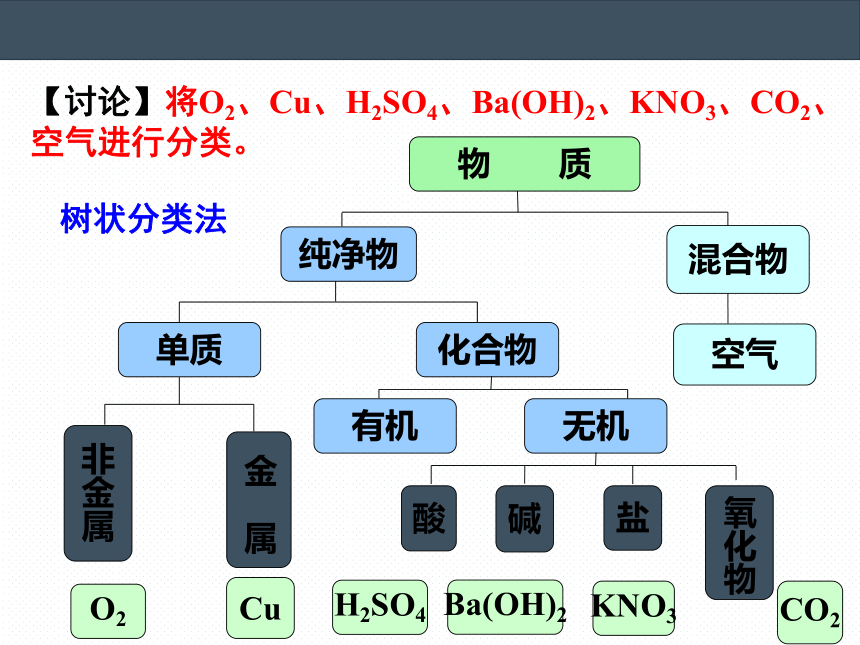
物 质
纯净物
混合物
空气
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
【讨论】将O2、Cu、H2SO4、Ba(OH)2、KNO3、CO2、空气进行分类。
有机
无机
O2
Cu
H2SO4
Ba(OH)2
KNO3
CO2
树状分类法
例:氧化物的分类
氧化物
从氧化物中元素种类
金属氧化物
如Na2O、Fe2O3、CaO
非金属氧化物
如CO2、SO2 、SO3
从是否与酸碱反应
酸性氧化物
碱性氧化物
如Na2O、Fe2O3、CaO
如CO2、SO2 、SO3
不成盐氧化物
如CO、NO
与酸反应生成盐和水
与碱反应生成盐和水
二、分散系及其分类
把一种(或多种)物质以粒子形式分散在另一种(或多种)物质中所形成的混合物。
1)分散质:
被分散成粒子的物质。
2)分散剂:
起容纳分散质作用的物质。
1、分散系:
举例
分散系
分散质
分散剂
CuSO4溶液
泥水
CuSO4晶体
泥沙
水
水
2、分散系分类
分散质
分散剂
气
液
固
气
液
固
(1)按聚集状态(气、液、固)来分,有9种类型
(2)按分散质微粒直径大小
0 1nm 100nm
溶液
胶体
浊液
分散质
粒子直径
(1nm = 10-9m)
分散系
胶体
浊液
溶液
悬浊液
乳浊液
分散系 溶液 浊液 胶体
分散质微粒直径
分散质微粒组成
外观特征 稳定性
能否透过滤纸
能否透过半透膜
【探究】不同分散系的比较
<1nm
>100nm
1nm~100nm
分子、离子
大量分子集合体
分子集合体
均一、透明
、稳定
不均一不稳定
均一、透明、介稳性
能
不能
能
【探究】如何实现胶体和溶液的分离?
渗析:
利用半透膜把胶体中混有的离子或分子从胶体
中分离出来。
原因:胶体微粒不能透过半透膜,溶液中分子和离子
能透过半透膜。
分散系 溶液 浊液 胶体
分散质微粒直径
分散质微粒组成
外观特征 稳定性
能否透过滤纸
能否透过半透膜
【探究】不同分散系的比较
<1nm
>100nm
1nm~100nm
分子、离子
大量分子集合体
分子集合体
均一、透明
、稳定
不均一不稳定
均一、透明、介稳性
能
不能
能
能
不能
不能
Fe(OH)3
AgI胶体
淀粉胶体
Fe(OH)3
AgI胶体
(2)胶体的分类
3、胶体
(1)概念:分散质粒子直径为1-100 nm的分散系
云烟雾
有色玻璃
常见的胶体:Fe(OH)3胶体、墨汁、淀粉胶体,牛奶、豆浆、血液、烟、云雾等。
①反应原理:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
==
②步骤:
沸水中滴入FeCl3饱和溶液
(4)胶体的性质
丁达尔效应:
(3)氢氧化铁胶体的制取
当可见光束通过胶体时,在入
射光侧面可观察到明亮的“通路”。
晨光穿过森林,梦幻般的光线
夜市中美丽的霓虹灯
THANK YOU
第一节 物质的分类及转化
第1课时 物质的分类
1.认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类;
2.了解分散系的含义、分类;
3.通过实验探究胶体的制备和性质,认识胶体是一种常见的分散系掌握胶体的性质;
4.能从不同层次认识物质的多样性,并对物质进行分类.
一、根据物质的组成和性质分类
任何物质都是由元素组成的,根据元素组成对物质
进行分类是化学研究的基础。
每一种元素都可以形成单质。由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
如,金刚石、石墨和C60是碳元素的同素异形体;氧气和臭氧(O3)是氧元素的同素异形体。
绝大多数元素都能与其他元素形成化合物。不同的元素在形成化合物时,可以按照一定的规律,以不同的方式进行组合。一百多种元素组成了种类繁多的物质。
要对事物进行分类,首先要确定一定的标准,标准不同,得到的分类结果也不相同。
以所含阳离子不同进行分类
以所含阴离子不同进行分类
分类的标准
交叉分类法:对同一事物按不同标准进行分类
物 质
纯净物
混合物
空气
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
【讨论】将O2、Cu、H2SO4、Ba(OH)2、KNO3、CO2、空气进行分类。
有机
无机
O2
Cu
H2SO4
Ba(OH)2
KNO3
CO2
树状分类法
例:氧化物的分类
氧化物
从氧化物中元素种类
金属氧化物
如Na2O、Fe2O3、CaO
非金属氧化物
如CO2、SO2 、SO3
从是否与酸碱反应
酸性氧化物
碱性氧化物
如Na2O、Fe2O3、CaO
如CO2、SO2 、SO3
不成盐氧化物
如CO、NO
与酸反应生成盐和水
与碱反应生成盐和水
二、分散系及其分类
把一种(或多种)物质以粒子形式分散在另一种(或多种)物质中所形成的混合物。
1)分散质:
被分散成粒子的物质。
2)分散剂:
起容纳分散质作用的物质。
1、分散系:
举例
分散系
分散质
分散剂
CuSO4溶液
泥水
CuSO4晶体
泥沙
水
水
2、分散系分类
分散质
分散剂
气
液
固
气
液
固
(1)按聚集状态(气、液、固)来分,有9种类型
(2)按分散质微粒直径大小
0 1nm 100nm
溶液
胶体
浊液
分散质
粒子直径
(1nm = 10-9m)
分散系
胶体
浊液
溶液
悬浊液
乳浊液
分散系 溶液 浊液 胶体
分散质微粒直径
分散质微粒组成
外观特征 稳定性
能否透过滤纸
能否透过半透膜
【探究】不同分散系的比较
<1nm
>100nm
1nm~100nm
分子、离子
大量分子集合体
分子集合体
均一、透明
、稳定
不均一不稳定
均一、透明、介稳性
能
不能
能
【探究】如何实现胶体和溶液的分离?
渗析:
利用半透膜把胶体中混有的离子或分子从胶体
中分离出来。
原因:胶体微粒不能透过半透膜,溶液中分子和离子
能透过半透膜。
分散系 溶液 浊液 胶体
分散质微粒直径
分散质微粒组成
外观特征 稳定性
能否透过滤纸
能否透过半透膜
【探究】不同分散系的比较
<1nm
>100nm
1nm~100nm
分子、离子
大量分子集合体
分子集合体
均一、透明
、稳定
不均一不稳定
均一、透明、介稳性
能
不能
能
能
不能
不能
Fe(OH)3
AgI胶体
淀粉胶体
Fe(OH)3
AgI胶体
(2)胶体的分类
3、胶体
(1)概念:分散质粒子直径为1-100 nm的分散系
云烟雾
有色玻璃
常见的胶体:Fe(OH)3胶体、墨汁、淀粉胶体,牛奶、豆浆、血液、烟、云雾等。
①反应原理:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
==
②步骤:
沸水中滴入FeCl3饱和溶液
(4)胶体的性质
丁达尔效应:
(3)氢氧化铁胶体的制取
当可见光束通过胶体时,在入
射光侧面可观察到明亮的“通路”。
晨光穿过森林,梦幻般的光线
夜市中美丽的霓虹灯
THANK YOU
