第2章 微项目 研究车用燃料及安全气囊——利用化学反应解决实际问题 课件(26张ppt)
文档属性
| 名称 | 第2章 微项目 研究车用燃料及安全气囊——利用化学反应解决实际问题 课件(26张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 425.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-06 11:47:31 | ||
图片预览








文档简介
课件26张PPT。微项目 研究车用燃料及安全气囊
——利用化学反应解决实际问题知识铺垫新知预习1.发动机的能量是燃料提供的,燃烧是放热过程。甲烷、汽油、乙醇等可燃物燃烧放热,可以作为汽车燃料。
2.铅蓄电池是可充电电池,充电时正极还原成二氧化铅,负极还原成纯铅。
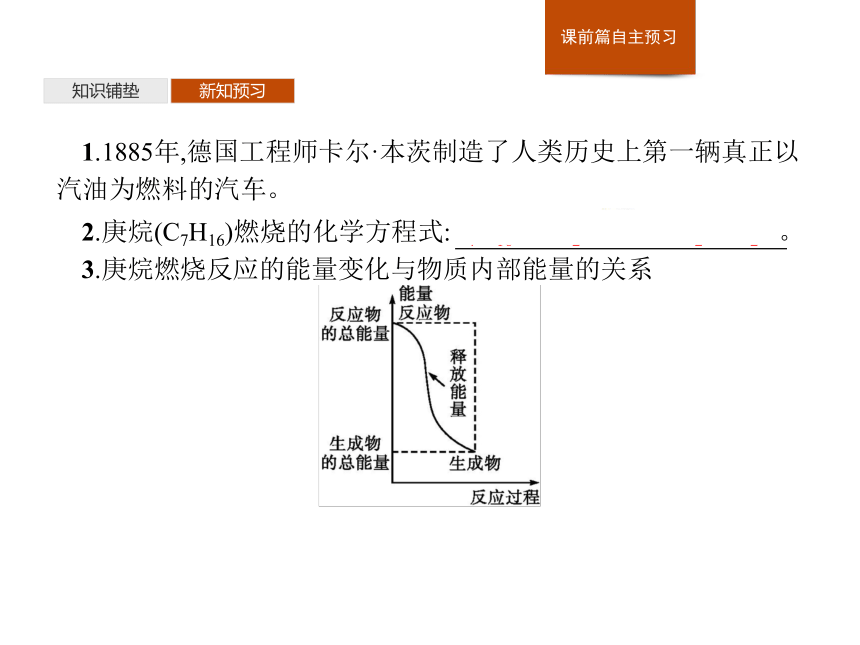
3.化学反应中既有物质变化又有能量变化。一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。知识铺垫新知预习1.1885年,德国工程师卡尔·本茨制造了人类历史上第一辆真正以汽油为燃料的汽车。2.庚烷(C7H16)燃烧的化学方程式:C7H16+11O2 7CO2+8H2O。
3.庚烷燃烧反应的能量变化与物质内部能量的关系知识铺垫新知预习4.为汽车选用安全气囊的气体发生剂时,要考虑所选物质的性质,还要关注所发生反应中的物质变化、能量变化和反应的化学反应速率。
5.NaN3常温下较稳定,受撞击时可迅速分解,产生氮气和金属钠,同时释放大量的热。
【微思考】汽车电瓶通常为铅蓄电池,放电时其能量转化形式是怎样的?写出电池总反应的化学方程式。每消耗1 mol硫酸转移电子的物质的量是多少?
提示:铅蓄电池是将化学能转化为电能,电池总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。每消耗1 mol硫酸转移1 mol电子。任务一任务二随堂检测 选择车用燃料
问题探究
1.如何根据燃料的能量变化选择车用燃料?
提示:达到燃料燃点需要的能量越低,反应物能量高于生成物能量越多的燃料越合适。
2.汽车尾气中有哪些有害成分?如何除去其中的氮氧化物?
提示:汽车尾气中的主要有害成分为碳氢化合物、氮氧化物、一氧化碳、二氧化碳、二氧化硫、硫化氢,以及微量的醛、酚、过氧化物等。使用催化转化器可将氮氧化物转化为氮气和氧气。任务一任务二随堂检测知识归纳
1.车用燃料
燃料通常指能够将自身存储的化学能通过化学反应(燃烧)转变为热能的物质。目前汽车所使用的燃料主要是汽油和柴油。而随着汽车保有量的逐年增加,汽车排放造成的环境污染问题以及石油资源逐渐匮乏的问题已不容忽视,因此各种代用燃料也得到了越来越广泛的应用。目前国内开发使用的发动机代用燃料包括天然气、液化石油气、甲醇、乙醇、生物质燃料、氢气以及二甲基醚等。
2.三元催化器,可将汽车尾气排出的CO、碳氢化物和NOx等有害气体通过氧化和还原作用转变为无害的二氧化碳、水和氮气。当高温的汽车尾气通过净化装置时,三元催化器中的净化剂将增强CO、碳氢化合物和NOx三种气体的活性,促使其进行一定的氧化还原化学反应,其中CO在高温下被氧化成为无色、无毒的二氧化碳气体,碳氢化物在高温下氧化成水和二氧化碳,NOx转化为氮气和氧气。三种有害气体都变成无害气体,汽车尾气得以净化。任务一任务二随堂检测典例剖析
例1下表为某汽车在不同速率时所产生的空气污染物质量(按汽车平均行驶1公里计算)。根据上表,下列说法不正确的是( )
A.汽车行驶时,污染物中CO含量最高
B.汽车速率为120 km·h-1时,污染最严重
C.从环保角度考虑,最合适的汽车速率为50 km·h-1
D.汽车速率增大时,产生的氮的氧化物也随之增多任务一任务二随堂检测答案:C
解析:根据表中信息可知汽车行驶时,污染物中CO含量最高,A项正确;汽车行驶速率为120 km·h-1时,三种污染物排放量都最多,污染最严重,B项正确;从环保角度考虑,最合适的汽车速率为80 km·h-1,C项错误;汽车行驶速率越大,产生的氮氧化物越多,D项正确。任务一任务二随堂检测变式训练1-1汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管安装“催化转化装置器”。它能使CO和NOx反应生成可参与大气生态环境循环的无毒气体,并使烃类充分燃烧,使SO2转化。下列说法正确的是( )
A.CO和NOx反应的化学方程式为2xCO+2NOx=2xCO2+N2
B.上述方法的缺点是导致空气中CO2的含量增大,从而大大提高空气的酸度
C.植树造林,增大绿化面积,可有效控制城市的各种污染源
D.汽车改用天然气或氢气作为燃料,不会减少对空气的污染
答案:A
解析:空气中CO2的含量增大,不会大大提高空气的酸度;植树造林,增大绿化面积,并不能有效控制城市的各种污染源;汽车改用天然气或氢气作为燃料,会减少对空气的污染。任务一任务二随堂检测变式训练1-2汽车尾气在光照下分解时,即开始光化学烟雾的循环,它的形成过程可用下列化学方程式表示:NO2=NO+O,2NO+O2=2NO2,O2+O=O3。下列有关叙述不正确的是( )
A.此过程中,NO2是催化剂
B.在此过程中,NO是中间产物
C.此过程的总方程式为2O3=3O2
D.光化学烟雾能引起人的外呼吸功能严重障碍
答案:C
解析:NO2在反应前后质量和化学性质均没发生变化,只是加快了O2变成O3的反应速率,因此NO2是O2变成O3的催化剂。将三个方程式相加得到的总反应方程式为3O2=2O3。任务一任务二随堂检测设计安全气囊
问题探究
汽车安全气囊中通常加入什么物质?气囊中产生的是什么气体?
提示:安全气囊中通常装入的是叠氮化钠(NaN3),受到剧烈撞击时迅速分解生成大量氮气,所以气囊中产生的是氮气。
知识归纳
1.安全气囊爆炸的化学反应原理
叠氮化钠、硝酸铵,经过猛烈撞击后,这些物质发生分解反应,产生大量的气体充满气囊,保护乘车人员的头部安全。2.目前使用的气体发生剂主要由叠氮化钠、三氧化二铁、硝酸铵等物质按一定比例混合而成。任务一任务二随堂检测典例剖析
例2氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。回答问题:
(1)Na3N的电子式为 ,该化合物由 键形成。?
(2)Na3N与盐酸反应生成 种盐,其电子式为 。?
(3)Na3N与水反应属于 反应。?
(4)比较Na3N中两种微粒的半径:r(Na+) r(N3-)(填“>”“<”或“=”)。?
(5)写出Na3N与水反应的化学方程式: 。?
(6)写出Na3N与盐酸反应的化学方程式: 。?任务一任务二随堂检测任务一任务二随堂检测 (2)氮化钠和水反应生成氨气,则根据原子守恒可判断,另外一种生成物应该是氢氧化钠,所以氮化钠和盐酸反应的生成物应该是氯化钠和氯化铵,共计是2种盐,氯化钠和氯化铵都是离子化合物,氯化(3)Na3N和水相互交换成分发生复分解反应生成NaOH和NH3。
(4)Na+与N3-属电子层结构相同的粒子,核电荷数越大半径越小,故Na+的核电荷数大而半径小,即r(Na+)(5)Na3N和水反应的化学方程式是Na3N+3H2O=3NaOH+NH3↑。
(6)Na3N与盐酸反应生成氯化钠和氯化铵,反应的化学方程式为Na3N+4HCl=3NaCl+NH4Cl。任务一任务二随堂检测变式训练2Na3N是离子化合物,它和水作用可产生NH3。下列叙述正确的是( )
A.Na+和N3-的电子层结构都与氖原子相同
B.Na+的半径大于N3-的半径
C.Na3N与足量的盐酸反应后生成一种盐
D.在Na3N与水的反应中,Na3N做还原剂
答案:A
解析:Na+和N3-核外电子数相同,电子层结构都与氖原子相同,故A正确;Na+的半径小于N3-的半径,故B错误;Na3N与盐酸发生反应Na3N+4HCl=3NaCl+NH4Cl,生成两种盐,故C错误;Na3N与水的反应中各元素化合价均不变,不属于氧化还原反应,故D错误。任务一任务二随堂检测1.近年来,我国许多城市禁止汽车使用含铅汽油的主要原因是( )
A.提高汽油燃烧效率
B.降低汽油成本
C.避免铅污染大气
D.铅资源短缺
答案:C
解析:为了防止震动,常在汽油中加入抗震剂,四乙基铅有很好的抗震作用,被广泛采用。后来发现加入的四乙基铅只有20%起了作用,其余80%随尾气排入大气,含铅化合物对人体有很大的危害,可通过呼吸或皮肤吸收进入人体,影响神经系统,造成意识障碍,引起幻听、幻视、抽搐、昏迷、直至死亡,尤其影响儿童智力发育,因此当前各国都采用其他抗震剂而不采用铅制剂。任务一任务二随堂检测2.氮和钠可形成离子化合物Na3N,它能与水剧烈反应产生NaOH和NH3。下列叙述正确的( )
A.Na3N中钠离子半径比氮离子半径小
B.Na3N含离子键和非极性键
C.Na3N属于共价化合物
D.Na3N中两元素都是ⅠA族元素
答案:A
解析:钠离子半径小于氮离子;Na3N中只含有离子键,属于离子化合物;Na是ⅠA族元素,N是ⅤA族元素。任务一任务二随堂检测3.汽车的发明与使用是人类智慧的杰出体现,它为人们的生活和生产带来了极大的方便,但同时由此引发的环境污染问题也越来越引起人们的关注,人们开始研究新的清洁燃料。
(1)新型环保出租车采用LPG+汽油的双燃料系统,其尾气中的有毒气体成分较普通车型下降80%左右,缓解了汽车尾气排放给城市环境造成的污染问题。下列物质中不属于有害气体的是 。?
A.CO2和H2
B.NO2和NO
C.CO和SO2
D.碳粒和含铅化合物任务一任务二随堂检测(2)为了减少大气污染,许多城市推广使用汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是 。?
A.碳水化合物
B.碳氢化合物
C.氢气
D.醇类
(3)我国推广使用乙醇汽油,它是在汽油中加入适量乙醇形成的混合燃料。下列叙述中正确的是 。?
A.使用乙醇汽油能减少有害气体的排放,是一种改善环境的清洁能源
B.燃料中的乙醇可以通过粮食发酵或化工合成等方法制得
C.乙醇汽油是一种新型化合物
D.燃烧乙醇汽油可以减少对大气的污染是因为它不含硫元素和氮元素任务一任务二随堂检测(4)氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括 。?
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③
C.③④ D.②④
答案:(1)A (2)B (3)AB (4)A任务一任务二随堂检测解析:(1)汽车尾气主要是NOx、CO、碳粒、含铅化合物和SO2,CO2与H2不属于有害气体。(2)压缩天然气和液化石油气两类燃料的主要成分均为碳原子数较小的烃。(3)乙醇汽油是一种混合物,其含硫、氮量低,故污染少,乙醇可通过淀粉水解或乙烯与水合成制得。(4)氢能作为燃料的优点是:来源丰富(水),单位质量的氢燃烧时放热量大,氢气燃烧的唯一产物是水,不产生污染。其缺点是:现有的制取氢气方法耗能大,制取的成本太高,另外氢气的熔、沸点太低,给储存和运输带来困难。任务一任务二随堂检测4.硝酸工业产生的尾气(NO、NO2等)对环境造成污染,同时汽车尾气(含烃类、CO、SO2与NO等)是城市空气的污染源。
(1)汽车以汽油作为发动机燃料,在不断启动打火的过程中产生了CO、NO等有毒气体,若供氧不足,主要产生的污染物是 ,若供氧充足,主要产生的有毒气体是 。写出CO与NO在催化剂作用下的反应方程式: 。?
(2)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是 。?任务一任务二随堂检测(3)谈一谈汽车尾气污染物对环境造成的影响: 。?
(4)你能否应用氮元素的单质和化合物之间的转化关系,设计除去汽车尾气中氮的氧化物(NO、NO2)的理论方案?
(5)控制城市空气污染的方法可以有( )
A.开发氢能源
B.使用电动车
C.植树造林
D.戴上呼吸面具任务一任务二随堂检测(2)SO2转化为SO3,SO3与水形成H2SO4的酸雾
(3)汽车尾气排放过多,可形成光化学烟雾而污染环境,引起人类呼吸严重障碍,导致心肺衰竭(4)6NO+4NH3=5N2+6H2O,6NO2+8NH3=7N2+12H2O (5)AB 解析:(1)当供氧不足时,烃(CxHy)不完全燃烧,产生有毒气体CO,当供氧充足时,产生NO、NO2等有毒气体。CO与NO在催化剂作用下任务一任务二随堂检测(5)控制城市污染源,应避免汽车燃烧汽油,所以必须开发新的能源、如开发氢能源、使用电动车等,从根源上消除污染。
2.铅蓄电池是可充电电池,充电时正极还原成二氧化铅,负极还原成纯铅。
3.化学反应中既有物质变化又有能量变化。一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。知识铺垫新知预习1.1885年,德国工程师卡尔·本茨制造了人类历史上第一辆真正以汽油为燃料的汽车。2.庚烷(C7H16)燃烧的化学方程式:C7H16+11O2 7CO2+8H2O。
3.庚烷燃烧反应的能量变化与物质内部能量的关系知识铺垫新知预习4.为汽车选用安全气囊的气体发生剂时,要考虑所选物质的性质,还要关注所发生反应中的物质变化、能量变化和反应的化学反应速率。
5.NaN3常温下较稳定,受撞击时可迅速分解,产生氮气和金属钠,同时释放大量的热。
【微思考】汽车电瓶通常为铅蓄电池,放电时其能量转化形式是怎样的?写出电池总反应的化学方程式。每消耗1 mol硫酸转移电子的物质的量是多少?
提示:铅蓄电池是将化学能转化为电能,电池总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。每消耗1 mol硫酸转移1 mol电子。任务一任务二随堂检测 选择车用燃料
问题探究
1.如何根据燃料的能量变化选择车用燃料?
提示:达到燃料燃点需要的能量越低,反应物能量高于生成物能量越多的燃料越合适。
2.汽车尾气中有哪些有害成分?如何除去其中的氮氧化物?
提示:汽车尾气中的主要有害成分为碳氢化合物、氮氧化物、一氧化碳、二氧化碳、二氧化硫、硫化氢,以及微量的醛、酚、过氧化物等。使用催化转化器可将氮氧化物转化为氮气和氧气。任务一任务二随堂检测知识归纳
1.车用燃料
燃料通常指能够将自身存储的化学能通过化学反应(燃烧)转变为热能的物质。目前汽车所使用的燃料主要是汽油和柴油。而随着汽车保有量的逐年增加,汽车排放造成的环境污染问题以及石油资源逐渐匮乏的问题已不容忽视,因此各种代用燃料也得到了越来越广泛的应用。目前国内开发使用的发动机代用燃料包括天然气、液化石油气、甲醇、乙醇、生物质燃料、氢气以及二甲基醚等。
2.三元催化器,可将汽车尾气排出的CO、碳氢化物和NOx等有害气体通过氧化和还原作用转变为无害的二氧化碳、水和氮气。当高温的汽车尾气通过净化装置时,三元催化器中的净化剂将增强CO、碳氢化合物和NOx三种气体的活性,促使其进行一定的氧化还原化学反应,其中CO在高温下被氧化成为无色、无毒的二氧化碳气体,碳氢化物在高温下氧化成水和二氧化碳,NOx转化为氮气和氧气。三种有害气体都变成无害气体,汽车尾气得以净化。任务一任务二随堂检测典例剖析
例1下表为某汽车在不同速率时所产生的空气污染物质量(按汽车平均行驶1公里计算)。根据上表,下列说法不正确的是( )
A.汽车行驶时,污染物中CO含量最高
B.汽车速率为120 km·h-1时,污染最严重
C.从环保角度考虑,最合适的汽车速率为50 km·h-1
D.汽车速率增大时,产生的氮的氧化物也随之增多任务一任务二随堂检测答案:C
解析:根据表中信息可知汽车行驶时,污染物中CO含量最高,A项正确;汽车行驶速率为120 km·h-1时,三种污染物排放量都最多,污染最严重,B项正确;从环保角度考虑,最合适的汽车速率为80 km·h-1,C项错误;汽车行驶速率越大,产生的氮氧化物越多,D项正确。任务一任务二随堂检测变式训练1-1汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管安装“催化转化装置器”。它能使CO和NOx反应生成可参与大气生态环境循环的无毒气体,并使烃类充分燃烧,使SO2转化。下列说法正确的是( )
A.CO和NOx反应的化学方程式为2xCO+2NOx=2xCO2+N2
B.上述方法的缺点是导致空气中CO2的含量增大,从而大大提高空气的酸度
C.植树造林,增大绿化面积,可有效控制城市的各种污染源
D.汽车改用天然气或氢气作为燃料,不会减少对空气的污染
答案:A
解析:空气中CO2的含量增大,不会大大提高空气的酸度;植树造林,增大绿化面积,并不能有效控制城市的各种污染源;汽车改用天然气或氢气作为燃料,会减少对空气的污染。任务一任务二随堂检测变式训练1-2汽车尾气在光照下分解时,即开始光化学烟雾的循环,它的形成过程可用下列化学方程式表示:NO2=NO+O,2NO+O2=2NO2,O2+O=O3。下列有关叙述不正确的是( )
A.此过程中,NO2是催化剂
B.在此过程中,NO是中间产物
C.此过程的总方程式为2O3=3O2
D.光化学烟雾能引起人的外呼吸功能严重障碍
答案:C
解析:NO2在反应前后质量和化学性质均没发生变化,只是加快了O2变成O3的反应速率,因此NO2是O2变成O3的催化剂。将三个方程式相加得到的总反应方程式为3O2=2O3。任务一任务二随堂检测设计安全气囊
问题探究
汽车安全气囊中通常加入什么物质?气囊中产生的是什么气体?
提示:安全气囊中通常装入的是叠氮化钠(NaN3),受到剧烈撞击时迅速分解生成大量氮气,所以气囊中产生的是氮气。
知识归纳
1.安全气囊爆炸的化学反应原理
叠氮化钠、硝酸铵,经过猛烈撞击后,这些物质发生分解反应,产生大量的气体充满气囊,保护乘车人员的头部安全。2.目前使用的气体发生剂主要由叠氮化钠、三氧化二铁、硝酸铵等物质按一定比例混合而成。任务一任务二随堂检测典例剖析
例2氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。回答问题:
(1)Na3N的电子式为 ,该化合物由 键形成。?
(2)Na3N与盐酸反应生成 种盐,其电子式为 。?
(3)Na3N与水反应属于 反应。?
(4)比较Na3N中两种微粒的半径:r(Na+) r(N3-)(填“>”“<”或“=”)。?
(5)写出Na3N与水反应的化学方程式: 。?
(6)写出Na3N与盐酸反应的化学方程式: 。?任务一任务二随堂检测任务一任务二随堂检测 (2)氮化钠和水反应生成氨气,则根据原子守恒可判断,另外一种生成物应该是氢氧化钠,所以氮化钠和盐酸反应的生成物应该是氯化钠和氯化铵,共计是2种盐,氯化钠和氯化铵都是离子化合物,氯化(3)Na3N和水相互交换成分发生复分解反应生成NaOH和NH3。
(4)Na+与N3-属电子层结构相同的粒子,核电荷数越大半径越小,故Na+的核电荷数大而半径小,即r(Na+)
(6)Na3N与盐酸反应生成氯化钠和氯化铵,反应的化学方程式为Na3N+4HCl=3NaCl+NH4Cl。任务一任务二随堂检测变式训练2Na3N是离子化合物,它和水作用可产生NH3。下列叙述正确的是( )
A.Na+和N3-的电子层结构都与氖原子相同
B.Na+的半径大于N3-的半径
C.Na3N与足量的盐酸反应后生成一种盐
D.在Na3N与水的反应中,Na3N做还原剂
答案:A
解析:Na+和N3-核外电子数相同,电子层结构都与氖原子相同,故A正确;Na+的半径小于N3-的半径,故B错误;Na3N与盐酸发生反应Na3N+4HCl=3NaCl+NH4Cl,生成两种盐,故C错误;Na3N与水的反应中各元素化合价均不变,不属于氧化还原反应,故D错误。任务一任务二随堂检测1.近年来,我国许多城市禁止汽车使用含铅汽油的主要原因是( )
A.提高汽油燃烧效率
B.降低汽油成本
C.避免铅污染大气
D.铅资源短缺
答案:C
解析:为了防止震动,常在汽油中加入抗震剂,四乙基铅有很好的抗震作用,被广泛采用。后来发现加入的四乙基铅只有20%起了作用,其余80%随尾气排入大气,含铅化合物对人体有很大的危害,可通过呼吸或皮肤吸收进入人体,影响神经系统,造成意识障碍,引起幻听、幻视、抽搐、昏迷、直至死亡,尤其影响儿童智力发育,因此当前各国都采用其他抗震剂而不采用铅制剂。任务一任务二随堂检测2.氮和钠可形成离子化合物Na3N,它能与水剧烈反应产生NaOH和NH3。下列叙述正确的( )
A.Na3N中钠离子半径比氮离子半径小
B.Na3N含离子键和非极性键
C.Na3N属于共价化合物
D.Na3N中两元素都是ⅠA族元素
答案:A
解析:钠离子半径小于氮离子;Na3N中只含有离子键,属于离子化合物;Na是ⅠA族元素,N是ⅤA族元素。任务一任务二随堂检测3.汽车的发明与使用是人类智慧的杰出体现,它为人们的生活和生产带来了极大的方便,但同时由此引发的环境污染问题也越来越引起人们的关注,人们开始研究新的清洁燃料。
(1)新型环保出租车采用LPG+汽油的双燃料系统,其尾气中的有毒气体成分较普通车型下降80%左右,缓解了汽车尾气排放给城市环境造成的污染问题。下列物质中不属于有害气体的是 。?
A.CO2和H2
B.NO2和NO
C.CO和SO2
D.碳粒和含铅化合物任务一任务二随堂检测(2)为了减少大气污染,许多城市推广使用汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是 。?
A.碳水化合物
B.碳氢化合物
C.氢气
D.醇类
(3)我国推广使用乙醇汽油,它是在汽油中加入适量乙醇形成的混合燃料。下列叙述中正确的是 。?
A.使用乙醇汽油能减少有害气体的排放,是一种改善环境的清洁能源
B.燃料中的乙醇可以通过粮食发酵或化工合成等方法制得
C.乙醇汽油是一种新型化合物
D.燃烧乙醇汽油可以减少对大气的污染是因为它不含硫元素和氮元素任务一任务二随堂检测(4)氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括 。?
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③
C.③④ D.②④
答案:(1)A (2)B (3)AB (4)A任务一任务二随堂检测解析:(1)汽车尾气主要是NOx、CO、碳粒、含铅化合物和SO2,CO2与H2不属于有害气体。(2)压缩天然气和液化石油气两类燃料的主要成分均为碳原子数较小的烃。(3)乙醇汽油是一种混合物,其含硫、氮量低,故污染少,乙醇可通过淀粉水解或乙烯与水合成制得。(4)氢能作为燃料的优点是:来源丰富(水),单位质量的氢燃烧时放热量大,氢气燃烧的唯一产物是水,不产生污染。其缺点是:现有的制取氢气方法耗能大,制取的成本太高,另外氢气的熔、沸点太低,给储存和运输带来困难。任务一任务二随堂检测4.硝酸工业产生的尾气(NO、NO2等)对环境造成污染,同时汽车尾气(含烃类、CO、SO2与NO等)是城市空气的污染源。
(1)汽车以汽油作为发动机燃料,在不断启动打火的过程中产生了CO、NO等有毒气体,若供氧不足,主要产生的污染物是 ,若供氧充足,主要产生的有毒气体是 。写出CO与NO在催化剂作用下的反应方程式: 。?
(2)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是 。?任务一任务二随堂检测(3)谈一谈汽车尾气污染物对环境造成的影响: 。?
(4)你能否应用氮元素的单质和化合物之间的转化关系,设计除去汽车尾气中氮的氧化物(NO、NO2)的理论方案?
(5)控制城市空气污染的方法可以有( )
A.开发氢能源
B.使用电动车
C.植树造林
D.戴上呼吸面具任务一任务二随堂检测(2)SO2转化为SO3,SO3与水形成H2SO4的酸雾
(3)汽车尾气排放过多,可形成光化学烟雾而污染环境,引起人类呼吸严重障碍,导致心肺衰竭(4)6NO+4NH3=5N2+6H2O,6NO2+8NH3=7N2+12H2O (5)AB 解析:(1)当供氧不足时,烃(CxHy)不完全燃烧,产生有毒气体CO,当供氧充足时,产生NO、NO2等有毒气体。CO与NO在催化剂作用下任务一任务二随堂检测(5)控制城市污染源,应避免汽车燃烧汽油,所以必须开发新的能源、如开发氢能源、使用电动车等,从根源上消除污染。
