第二单元 元素性质的递变规律 元素第一电离能的周期性变化20张PPT
文档属性
| 名称 | 第二单元 元素性质的递变规律 元素第一电离能的周期性变化20张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-10 08:22:36 | ||
图片预览





文档简介
课件20张PPT。专题二 原子结构与元素的性质第二单元 元素性质的递变规律
元素第一电离能的周期性变化
苏教版 物质结构与性质 阅读课本p20解决以下问题:
1、什么是第一电离能
2、符号、单位思考:第一电离能数值大小与原子得失电子能力有什么关系?第一电离能第一电离能定义的理解1、已知1mol M(g)变成M +(g)时,所吸收的最低能量为502KJ,则M元素的I1= .
2、判断正误
20℃时1molNa失去1mol电子吸收650KJ能量,则Na的第一电离能为650 KJ·mol-1
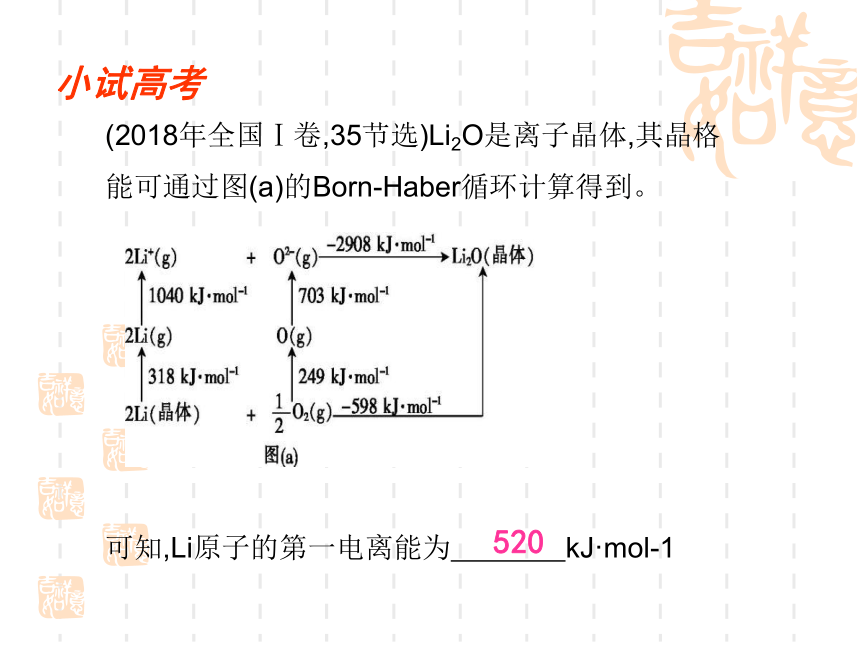
502KJ/mol错小试高考(2018年全国Ⅰ卷,35节选)Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。
可知,Li原子的第一电离能为 kJ·mol-1
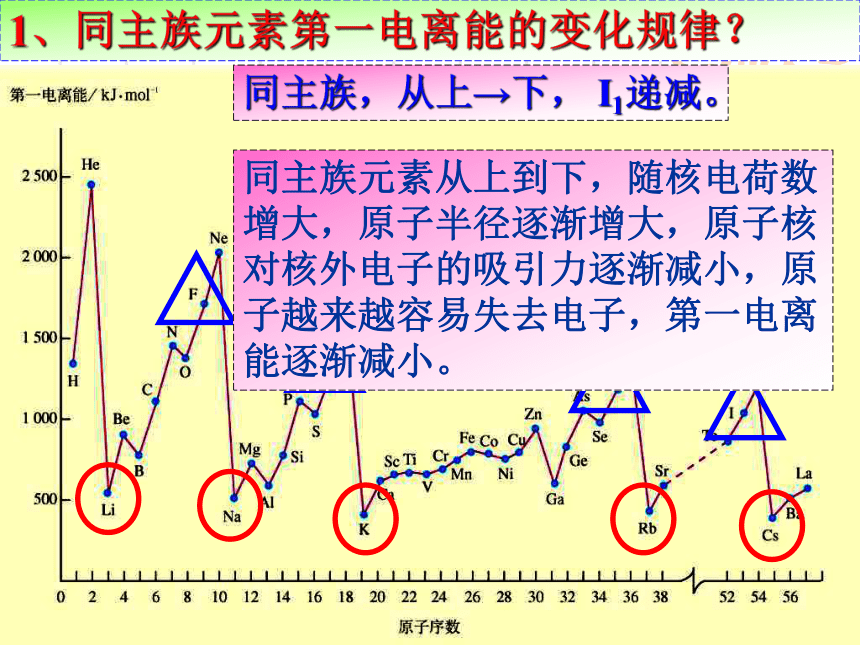
520 问题探究1.同周期、同主族元素第一电离能的变化规律?
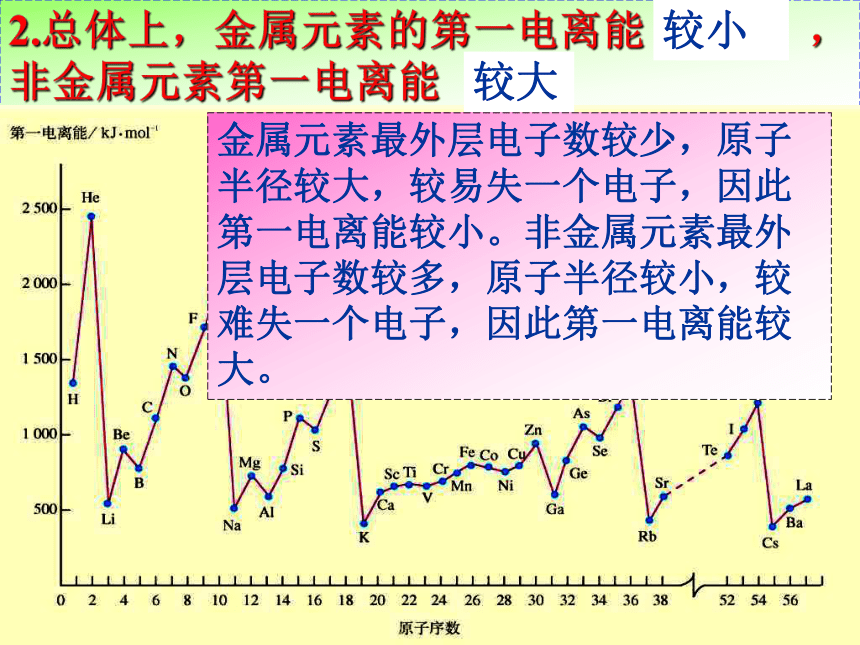
2.总体上,金属元素的第一电离能较( ? ),非金属元素第一电离能较( ? )
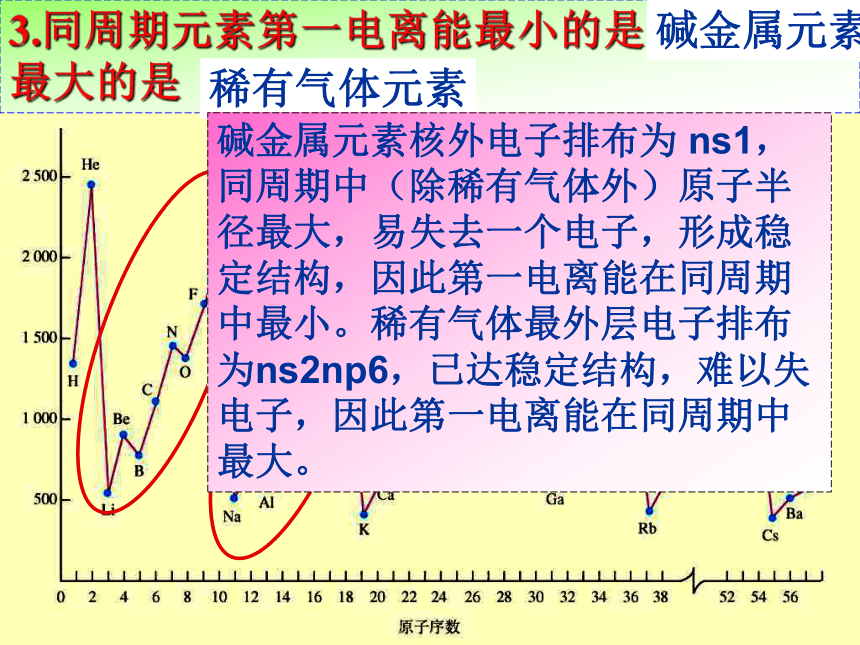
3.同周期元素第一电离能最小的是 ( ? 族元素 ) 最大的是( ? 族元素 )
4、短周期中同周期哪些元素第一电离能出现反常?
这些元素有什么共同点?试从核外电子排布分析出现反常的原因。
请以小组为单位,探究下列问题并解释原因。kJ/mol1、 同周期元素第一电离能的变化规律?同周期,从左→右, I1呈增大趋势同周期元素从左到右,随核电荷数增大,原子半径逐渐减小,原子核对核外电子的吸引力逐渐增大,原子越来越难失去电子,第一电离能有逐渐增大的趋势。1、同主族元素第一电离能的变化规律?同主族,从上→下, I1递减。同主族元素从上到下,随核电荷数增大,原子半径逐渐增大,原子核对核外电子的吸引力逐渐减小,原子越来越容易失去电子,第一电离能逐渐减小。kJ/molScTi2.总体上,金属元素的第一电离能( ),非金属元素第一电离能( ) 较大较小金属元素最外层电子数较少,原子半径较大,较易失一个电子,因此第一电离能较小。非金属元素最外层电子数较多,原子半径较小,较难失一个电子,因此第一电离能较大。kJ/mol3.同周期元素第一电离能最小的是 ( )
最大的是( )碱金属元素稀有气体元素碱金属元素核外电子排布为 ns1,同周期中(除稀有气体外)原子半径最大,易失去一个电子,形成稳定结构,因此第一电离能在同周期中最小。稀有气体最外层电子排布为ns2np6,已达稳定结构,难以失电子,因此第一电离能在同周期中最大。4、短周期中同周期哪些元素第一电离能出现反常?
这些元素有什么共同点?试从核外电子排布分析出现反常的原因。规律特殊性:ⅡA、ⅤA族元素第一电离能比同周期相邻元素高拓展讨论:同种元素逐级电离能的变化规律同种元素逐级电离能逐渐升高: I1﹤I2﹤I3……﹤InNa元素的逐级电离能数据: 一价气态正离子再失去一个电子所需要的能量叫做第二电离能,符号I2。以此类推,第三、第四电离能……表2-6 钠和镁的第一、二、三电离能 为什么Na元素易形成Na+,而不易形成Na2+;镁元素易形成Mg2+,而不易形成Mg3+?分析以上数据回答以下问题:
交流与讨论从表中数据可知钠元素的第二电离能远大于第一电离能,因此钠容易失去第一个电子而不易失去第二个电子;即Na易形成Na +而不易形成Na 2+ 。而Mg的第一第二电离能相差不大,第三电离能远大于第二电离能,因此镁易形成+2价镁离子。交流与讨论
已知某元素M的各级电离能(In/kJ?mo1—1)如下:
试推测该元素的原子最外层有 个电子
主要化合价是 价.该元素氧化物的化学式可能是3+3M2O3
元素第一电离能 同周期左→ 右增大趋势(两处反常)
同主族上→ 下逐渐减小随原子序数的递增,元素的第一电离能呈现周期性变化。这一变化规律是原子核外电子排布呈周期性变化的结果。 1、判断下列元素间的第一电离能的大小
Na K N P
F Ne Cl S
Mg Al O N>>>><<练一练2.下列元素中,第一电离能最大的( )
A、 K B、 Na C、P D、Cl D具有下列电子构型的元素中,第一电离能最小的是( )
A、nS2nP3 B、nS2nP4
C、nS2nP5 D、 nS2nP6
B
4.下列说法中正确的是( )
A.第3周期所含的元素中钠的第一电离能最小
B.硼的第一电离能比铍的第一电离能大
C.在所有元素中,氟的第一电离能最大
D.钾的第一电离能比镁的第一电离能大
5.下列各组元素,按照原子半径依次减小,第一电离能依次增大的顺序排列的是( )
A. Ca、Mg 、 Be B. Na 、 Mg 、Al
C. C 、 N 、 O D. P 、 S 、 FAA巩固练习:练一练小试高考1.(2016年全国ⅠⅠⅠ卷,37节选)国Ⅲ) 根据元素周期律,第一电离能Ga_________As。(填“大于”或“小于”)
2.(2014·新课标全国卷Ⅱ) N、O、S元素中第一电离能最大的是________(填元素符号)。
小于 N 小试高考((2018年全国Ⅲ卷,35节选)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn) (填“大于”或“小于”)I1(Cu)。原因是 ?
(2016年全国Ⅱ卷,37节选)元素铜与镍的第二电离能分别为ICu=1958 kJ·mol-1、INi=1753 kJ·mol-1,ICu>INi的原因是 。?
大于Zn的核外电子排布为全满稳定结构,较难失电子Cu失去的是全充满的3d10电子,Ni失去的是4S1电子作 业
1、课课练 2、课后作业
元素第一电离能的周期性变化
苏教版 物质结构与性质 阅读课本p20解决以下问题:
1、什么是第一电离能
2、符号、单位思考:第一电离能数值大小与原子得失电子能力有什么关系?第一电离能第一电离能定义的理解1、已知1mol M(g)变成M +(g)时,所吸收的最低能量为502KJ,则M元素的I1= .
2、判断正误
20℃时1molNa失去1mol电子吸收650KJ能量,则Na的第一电离能为650 KJ·mol-1
502KJ/mol错小试高考(2018年全国Ⅰ卷,35节选)Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。
可知,Li原子的第一电离能为 kJ·mol-1
520 问题探究1.同周期、同主族元素第一电离能的变化规律?
2.总体上,金属元素的第一电离能较( ? ),非金属元素第一电离能较( ? )
3.同周期元素第一电离能最小的是 ( ? 族元素 ) 最大的是( ? 族元素 )
4、短周期中同周期哪些元素第一电离能出现反常?
这些元素有什么共同点?试从核外电子排布分析出现反常的原因。
请以小组为单位,探究下列问题并解释原因。kJ/mol1、 同周期元素第一电离能的变化规律?同周期,从左→右, I1呈增大趋势同周期元素从左到右,随核电荷数增大,原子半径逐渐减小,原子核对核外电子的吸引力逐渐增大,原子越来越难失去电子,第一电离能有逐渐增大的趋势。1、同主族元素第一电离能的变化规律?同主族,从上→下, I1递减。同主族元素从上到下,随核电荷数增大,原子半径逐渐增大,原子核对核外电子的吸引力逐渐减小,原子越来越容易失去电子,第一电离能逐渐减小。kJ/molScTi2.总体上,金属元素的第一电离能( ),非金属元素第一电离能( ) 较大较小金属元素最外层电子数较少,原子半径较大,较易失一个电子,因此第一电离能较小。非金属元素最外层电子数较多,原子半径较小,较难失一个电子,因此第一电离能较大。kJ/mol3.同周期元素第一电离能最小的是 ( )
最大的是( )碱金属元素稀有气体元素碱金属元素核外电子排布为 ns1,同周期中(除稀有气体外)原子半径最大,易失去一个电子,形成稳定结构,因此第一电离能在同周期中最小。稀有气体最外层电子排布为ns2np6,已达稳定结构,难以失电子,因此第一电离能在同周期中最大。4、短周期中同周期哪些元素第一电离能出现反常?
这些元素有什么共同点?试从核外电子排布分析出现反常的原因。规律特殊性:ⅡA、ⅤA族元素第一电离能比同周期相邻元素高拓展讨论:同种元素逐级电离能的变化规律同种元素逐级电离能逐渐升高: I1﹤I2﹤I3……﹤InNa元素的逐级电离能数据: 一价气态正离子再失去一个电子所需要的能量叫做第二电离能,符号I2。以此类推,第三、第四电离能……表2-6 钠和镁的第一、二、三电离能 为什么Na元素易形成Na+,而不易形成Na2+;镁元素易形成Mg2+,而不易形成Mg3+?分析以上数据回答以下问题:
交流与讨论从表中数据可知钠元素的第二电离能远大于第一电离能,因此钠容易失去第一个电子而不易失去第二个电子;即Na易形成Na +而不易形成Na 2+ 。而Mg的第一第二电离能相差不大,第三电离能远大于第二电离能,因此镁易形成+2价镁离子。交流与讨论
已知某元素M的各级电离能(In/kJ?mo1—1)如下:
试推测该元素的原子最外层有 个电子
主要化合价是 价.该元素氧化物的化学式可能是3+3M2O3
元素第一电离能 同周期左→ 右增大趋势(两处反常)
同主族上→ 下逐渐减小随原子序数的递增,元素的第一电离能呈现周期性变化。这一变化规律是原子核外电子排布呈周期性变化的结果。 1、判断下列元素间的第一电离能的大小
Na K N P
F Ne Cl S
Mg Al O N>>>><<练一练2.下列元素中,第一电离能最大的( )
A、 K B、 Na C、P D、Cl D具有下列电子构型的元素中,第一电离能最小的是( )
A、nS2nP3 B、nS2nP4
C、nS2nP5 D、 nS2nP6
B
4.下列说法中正确的是( )
A.第3周期所含的元素中钠的第一电离能最小
B.硼的第一电离能比铍的第一电离能大
C.在所有元素中,氟的第一电离能最大
D.钾的第一电离能比镁的第一电离能大
5.下列各组元素,按照原子半径依次减小,第一电离能依次增大的顺序排列的是( )
A. Ca、Mg 、 Be B. Na 、 Mg 、Al
C. C 、 N 、 O D. P 、 S 、 FAA巩固练习:练一练小试高考1.(2016年全国ⅠⅠⅠ卷,37节选)国Ⅲ) 根据元素周期律,第一电离能Ga_________As。(填“大于”或“小于”)
2.(2014·新课标全国卷Ⅱ) N、O、S元素中第一电离能最大的是________(填元素符号)。
小于 N 小试高考((2018年全国Ⅲ卷,35节选)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn) (填“大于”或“小于”)I1(Cu)。原因是 ?
(2016年全国Ⅱ卷,37节选)元素铜与镍的第二电离能分别为ICu=1958 kJ·mol-1、INi=1753 kJ·mol-1,ICu>INi的原因是 。?
大于Zn的核外电子排布为全满稳定结构,较难失电子Cu失去的是全充满的3d10电子,Ni失去的是4S1电子作 业
1、课课练 2、课后作业
