第二单元 元素性质的递变规律 元素第一电离能的周期性变化31张PPT
文档属性
| 名称 | 第二单元 元素性质的递变规律 元素第一电离能的周期性变化31张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-10 08:23:01 | ||
图片预览






文档简介
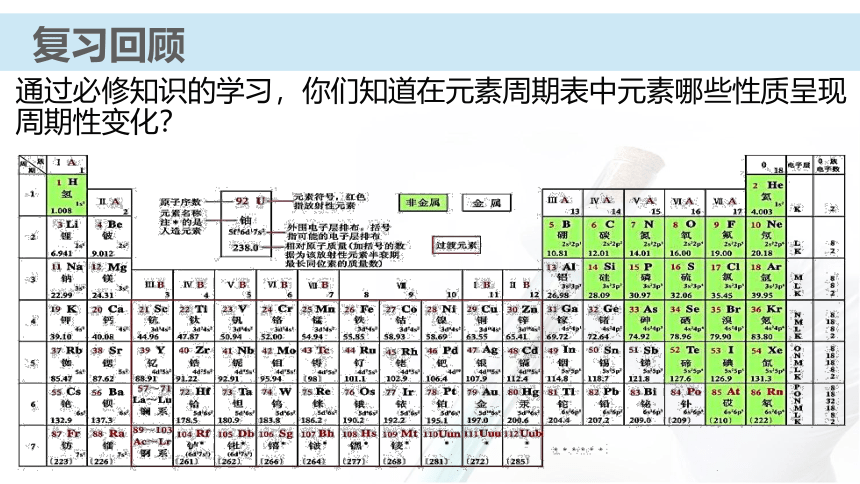
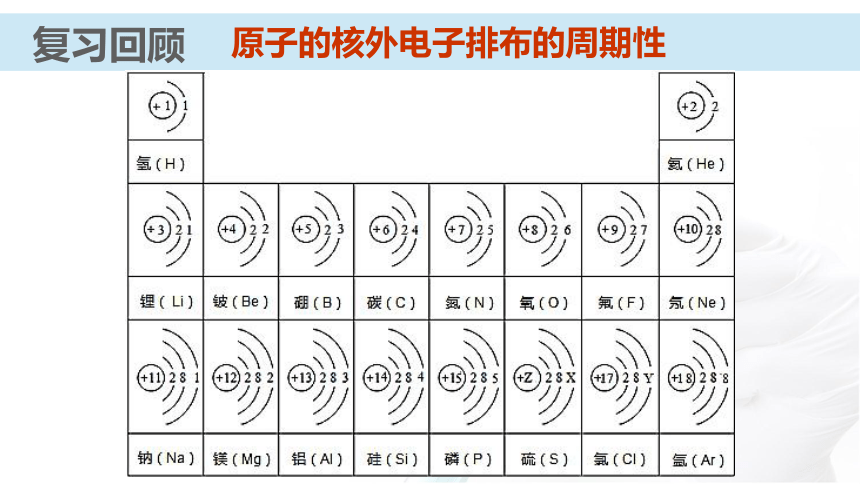
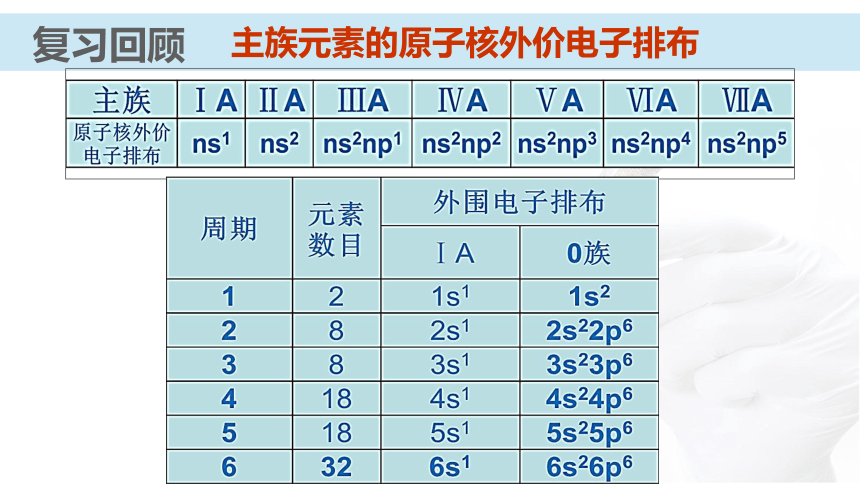
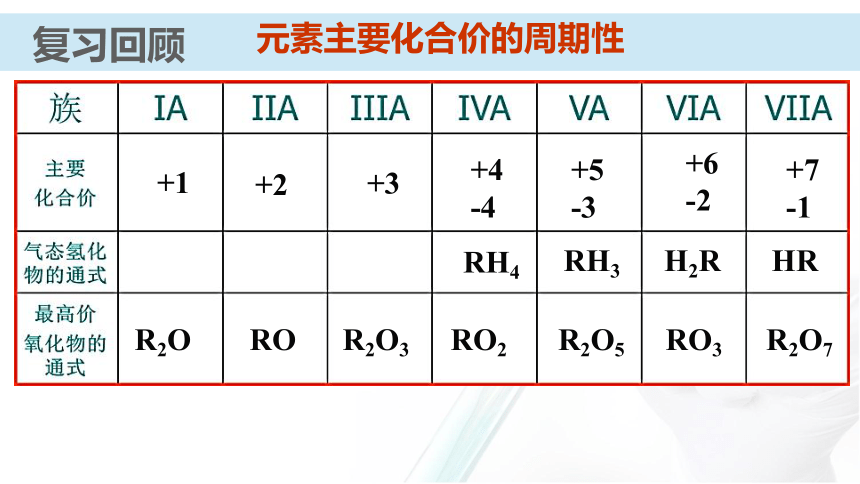
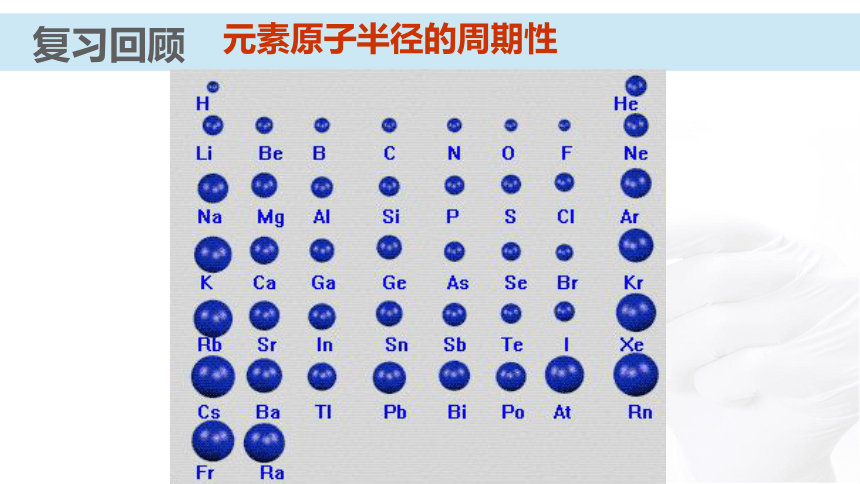
课件31张PPT。 【化学史话】第一个稀有气体化合物的发现英国化学家巴特列O2O2+1175.5kJ?mol-1电离能XeXe+1170 kJ?mol-1电离能O2PtF6XePtF6 O2+PtF6- Xe+【化学史话】第一个稀有气体化合物的发现资料卡:稀有气体化合物的重要应用 氡的氟化物应用于辐射监测和大气净化;氙的化合物具有奇特的光、电和磁学性质,可用来制造特殊的光学玻璃、激光材料;XeO3对震动很敏感,爆炸后不留任何碎片或腐蚀性气体,可用作微型炸药和高能燃料。元素第一电离能的周期性变化通过必修知识的学习,你们知道在元素周期表中元素哪些性质呈现周期性变化?复习回顾复习回顾原子的核外电子排布的周期性复习回顾主族元素的原子核外价电子排布元素主要化合价的周期性复习回顾复习回顾元素原子半径的周期性知识梳理原子半径依次( ),核对电子的引力依次( )
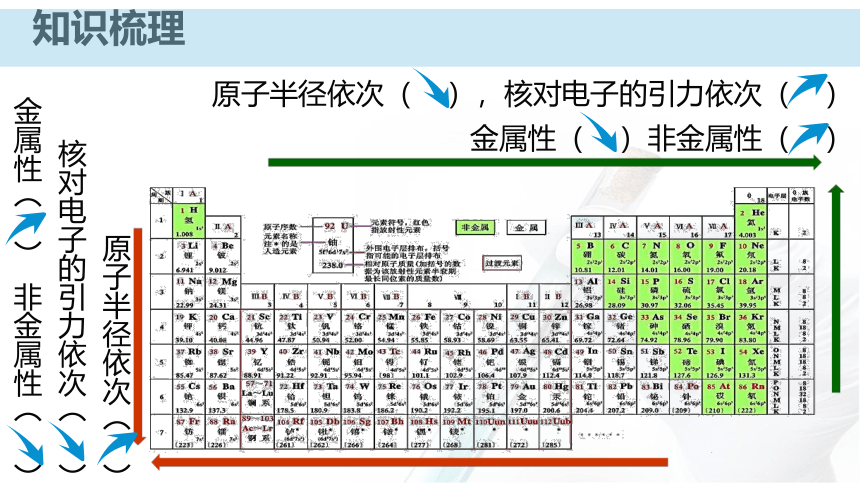
金属性( )非金属性( )原子半径依次( )
核对电子的引力依次( )
金属性( ) 非金属性( )即时突破结合元素周期律,比较下列元素原子的失电子能力。
Li Be
Be Mg
Li Mg
><问题探究一、元素第一电离能阅读课本p20解决以下问题:
1、什么是第一电离能?
2、符号、单位和表示方法?
3、第一电离能数值大小与原子得失电子能力有什么关系?解决问题738kJ·mol-1一、元素第一电离能【概念】元素第一电离能:
符号:
单位:气态原子失去一个电子形成+1价气态阳离子所需的最低能量。I1kJ·mol-1?【概念运用】③元素第一电离能的大小与原子失电子能力有何关系?I1越小,原子越易失去一个电子;
I1越大,原子越难失去一个电子。I1的意义:衡量元素的气态原子失去一个电子的
难易程度 。解决问题一、元素第一电离能1~18号元素第一电离能数据 单位:kJ·mol-1解决问题 气态原子失电子能力:Li Mg ?>交流讨论元素第一电离能的变化规律1、总体上,金属与非金属的I1有何区别?
2、同主族元素的I1变化规律?
3、同周期主族元素的I1的变化规律?
4、试从原子结构角度解释这种变化规律。交流讨论元素第一电离能的变化规律结论:1.总体上,金属元素的第一电离能都较小 ,非金属元素和稀有气体元素的第一电离能都较大结论:2、同主族,从上→下, I1依次递减。交流讨论同主族元素第一电离能的变化规律原因:同一主族从上到下,电子层数增加,
原子半径增大,核对外层电子的引力减小,
失电子所需的能量减小,元素第一电离能逐渐减小。同周期主族元素第一电离能的变化规律交流讨论结论:3、同周期从左到右,主族元素的I1总体上是呈增大趋势。
最小的是碱金属元素,最大的是稀有气体元素。原因:同周期从左到右,核电荷数增加,原子半径减小,
核对外层电子的引力增大,失电子所需的能量增大,
元素第一电离能逐渐增大。5、同周期哪些元素第一电离能出现反常?
这些元素有什么共同点?试从核外电子排布分析出现反常的原因。交流讨论 规律特殊性:
ⅡA、ⅤA族元素第一电离能比同周期相邻元素高交流讨论小结:元素第一电离能的递变规律随着原子序数的递增,元素第一电离能呈现周期性变化这一变化规律是原子核外电子排布呈现周期性变化的结果。交流讨论通过以上分析,你认为影响第一电离能的因素有哪些?1、原子核对核外电子的引力:2、原子的核外电子是否具有稳定结构?核电荷数原子半径(1)将下列元素按第一电离能由大到小的顺序排列: ①N O F Ne ②Na Mg Al K (2)预测下列关系中正确的 (填写编号) ①I1(砷)> I1(硒) ② I1(砷)< I1(硒) ③ I1(溴)> I1(硒)④ I1(溴)< I1(硒) 即时巩固根据第一电离能的定义,你能说出什么是第二电离能、第三电离能......吗? 第二电离能:是指+1价气态离子失去一个电子形成+2价气态离子所需的最低能量称该元素的第二电离能。用I2表示。
类似用I3、I4...表示元素的第三、四...电离能等。思维拓宽问题探究钠和镁的第一、第二、第三电离能如下表所示,分析表中数据,解释下列问题:(1)为什么对于同一元素来说,I1(2)为什么钠易形成Na+,而不易形成Na2+,镁易形成Mg2+,而不易形成Mg3+?
(3)为什么钠元素的I2远大于I1,而镁元素的I3远大于I1、I2?
(用所学的原子结构或离子结构知识解释)
试推测该元素的原子最外层有 个电子
主要化合价是 价.该元素氧化物的化学式可能是 。3+3M2O3
即时巩固
(3)已知某元素M的各级电离能(In/kJ?mo1-1)如下:
元素电离能大小的应用:用来衡量原子失去电子的难易
判断原子失去电子的数目和形成阳离子所带的电荷
根据电离能数据是否接近,寻找合成新的化合物知识总结知识总结核电荷数
原子半径
原子的核外电子排布(稳定?)知识总结依次减小大增次依呈减小趋势呈增大趋势CsHe2.下列各组元素,按照原子半径依次减小、第一电离能依次增大的顺序排列的是( )
A.Ca、Mg、Be B.Na、Mg、Al
C.C、N、O D.P、S、F1.具有下列电子构型的元素中,第一电离能最小的是( )
A.ns2np3 B. ns2np4
C. ns2np5 D. ns2np6练习与实践
金属性( )非金属性( )原子半径依次( )
核对电子的引力依次( )
金属性( ) 非金属性( )即时突破结合元素周期律,比较下列元素原子的失电子能力。
Li Be
Be Mg
Li Mg
><问题探究一、元素第一电离能阅读课本p20解决以下问题:
1、什么是第一电离能?
2、符号、单位和表示方法?
3、第一电离能数值大小与原子得失电子能力有什么关系?解决问题738kJ·mol-1一、元素第一电离能【概念】元素第一电离能:
符号:
单位:气态原子失去一个电子形成+1价气态阳离子所需的最低能量。I1kJ·mol-1?【概念运用】③元素第一电离能的大小与原子失电子能力有何关系?I1越小,原子越易失去一个电子;
I1越大,原子越难失去一个电子。I1的意义:衡量元素的气态原子失去一个电子的
难易程度 。解决问题一、元素第一电离能1~18号元素第一电离能数据 单位:kJ·mol-1解决问题 气态原子失电子能力:Li Mg ?>交流讨论元素第一电离能的变化规律1、总体上,金属与非金属的I1有何区别?
2、同主族元素的I1变化规律?
3、同周期主族元素的I1的变化规律?
4、试从原子结构角度解释这种变化规律。交流讨论元素第一电离能的变化规律结论:1.总体上,金属元素的第一电离能都较小 ,非金属元素和稀有气体元素的第一电离能都较大结论:2、同主族,从上→下, I1依次递减。交流讨论同主族元素第一电离能的变化规律原因:同一主族从上到下,电子层数增加,
原子半径增大,核对外层电子的引力减小,
失电子所需的能量减小,元素第一电离能逐渐减小。同周期主族元素第一电离能的变化规律交流讨论结论:3、同周期从左到右,主族元素的I1总体上是呈增大趋势。
最小的是碱金属元素,最大的是稀有气体元素。原因:同周期从左到右,核电荷数增加,原子半径减小,
核对外层电子的引力增大,失电子所需的能量增大,
元素第一电离能逐渐增大。5、同周期哪些元素第一电离能出现反常?
这些元素有什么共同点?试从核外电子排布分析出现反常的原因。交流讨论 规律特殊性:
ⅡA、ⅤA族元素第一电离能比同周期相邻元素高交流讨论小结:元素第一电离能的递变规律随着原子序数的递增,元素第一电离能呈现周期性变化这一变化规律是原子核外电子排布呈现周期性变化的结果。交流讨论通过以上分析,你认为影响第一电离能的因素有哪些?1、原子核对核外电子的引力:2、原子的核外电子是否具有稳定结构?核电荷数原子半径(1)将下列元素按第一电离能由大到小的顺序排列: ①N O F Ne ②Na Mg Al K (2)预测下列关系中正确的 (填写编号) ①I1(砷)> I1(硒) ② I1(砷)< I1(硒) ③ I1(溴)> I1(硒)④ I1(溴)< I1(硒) 即时巩固根据第一电离能的定义,你能说出什么是第二电离能、第三电离能......吗? 第二电离能:是指+1价气态离子失去一个电子形成+2价气态离子所需的最低能量称该元素的第二电离能。用I2表示。
类似用I3、I4...表示元素的第三、四...电离能等。思维拓宽问题探究钠和镁的第一、第二、第三电离能如下表所示,分析表中数据,解释下列问题:(1)为什么对于同一元素来说,I1
(3)为什么钠元素的I2远大于I1,而镁元素的I3远大于I1、I2?
(用所学的原子结构或离子结构知识解释)
试推测该元素的原子最外层有 个电子
主要化合价是 价.该元素氧化物的化学式可能是 。3+3M2O3
即时巩固
(3)已知某元素M的各级电离能(In/kJ?mo1-1)如下:
元素电离能大小的应用:用来衡量原子失去电子的难易
判断原子失去电子的数目和形成阳离子所带的电荷
根据电离能数据是否接近,寻找合成新的化合物知识总结知识总结核电荷数
原子半径
原子的核外电子排布(稳定?)知识总结依次减小大增次依呈减小趋势呈增大趋势CsHe2.下列各组元素,按照原子半径依次减小、第一电离能依次增大的顺序排列的是( )
A.Ca、Mg、Be B.Na、Mg、Al
C.C、N、O D.P、S、F1.具有下列电子构型的元素中,第一电离能最小的是( )
A.ns2np3 B. ns2np4
C. ns2np5 D. ns2np6练习与实践
