第二单元 元素性质的递变规律
图片预览







文档简介
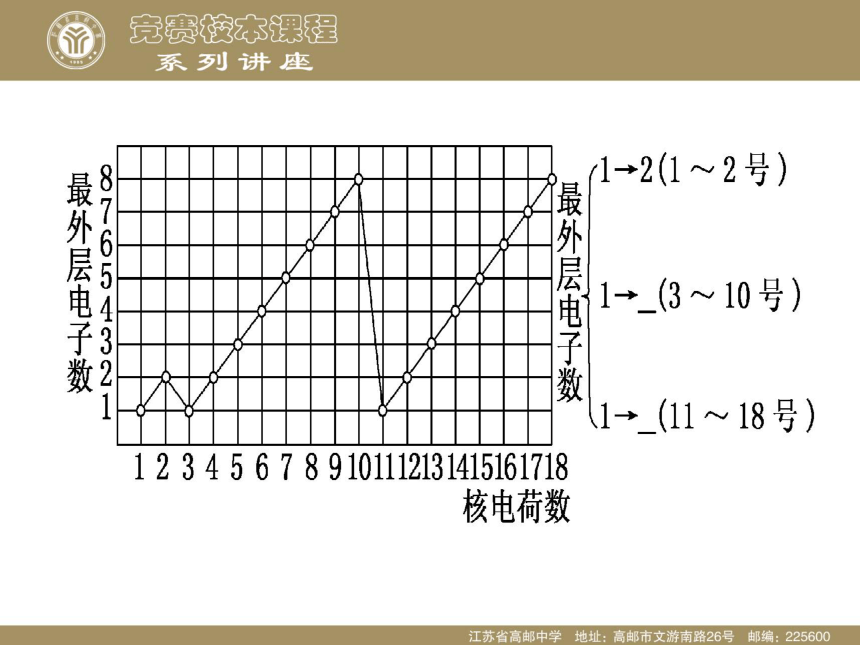
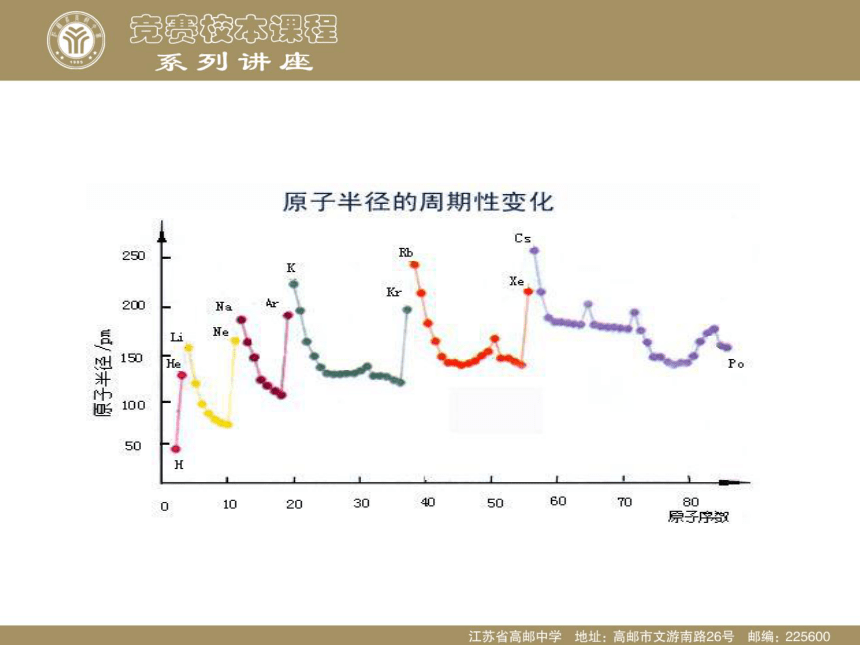
课件29张PPT。第二讲 元素性质的递变规律【交流与讨论1】 1、同一周期从左到右随着原子序数的增加,元素原子的外围电子排布呈现什么样的变化规律? 2、同一主族从上到下随着原子序数的增加,元素原子的外围电子排布呈现什么样的变化规律?【结论1】 1、同一周期从左到右随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化。 2、同一主族从上到下随着原子序数的增加,元素的原子外围电子排布相同,不同的只是电子层数。【交流与讨论2】 1、同一周期从左到右随着原子序数的增加,元素原子半径呈现什么样的变化规律(稀有气体除外)? 2、同一主族从上到下随着原子序数的增加,元素原子半径呈现什么样的变化规律?【结论2】 1、同一周期从左到右随着原子序数的增加,原子半径依次减小(除稀有气体)。
2、同一主族从上到下随着原子序数的增加,原子半径依次增大。
【交流与讨论3】 1、同一周期从左到右随着原子序数的增加,元素的主要化合价呈现什么样的变化规律? 2、同一主族从上到下随着原子序数的增加,元素的主要化合价呈现什么样的变化规律?
【结论3】 1、同一周期从左到右随着原子序数的增加,元素的最高正价由+1价递增到+7价 (稀有气体、氧、氟除外) ,且最高正价等于最外层电子数。最低负价由-4价变化到-1价。
2、同主族元素,最高正价等于主族序数。【交流与讨论4】 1、同一周期从左到右随着原子序数的增加,元素金属性和非金属性呈现什么样的变化规律?
2、同一主族从上到下随着原子序数的增加,元素金属性和非金属性呈现什么样的变化规律?
【信息提示】元素的金属性与非金属性强弱
人们在长期的研究中发现,元素的单质和化合物的某些性质有助于判断元素的金属性、非金属性强弱:通常情况下,元素的金属性越强,它的单质越容易从水或酸中置换出氢,该元素最高价氧化物的水化物的碱性越强;元素的非金属性越强,它的单质越容易与氢反应形成气态氢化物,气态氢化物越稳定,该元素最高价氧化物的水化物的酸性越强。
SiH4PH3H2SHClH4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸【结论4】 1、同一周期从左到右随着原子序数的增加,元素金属性逐渐减弱,非金属性逐渐增强。
2、同一主族从上到下随着原子序数的增加,元素的金属性逐渐增强,非金属性逐渐减弱。 元素第一电离能的周期性变化 气态原子 气态阳离子 I1 容易 【交流与讨论5】 1、同一周期从左到右随着原子序数的增加,元素的第一电离能呈现什么样的变化规律? 2、同一主族从上到下随着原子序数的增加,元素的第一电离能呈现什么样的变化规律? 1、同一周期从左到右随着原子序数的增加,第一电离能呈现增大趋势。
2、同一主族从上到下随着原子序数的增加,第一电离能逐渐减小。
3、元素的第一电离能大小还与其原子的核外电子排布(特别是外围电子排布)有关。通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构时,原子的能量较低,该元素具有较大的第一电离能。【结论5】+1价 +2价 +3价 +2价 元素电负性的周期性变化 吸引电子能力 越强 增大 减小 【交流与讨论6】 1、同一周期从左到右随着原子
序数的增加,元素的电负性呈现
什么样的变化规律? 2、同一主族从上到下随着原子序数的增加,元素的电负性呈现什么样的变化规律?【结论6】 1、同一周期从左到右随着原子序数的增加,主族元素的电负性逐渐增大。
2、同一主族从上到下随着原子序数的增加,元素的电负性呈现减小的趋势。
2、同一主族从上到下随着原子序数的增加,原子半径依次增大。
【交流与讨论3】 1、同一周期从左到右随着原子序数的增加,元素的主要化合价呈现什么样的变化规律? 2、同一主族从上到下随着原子序数的增加,元素的主要化合价呈现什么样的变化规律?
【结论3】 1、同一周期从左到右随着原子序数的增加,元素的最高正价由+1价递增到+7价 (稀有气体、氧、氟除外) ,且最高正价等于最外层电子数。最低负价由-4价变化到-1价。
2、同主族元素,最高正价等于主族序数。【交流与讨论4】 1、同一周期从左到右随着原子序数的增加,元素金属性和非金属性呈现什么样的变化规律?
2、同一主族从上到下随着原子序数的增加,元素金属性和非金属性呈现什么样的变化规律?
【信息提示】元素的金属性与非金属性强弱
人们在长期的研究中发现,元素的单质和化合物的某些性质有助于判断元素的金属性、非金属性强弱:通常情况下,元素的金属性越强,它的单质越容易从水或酸中置换出氢,该元素最高价氧化物的水化物的碱性越强;元素的非金属性越强,它的单质越容易与氢反应形成气态氢化物,气态氢化物越稳定,该元素最高价氧化物的水化物的酸性越强。
SiH4PH3H2SHClH4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸【结论4】 1、同一周期从左到右随着原子序数的增加,元素金属性逐渐减弱,非金属性逐渐增强。
2、同一主族从上到下随着原子序数的增加,元素的金属性逐渐增强,非金属性逐渐减弱。 元素第一电离能的周期性变化 气态原子 气态阳离子 I1 容易 【交流与讨论5】 1、同一周期从左到右随着原子序数的增加,元素的第一电离能呈现什么样的变化规律? 2、同一主族从上到下随着原子序数的增加,元素的第一电离能呈现什么样的变化规律? 1、同一周期从左到右随着原子序数的增加,第一电离能呈现增大趋势。
2、同一主族从上到下随着原子序数的增加,第一电离能逐渐减小。
3、元素的第一电离能大小还与其原子的核外电子排布(特别是外围电子排布)有关。通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构时,原子的能量较低,该元素具有较大的第一电离能。【结论5】+1价 +2价 +3价 +2价 元素电负性的周期性变化 吸引电子能力 越强 增大 减小 【交流与讨论6】 1、同一周期从左到右随着原子
序数的增加,元素的电负性呈现
什么样的变化规律? 2、同一主族从上到下随着原子序数的增加,元素的电负性呈现什么样的变化规律?【结论6】 1、同一周期从左到右随着原子序数的增加,主族元素的电负性逐渐增大。
2、同一主族从上到下随着原子序数的增加,元素的电负性呈现减小的趋势。
