第三单元 共价键 原子晶体
图片预览







文档简介
课件29张PPT。 版本:苏教版选修3
专题3第三单元
课题:原子晶体化学 · 选修 3 考纲对本节内容的要求:了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系聚焦高考:1、共价键:
2、键能:
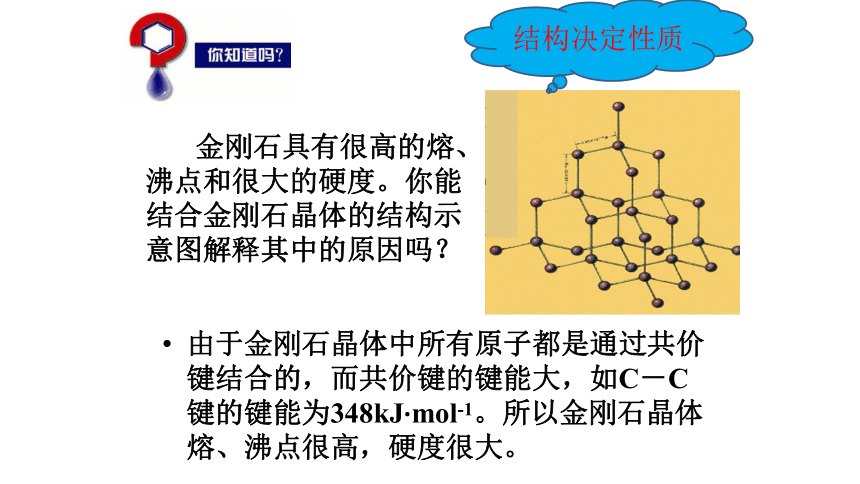
3、键长:知识回顾原子之间通过共用电子对所形成的相互作用。在101kPa、298K条件下,1mol气态AB分子生成气态A原子和气态B原子的过程所吸收的能量,称为AB间共价键的键能。成键两原子间的平均间距。科学视野 从金刚石到钻石金刚石的用途:作玻璃刀,钻头 金刚石具有很高的熔、沸点和很大的硬度。你能结合金刚石晶体的结构示意图解释其中的原因吗?由于金刚石晶体中所有原子都是通过共价键结合的,而共价键的键能大,如C-C键的键能为348kJ·mol-1。所以金刚石晶体熔、沸点很高,硬度很大。结构决定性质阅读课本51页,请思考:1、什么是原子晶体?
2、原子晶体有哪些特性?3、常见的原子晶体有哪些?一、原子晶体1、定义:
2、构成微粒:
3、微粒之间的作用:
4、气化或熔化时破坏的作用力:
5、晶体中没有单个分子存在;化学式只代表原子个数之比归纳总结原子间以共价键相结合而形成的空间网状结构的晶体。
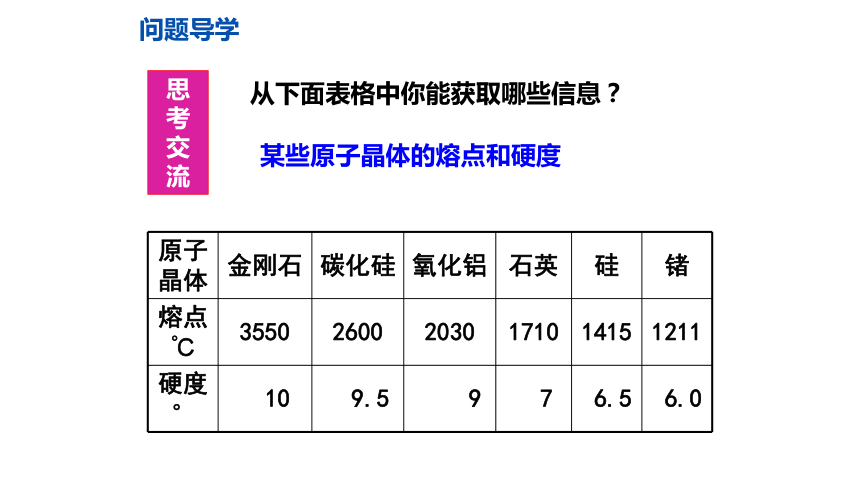
原子共价键共价键 思考交流从下面表格中你能获取哪些信息?某些原子晶体的熔点和硬度问题导学6、原子晶体的物理性质 很高很大不溶一般不导电(硅是半导体)归纳总结结构决定性质7、常见的原子晶体类型:(1)某些非金属单质: 金刚石(C) 硼(B)硅(Si)(2)某些非金属化合物:碳化硅(SiC) 氮化硼 (BN)(3)某些氧化物:二氧化硅( SiO2) Al2O3晶体性质反应结构归纳总结 课堂检测 1、下列晶体中不属于原子晶体的是( )
A、食盐 B、金刚砂 C、金刚石 D、水晶
2、金刚石是典型的原子晶体,下列关于金刚石的说法中错误的是( )
A、晶体中不存在独立的 “分子”
B、碳原子间以共价键相结合
C、是硬度最大的物质之一
D、化学性质稳定,即使在高温下也不会与氧气反应
AD 问题探究晶体硅(Si)和金刚砂(SiC)都是与金刚石相似的原子晶体,请根据表3-6中的数据,分析其熔点、硬度的大小与其结构之间的关系。表3-6 部分原子晶体的键能、键长、熔点和硬度
8、 影响原子晶体熔沸点、硬度大小的因素:共价键的强弱键长的大小一般形成共价键的两原子半径越小键长越小,键能越 大 ,原子晶体的熔沸点越 高 ,硬度越 大 。课堂检测3(1)碳化硅具有类似金刚石结构,其中碳原子和硅原子位置是交替的。在下列三种晶体①金刚石②晶体硅③碳化硅中,它们的熔点从高到低的顺序是
(2)磷化硼(BP )和氮化硼(BN)是受到高度关注的耐磨材料,但氮化硼晶体的熔点要比磷化硼晶体的熔点高原因? 二、典型的原子晶体金刚石键能: 347.7kj/mol熔点:
大于35500C硬度:很大动画分析问题探究8×1/8+6×1/2+4=81.在金刚石晶体中,每个碳原子以共价键跟相邻的 个
C形成正四面 体,且在中心。
2.正四面体向空间延伸成立体网状,所有的C—C键长、键角
3.在金刚石晶体中最小碳环由 碳原子来组成
4.在金刚石晶体中碳原子个数与C-C共价键个数之比是
5.在金刚石晶胞中占有的碳原子数 1 ︰ 26个48个小结:相等提出问题:钻石与水晶都有规则的外形,
与钻石相比,水晶会有什么样的空间结构?
SiO2平面结构利用金刚石的结构来推断SiO2的空间结构金刚石白球表示硅原子180o109o28′SiO共价键三、二氧化硅的晶体结构SiO2晶体结构1. 在SiO2晶体中,每个硅原子与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 。
2. 在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;
3. 在SiO2 晶体中,最小环为 元环。21:24421:41:2124.硅原子个数与Si-O 共价键个数之是 ;氧原子个数与Si-O 共价键个数之比是 。在SiO2 晶胞中硅原子数为
氧原子数为
小结:816判断原子晶体的方法:1、记住常见的原子晶体:
金刚石、晶体Si、SiO2 SiC BN 2、根据结构:空间立体网状3、根据物理特性:耐高温、耐磨材料金属键、离子键和共价键的比较阴阳离子间
的静电作用通过共用电子对产生的相互作用金属离子和自
由电子间的静
电作用无无既有方向性
又有饱和性金属元素的原子半径和单位体积内自由电子数目阴、阳离子的电荷数和核间距键长、成键电子数、极性整理与归纳①判断下列物质含有哪些化学键
NH4Cl Na2O2 Mg H2O2
课堂检测②干冰是二氧化碳的分子晶体,但是已经有科学家在实验室将干冰制成了原子晶体。
那么,同是原子晶体的CO2和SiO2,哪一个硬度大?试说明理由。对本节课内容进行总结提炼课堂小结布置作业:课本P52 :9
练习册谢谢观赏
专题3第三单元
课题:原子晶体化学 · 选修 3 考纲对本节内容的要求:了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系聚焦高考:1、共价键:
2、键能:
3、键长:知识回顾原子之间通过共用电子对所形成的相互作用。在101kPa、298K条件下,1mol气态AB分子生成气态A原子和气态B原子的过程所吸收的能量,称为AB间共价键的键能。成键两原子间的平均间距。科学视野 从金刚石到钻石金刚石的用途:作玻璃刀,钻头 金刚石具有很高的熔、沸点和很大的硬度。你能结合金刚石晶体的结构示意图解释其中的原因吗?由于金刚石晶体中所有原子都是通过共价键结合的,而共价键的键能大,如C-C键的键能为348kJ·mol-1。所以金刚石晶体熔、沸点很高,硬度很大。结构决定性质阅读课本51页,请思考:1、什么是原子晶体?
2、原子晶体有哪些特性?3、常见的原子晶体有哪些?一、原子晶体1、定义:
2、构成微粒:
3、微粒之间的作用:
4、气化或熔化时破坏的作用力:
5、晶体中没有单个分子存在;化学式只代表原子个数之比归纳总结原子间以共价键相结合而形成的空间网状结构的晶体。
原子共价键共价键 思考交流从下面表格中你能获取哪些信息?某些原子晶体的熔点和硬度问题导学6、原子晶体的物理性质 很高很大不溶一般不导电(硅是半导体)归纳总结结构决定性质7、常见的原子晶体类型:(1)某些非金属单质: 金刚石(C) 硼(B)硅(Si)(2)某些非金属化合物:碳化硅(SiC) 氮化硼 (BN)(3)某些氧化物:二氧化硅( SiO2) Al2O3晶体性质反应结构归纳总结 课堂检测 1、下列晶体中不属于原子晶体的是( )
A、食盐 B、金刚砂 C、金刚石 D、水晶
2、金刚石是典型的原子晶体,下列关于金刚石的说法中错误的是( )
A、晶体中不存在独立的 “分子”
B、碳原子间以共价键相结合
C、是硬度最大的物质之一
D、化学性质稳定,即使在高温下也不会与氧气反应
AD 问题探究晶体硅(Si)和金刚砂(SiC)都是与金刚石相似的原子晶体,请根据表3-6中的数据,分析其熔点、硬度的大小与其结构之间的关系。表3-6 部分原子晶体的键能、键长、熔点和硬度
8、 影响原子晶体熔沸点、硬度大小的因素:共价键的强弱键长的大小一般形成共价键的两原子半径越小键长越小,键能越 大 ,原子晶体的熔沸点越 高 ,硬度越 大 。课堂检测3(1)碳化硅具有类似金刚石结构,其中碳原子和硅原子位置是交替的。在下列三种晶体①金刚石②晶体硅③碳化硅中,它们的熔点从高到低的顺序是
(2)磷化硼(BP )和氮化硼(BN)是受到高度关注的耐磨材料,但氮化硼晶体的熔点要比磷化硼晶体的熔点高原因? 二、典型的原子晶体金刚石键能: 347.7kj/mol熔点:
大于35500C硬度:很大动画分析问题探究8×1/8+6×1/2+4=81.在金刚石晶体中,每个碳原子以共价键跟相邻的 个
C形成正四面 体,且在中心。
2.正四面体向空间延伸成立体网状,所有的C—C键长、键角
3.在金刚石晶体中最小碳环由 碳原子来组成
4.在金刚石晶体中碳原子个数与C-C共价键个数之比是
5.在金刚石晶胞中占有的碳原子数 1 ︰ 26个48个小结:相等提出问题:钻石与水晶都有规则的外形,
与钻石相比,水晶会有什么样的空间结构?
SiO2平面结构利用金刚石的结构来推断SiO2的空间结构金刚石白球表示硅原子180o109o28′SiO共价键三、二氧化硅的晶体结构SiO2晶体结构1. 在SiO2晶体中,每个硅原子与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 。
2. 在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;
3. 在SiO2 晶体中,最小环为 元环。21:24421:41:2124.硅原子个数与Si-O 共价键个数之是 ;氧原子个数与Si-O 共价键个数之比是 。在SiO2 晶胞中硅原子数为
氧原子数为
小结:816判断原子晶体的方法:1、记住常见的原子晶体:
金刚石、晶体Si、SiO2 SiC BN 2、根据结构:空间立体网状3、根据物理特性:耐高温、耐磨材料金属键、离子键和共价键的比较阴阳离子间
的静电作用通过共用电子对产生的相互作用金属离子和自
由电子间的静
电作用无无既有方向性
又有饱和性金属元素的原子半径和单位体积内自由电子数目阴、阳离子的电荷数和核间距键长、成键电子数、极性整理与归纳①判断下列物质含有哪些化学键
NH4Cl Na2O2 Mg H2O2
课堂检测②干冰是二氧化碳的分子晶体,但是已经有科学家在实验室将干冰制成了原子晶体。
那么,同是原子晶体的CO2和SiO2,哪一个硬度大?试说明理由。对本节课内容进行总结提炼课堂小结布置作业:课本P52 :9
练习册谢谢观赏
